名校
解题方法
1 . 为验证不同化合价铁的氧化还原能力,利用下列电池装置进行实验。
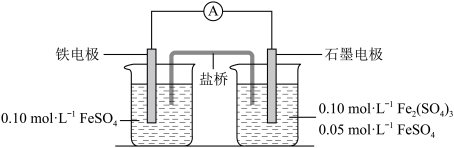
回答下列问题:
(1)电流表显示电子由铁电极流向石墨电极。可知,盐桥中的阳离子进入________ 电极溶液中。
(2)电池反应一段时间后,测得铁电极溶液中c(Fe2+)增加了0.02 mol·L-1。石墨电极上未见Fe析出。可知,石墨电极溶液中c(Fe2+)=________ 。
(3)根据(1)、(2)实验结果,可知石墨电极的电极反应式为___________________ ,铁电极的电极反应式为_______________________________ 。因此,验证了Fe2+氧化性小于________ 、还原性小于________ 。

回答下列问题:
(1)电流表显示电子由铁电极流向石墨电极。可知,盐桥中的阳离子进入
(2)电池反应一段时间后,测得铁电极溶液中c(Fe2+)增加了0.02 mol·L-1。石墨电极上未见Fe析出。可知,石墨电极溶液中c(Fe2+)=
(3)根据(1)、(2)实验结果,可知石墨电极的电极反应式为
您最近一年使用:0次
解题方法
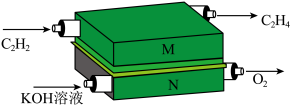
2 . 膜电极反应器具有电阻低、能耗低、结构紧凑等优点,研究人员设计了一种(碱性)膜电极反应器(如图所示)用于持续制备 ,下列说法中正确的是
,下列说法中正确的是
 ,下列说法中正确的是
,下列说法中正确的是
| A.电极M上,反应物和生成物中碳原子的杂化方式相同 |
B.电极N的电极反应式: |
| C.反应后溶液的pH变大 |
D.电极M上产生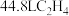 ,转移电子的数目为 ,转移电子的数目为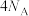 |
您最近一年使用:0次
名校
解题方法
3 . 设计如图装置回收金属钴。保持细菌所在环境pH稳定,借助其降解乙酸盐生成 ,将废旧锂离子电池的正极材料
,将废旧锂离子电池的正极材料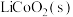 转化为
转化为 ,工作时保持厌氧环境,并定时将乙室溶液转移至甲室。已知电极材料均为石墨材质,右侧装置为原电池。下列说法正确的是
,工作时保持厌氧环境,并定时将乙室溶液转移至甲室。已知电极材料均为石墨材质,右侧装置为原电池。下列说法正确的是
 ,将废旧锂离子电池的正极材料
,将废旧锂离子电池的正极材料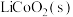 转化为
转化为 ,工作时保持厌氧环境,并定时将乙室溶液转移至甲室。已知电极材料均为石墨材质,右侧装置为原电池。下列说法正确的是
,工作时保持厌氧环境,并定时将乙室溶液转移至甲室。已知电极材料均为石墨材质,右侧装置为原电池。下列说法正确的是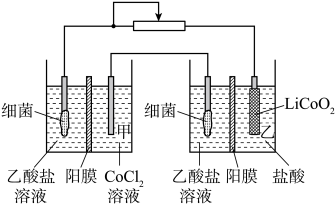
| A.装置工作一段时间后,乙室应补充盐酸 |
| B.装置工作时,甲室溶液pH逐渐增大 |
C.乙室电极反应式为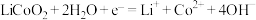 |
D.若甲室 减少200mg,乙室 减少200mg,乙室 增加400mg,则此时已进行过溶液转移 增加400mg,则此时已进行过溶液转移 |
您最近一年使用:0次
2023-12-19更新
|
341次组卷
|
2卷引用:福建省厦门第一中学2023-2024学年高二上学期12月月考化学试卷
解题方法
4 . 甲醇燃料电池在碱性条件下的电池反应为2CH3OH+3O2+4OH-=2CO +6H2O。则下列有关说法不正确的是
+6H2O。则下列有关说法不正确的是
 +6H2O。则下列有关说法不正确的是
+6H2O。则下列有关说法不正确的是| A.O2在正极参与反应 |
| B.该电池使用一段时间后溶液pH变小 |
C.负极反应为:CH3OH-6e-+8OH-=CO +6H2O +6H2O |
| D.每转移0.6 mol电子,则消耗氧气的体积为3.36L |
您最近一年使用:0次
2021-11-13更新
|
602次组卷
|
7卷引用:福建省福州市八县(市)协作校2021-2022学年高二上学期期中联考化学试题
福建省福州市八县(市)协作校2021-2022学年高二上学期期中联考化学试题(已下线)期末综合测试卷02-【上好课】2021-2022学年高二化学选修4同步备课系列(人教版)(已下线)第25讲 化学电源(word讲义)-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)江西省南昌市知行中学2021-2022学年高二上学期12月月考化学试题江苏省宿迁市北大附属宿迁实验学校2022-2023学年高二上学期开学考试化学试题江西省宜春市丰城市2022-2023学年高二上学期1月期末化学试题内蒙古自治区第二地质中学2023-2024学年高二上学期12月期中考试化学试题
名校
解题方法
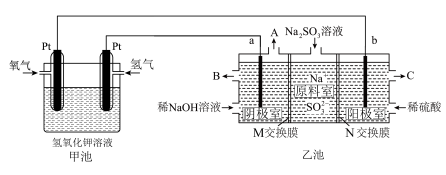
5 . 工业上常用 溶液除去烟气中的
溶液除去烟气中的 ,某小组设计如图所示装置(a、b电极均为石墨),对除硫后产物
,某小组设计如图所示装置(a、b电极均为石墨),对除硫后产物 溶液进行电解,制得
溶液进行电解,制得 和循环再生
和循环再生 。
。_______ 极(填“正”或“负”),写出通入氢气的电极反应式_______ 。
(2)①乙池中阳极室 口流出的是较浓的
口流出的是较浓的 ,则
,则 为
为_______ (填“阳”或“阴”)离子交换膜,写出阳极室的电极反应式_______ 。
②阴极室中 溶液浓度增大的原因是:阴极室中水电离出的
溶液浓度增大的原因是:阴极室中水电离出的_______ (用离子符号或化学式填空,下同)得电子反应生成_______ ,其浓度减小,使溶液中_______ 浓度增大,为了保持阴极室溶液中阴阳离子电荷平衡,_______ 从原料室向阴极室迁移,从而使阴极室中 的浓度增大。
的浓度增大。
(3)在标准状况下,若甲池中有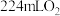 参加反应,理论上乙池可生成
参加反应,理论上乙池可生成_______ 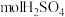 。
。
(4)比能量是指参与反应单位质量的电极材料所能输出电能的多少,电池输出电能与反应的电子转移数目成正比。理论上, 与
与 均作负极时,它们的比能量之比为
均作负极时,它们的比能量之比为_______ 。
 溶液除去烟气中的
溶液除去烟气中的 ,某小组设计如图所示装置(a、b电极均为石墨),对除硫后产物
,某小组设计如图所示装置(a、b电极均为石墨),对除硫后产物 溶液进行电解,制得
溶液进行电解,制得 和循环再生
和循环再生 。
。
(2)①乙池中阳极室
 口流出的是较浓的
口流出的是较浓的 ,则
,则 为
为②阴极室中
 溶液浓度增大的原因是:阴极室中水电离出的
溶液浓度增大的原因是:阴极室中水电离出的 的浓度增大。
的浓度增大。(3)在标准状况下,若甲池中有
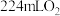 参加反应,理论上乙池可生成
参加反应,理论上乙池可生成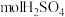 。
。(4)比能量是指参与反应单位质量的电极材料所能输出电能的多少,电池输出电能与反应的电子转移数目成正比。理论上,
 与
与 均作负极时,它们的比能量之比为
均作负极时,它们的比能量之比为
您最近一年使用:0次
2024-01-21更新
|
139次组卷
|
2卷引用:福建省永春第一中学2023-2024学年高一下学期4月月考化学试题
解题方法
6 . 能源与人类的生存和发展息息相关,化学反应在人类利用能源的历史过程中充当重要的角色。回答下列问题:
(1)原电池是直接把化学能转化为电能的装置。据如下装置图,回答下列问题:

①若X为Ag,Y为 溶液,溶液中的
溶液,溶液中的 移向
移向______ (填“Cu”或“X”)电极,当电路中转移0.2 mol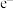 时,电解质溶液质量减少
时,电解质溶液质量减少______ g
②若用如图装置,依据反应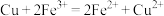 设计原电池,则电极X可以用
设计原电池,则电极X可以用______ (填电极材料)做电极材料,电解质溶液Y的溶质为______ (填化学式),铜极的电极反应式为__________________ 。
(2)航天技术上使用的氢-氧燃料电池具有高能、轻便和不污染环境等优点。如图是氢-氧燃料电池的装置图,则:
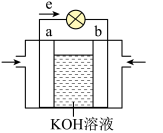
①a电极发生________ (填“氧化”或“还原”)反应。
②b电极附近pH________ 。(填增大、减小或不变)
③负极反应式为:________________________________ 。
(1)原电池是直接把化学能转化为电能的装置。据如下装置图,回答下列问题:

①若X为Ag,Y为
 溶液,溶液中的
溶液,溶液中的 移向
移向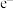 时,电解质溶液质量减少
时,电解质溶液质量减少②若用如图装置,依据反应
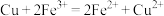 设计原电池,则电极X可以用
设计原电池,则电极X可以用(2)航天技术上使用的氢-氧燃料电池具有高能、轻便和不污染环境等优点。如图是氢-氧燃料电池的装置图,则:

①a电极发生
②b电极附近pH
③负极反应式为:
您最近一年使用:0次
名校
解题方法
7 . 在第十三届阿布扎比国际防务展上,采用先进的氢燃料电池系统的无人机,创造了该级别270分钟续航的新世界记录。下列有关氢燃料电池的说法正确的是
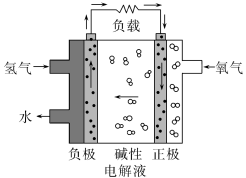

| A.通入氧气的电极发生氧化反应 |
| B.碱性电解液中阳离子向通入氢气的方向移动 |
| C.正极的电极反应式为:O2+2H2O+4e-═4OH- |
| D.放电过程中碱性电解液的浓度不断增大 |
您最近一年使用:0次
2020-07-29更新
|
532次组卷
|
5卷引用:福建省南安市柳城中学2020-2021学年高二上学期期中考试化学试题
8 . 能源是现代文明的原动力,电池与我们的生活和生产密切相关。
(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的_____(填字母)。
(2)下图为原电池装置示意图:
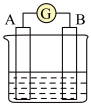
①若A为 片,B为石墨棒,电解质溶液为稀硫酸,写出负极的电极反应式:
片,B为石墨棒,电解质溶液为稀硫酸,写出负极的电极反应式:_____ ,反应过程中溶液的酸性_____ (填“增强”、“减弱”或“不变”)。一段时间后,当电池中放出2.24L(标准状况)气体时,电路中有_____ 个电子通过了导线(用 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。
②若A为镁片,B为铝片,电解质为 溶液,则铝片为
溶液,则铝片为_____ (填“正极”或“负极”);写出该电极的电极反应式:_____ 。
(3)燃料电池是一种具有应用前景的绿色电源, 和
和 组合形成的燃料电池的结构如图(电解质溶液是稀硫酸,质子交换膜只允许
组合形成的燃料电池的结构如图(电解质溶液是稀硫酸,质子交换膜只允许 通过)。则电极d是
通过)。则电极d是_____ (填“正极”或“负极”),则该燃料电池如下:
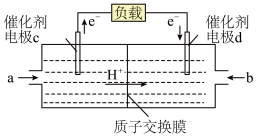
(4)为证明铁的金属活动性比铜强,某同学设计了如下一些方案。其中能证明铁的金属活动性比铜强的方案是
(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的_____(填字母)。
A. |
B.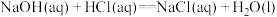 |
C.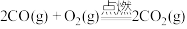 |
D.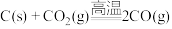 |

①若A为
 片,B为石墨棒,电解质溶液为稀硫酸,写出负极的电极反应式:
片,B为石墨棒,电解质溶液为稀硫酸,写出负极的电极反应式: 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。②若A为镁片,B为铝片,电解质为
 溶液,则铝片为
溶液,则铝片为(3)燃料电池是一种具有应用前景的绿色电源,
 和
和 组合形成的燃料电池的结构如图(电解质溶液是稀硫酸,质子交换膜只允许
组合形成的燃料电池的结构如图(电解质溶液是稀硫酸,质子交换膜只允许 通过)。则电极d是
通过)。则电极d是
(4)为证明铁的金属活动性比铜强,某同学设计了如下一些方案。其中能证明铁的金属活动性比铜强的方案是
| 方案 | 现象或产物 |
A.将铁片置于 溶液中 溶液中 | 铁片上有亮红色物质析出 |
| B.将铁丝和铜丝分别在氯气燃烧 | 产物分别为 和 和 |
| C.将铁片和铜片分别置于稀硫酸溶液中 | 铁片上有气泡产生,铜片上无气泡产生 |
| D.将铁片和铜片置于盛有稀硫酸的烧杯中,并用导线连 | 铁片溶解,铜片上有气泡产生 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
9 . 已知氧化性:Au3+>Ag+>Cu2+>Pb2+>Cr3+>Zn2+>Ti2+。现有如图所示的电化学装置,下列叙述中正确的是
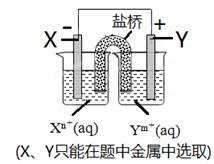

| A.若X为Ti,则Y极的电极反应式可能是Zn-2e-=Zn2+ |
| B.若X为Cr,则Y可以选Zn或Ti |
| C.若Y为Cu,则X极的电极反应式可能是Cr-3e-=Cr3+ |
| D.若Y为Pb,则Xn+(aq)中阴离子数会减少 |
您最近一年使用:0次
2016-12-09更新
|
1336次组卷
|
10卷引用:福建省晋江市季延中学2018-2019学年高二(理)上学期期中考试化学试题
福建省晋江市季延中学2018-2019学年高二(理)上学期期中考试化学试题(已下线)2013-2014学年江西省鹰潭一中高二上学期期中考试化学试卷山东省济南市山东师范大学附属中学2020-2021学年高二上学期10月学业质量检测化学试题河南省郑州市第106中学2020-2021学年高二上学期9月月考化学(理)试题(已下线)第四章 电化学基础(能力提升)-2020-2021学年高二化学单元测试定心卷(人教版选修4)山东省德州市夏津第一中学2021-2022学年高二上学期第一次月考化学试卷山东省枣庄市第三中学2021-2022学年高二10月月考化学试题江西省崇义中学2020-2021学年高一上学期期中考试(A卷)化学试题(已下线)4.1.1 原电池的工作原理(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)第一节 原电池 第1课时 原电池的工作原理



