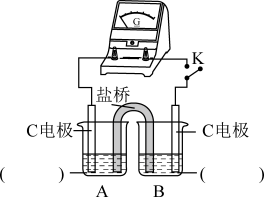
1 . 物质中的化学能在一定条件下可转化为电能。请依据下图原电池装置回答下列问题。
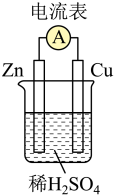
(1)该装置将反应___________ (写离子方程式)释放的能量直接转化为电能,能证明产生电能的实验现象是:_____________ 。
(2)下列关于该装置说法正确的是:_________ (填字母)。
A.Zn为原电池的正极
B.电子从Cu经导线流向Zn
C.Cu的作用是导电、提供H+得电子的场所
(3)下列反应通过原电池装置,可实现化学能直接转化为电能的是______ (填字母)。
A.2H2+O2 2H2O
2H2O
B.Zn+Cu2+=Zn2++Cu
C.Na2CO3+2HCl=2NaCl+H2O+CO2↑

(1)该装置将反应
(2)下列关于该装置说法正确的是:
A.Zn为原电池的正极
B.电子从Cu经导线流向Zn
C.Cu的作用是导电、提供H+得电子的场所
(3)下列反应通过原电池装置,可实现化学能直接转化为电能的是
A.2H2+O2
 2H2O
2H2OB.Zn+Cu2+=Zn2++Cu
C.Na2CO3+2HCl=2NaCl+H2O+CO2↑
您最近一年使用:0次
2020-09-21更新
|
254次组卷
|
2卷引用:北京市丰台区2020年普通高中合格性考试调研化学试题
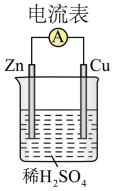
2 . 化学电池的发明,是贮能和供能技术的巨大进步。______ (填“正极”或“负极”)。
(2)装置中锌片上发生_____ (“氧化”或“还原”)反应,写出负极发生的电极反应式______ 。
(3)电子流动的方向是________ (“Zn→Cu”或“Cu→Zn”)。
(4)上图所示装置可将_______ (写离子方程式)反应释放的能量 直接转变为电能;能证明产生电能的实验现象是________ 。
(5)2019 年诺贝尔化学奖授予对锂离子电池研究做出突出贡献的科学家。某锂离子电池的工作原理如下。___________ (填序号)。
①A为电池的正极 ②该装置实现了化学能转化为电能
③电池工作时,电池内部的锂离子定向移动
(2)装置中锌片上发生
(3)电子流动的方向是
(4)上图所示装置可将
(5)2019 年诺贝尔化学奖授予对锂离子电池研究做出突出贡献的科学家。某锂离子电池的工作原理如下。
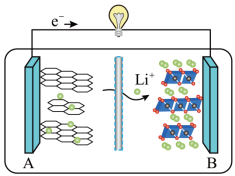
①A为电池的正极 ②该装置实现了化学能转化为电能
③电池工作时,电池内部的锂离子定向移动
您最近一年使用:0次
2024-01-06更新
|
32次组卷
|
2卷引用:四川省眉山市仁寿第一中学校(北校区)2023-2024学年高二上学期11月期中化学试题
3 . 电能是现代社会应用最广泛的能源之一、某原电池装置如图所示。其中,
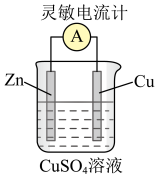
(1)Zn电极为原电池的___________ 极 (填“正” 或“负”)
(2)Cu电极上发生的电极反应式是___________ 。
(3)能证明产生电能的实验现象是___________ 。
(4)2019 年诺贝尔化学奖授予对锂离子电池研究做出突出贡献的科学家。某锂离子电池的工作原理如下。下列说法正确的是___________ (填序号)。
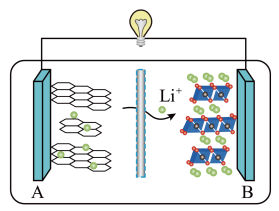
①A为电池的正极
②该装置实现了化学能转化为电能
③电池工作时,电池内部的锂离子定向移动

(1)Zn电极为原电池的
(2)Cu电极上发生的电极反应式是
(3)能证明产生电能的实验现象是
(4)2019 年诺贝尔化学奖授予对锂离子电池研究做出突出贡献的科学家。某锂离子电池的工作原理如下。下列说法正确的是

①A为电池的正极
②该装置实现了化学能转化为电能
③电池工作时,电池内部的锂离子定向移动
您最近一年使用:0次
名校
解题方法
4 . 如图装置,能溶解辉铜矿石(主要成分是Cu2S)制得硫酸铜。下列说法正确的是
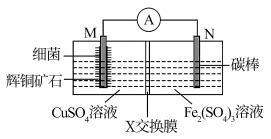

| A.X交换膜可以是阳离子交换膜 |
B.M极上的电极反应式为Cu2S+10e-+4H2O=2Cu2++8H++SO |
| C.为证明右侧产物,可取少量溶液加入K3[Fe(CN)6]溶液,观察是否有蓝色沉淀 |
| D.M极的电势高于N极的电势 |
您最近一年使用:0次
2023-11-11更新
|
321次组卷
|
2卷引用:福建省福州市八县一中2023-2024学年高二上学期11月期中化学试题
5 . 实验室探究NaHSO3溶液与Cu2+的反应。
I.如图所示制备(经检验装置气密性良好)。
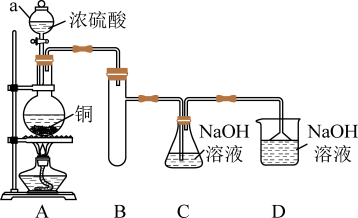
(1)仪器a的名称是___________ ,装置D的作用为___________ 。
(2)写出C中制备NaHSO3的离子方程式___________ 。
Ⅱ.探究NaHSO3溶液与Cu2+的反应,过程如图所示:
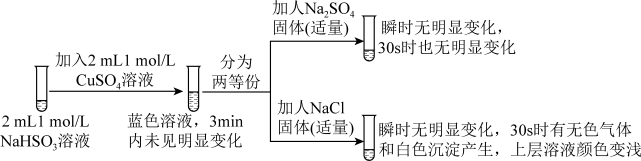
已知:硫酸亚铜易溶于水。回答下列问题:
(3)加入NaCl固体后产生的无色气体和白色沉淀经检验分别是SO2和CuCl,说明发生了氧化还原反应。加入NaCl固体发生反应的原因:
a.Cl-改变了 的还原性 b.Cl-改变了Cu2+的氧化性
的还原性 b.Cl-改变了Cu2+的氧化性
用原电池原理进行试验,探究上述现象可能的原因。
①由实验1、2可知原因a不合理,依据是___________ 。
②实验3:用如图所示装置实验,B中有白色沉淀生成,证明原因b合理。
i.补全电化学装置示意图A________________ 、B_____________________ 。
ii.写出B中的电极反应方程式___________ 。
iii.请从反应原理的角度解释原因:Cl-与Cu2+的还原产物Cu+形成沉淀,___________ ,使 与Cu2+的反应能够反应完全。
与Cu2+的反应能够反应完全。
I.如图所示制备(经检验装置气密性良好)。

(1)仪器a的名称是
(2)写出C中制备NaHSO3的离子方程式
Ⅱ.探究NaHSO3溶液与Cu2+的反应,过程如图所示:

已知:硫酸亚铜易溶于水。回答下列问题:
(3)加入NaCl固体后产生的无色气体和白色沉淀经检验分别是SO2和CuCl,说明发生了氧化还原反应。加入NaCl固体发生反应的原因:
a.Cl-改变了
 的还原性 b.Cl-改变了Cu2+的氧化性
的还原性 b.Cl-改变了Cu2+的氧化性用原电池原理进行试验,探究上述现象可能的原因。
| 编号 | 实验1 | 实验2 |
| 实验 | 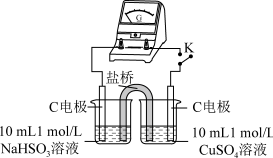 |  |
| 现象 | 闭合开关K,电流计指针发生微小偏 转,烧杯中未见明显现象 | 闭合开关K,电流计指针发生微小偏 转,烧杯中未见明显现象 |
②实验3:用如图所示装置实验,B中有白色沉淀生成,证明原因b合理。

i.补全电化学装置示意图A
ii.写出B中的电极反应方程式
iii.请从反应原理的角度解释原因:Cl-与Cu2+的还原产物Cu+形成沉淀,
 与Cu2+的反应能够反应完全。
与Cu2+的反应能够反应完全。
您最近一年使用:0次
6 . 野外焊接钢轨的原理如图所示
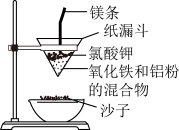
(1)写出铝粉参加反应的化学方程式:__________________ ,该反应的混合物称为:____________ 。铝能用于冶炼难熔金属,是因为:①铝还原性强,②____________
(2)反应所得块状熔融物中很可能含有金属铝,能证明含金属铝的化学试剂为:______
(3)能说明Fe粉与S粉的反应是放热反应的实验现象是:________________________
(4)原电池是把______ 能转化为______ 能的装置。
铜-锌稀硫酸原电池的总反应的离子反应方程式为__________ ;
正极的电极反应式:_____________ ;
相关判断正确的是________ ;
A.质量减轻的电极是正极 B.发生还原反应的是负极
C.锌电极是负极 D.电子从铜片流出

(1)写出铝粉参加反应的化学方程式:
(2)反应所得块状熔融物中很可能含有金属铝,能证明含金属铝的化学试剂为:
(3)能说明Fe粉与S粉的反应是放热反应的实验现象是:
(4)原电池是把
铜-锌稀硫酸原电池的总反应的离子反应方程式为
正极的电极反应式:
相关判断正确的是
A.质量减轻的电极是正极 B.发生还原反应的是负极
C.锌电极是负极 D.电子从铜片流出
您最近一年使用:0次
解题方法
7 . 化学能在一定条件下可转化为电能。
(1)如图装置中,Zn片发生___________ 反应(填“氧化”或“还原”),Cu片上发生反应的电极反应式为___________ ,能证明化学能转化为电能的实验现象是___________ 。
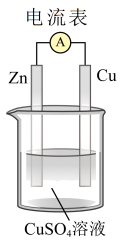
(2)下列反应通过原电池装置,可将化学能转化为电能的是___________ (填字母)。
a.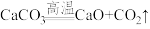 b.
b. c.
c.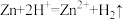
(3)某镁-海水电池工作原理如图所示,其总反应为: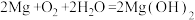 。下列说法正确的是
。下列说法正确的是___________ 。(填字母)
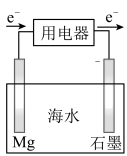
a.Mg作电池的正极 b.O2发生还原反应
(1)如图装置中,Zn片发生

(2)下列反应通过原电池装置,可将化学能转化为电能的是
a.
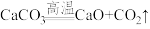 b.
b. c.
c.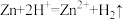
(3)某镁-海水电池工作原理如图所示,其总反应为:
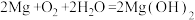 。下列说法正确的是
。下列说法正确的是
a.Mg作电池的正极 b.O2发生还原反应
您最近一年使用:0次
名校
8 . I.如图是利用电化学装置将SO2转化为重要的化工原料H2SO4的原理示意图。
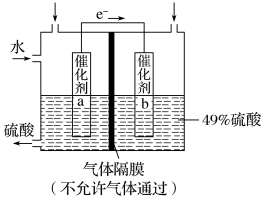
请回答下列问题:
(1)该装置将_______ 能转化为______ 能。
(2)催化剂b表面O2发生_______ 反应,其附近溶液酸性______ (填“增强”、“不变”或“减弱”)。
(3)催化剂a表面的电极反应式:_______ 。
II.某废料铁泥主要成分是Fe2O3、FeO和Fe,其他杂质不与硫酸反应。实验室用该废料提取Fe2O3,设计实验流程如图:

(4)步骤(I)充分反应后进行的实验操作名称是______ 。
(5)步骤(II)中加入H2O2溶液后需要适当加热但温度不能过高,原因是______ 。
(6)为了检验溶液B中是否有亚铁离子剩余,有同学提出只需要取少量溶液B于试管中并向其中滴加氢氧化钠溶液,然后观察现象即可证明。请你判断该同学的方法是否可行并说出理由______ 。
(7)步骤(III)中将NaOH溶液换成氨气也可以得到Fe(OH)3沉淀,反应的离子方程式为______ 。

请回答下列问题:
(1)该装置将
(2)催化剂b表面O2发生
(3)催化剂a表面的电极反应式:
II.某废料铁泥主要成分是Fe2O3、FeO和Fe,其他杂质不与硫酸反应。实验室用该废料提取Fe2O3,设计实验流程如图:

(4)步骤(I)充分反应后进行的实验操作名称是
(5)步骤(II)中加入H2O2溶液后需要适当加热但温度不能过高,原因是
(6)为了检验溶液B中是否有亚铁离子剩余,有同学提出只需要取少量溶液B于试管中并向其中滴加氢氧化钠溶液,然后观察现象即可证明。请你判断该同学的方法是否可行并说出理由
(7)步骤(III)中将NaOH溶液换成氨气也可以得到Fe(OH)3沉淀,反应的离子方程式为
您最近一年使用:0次
2023-05-19更新
|
705次组卷
|
2卷引用:贵州省遵义市仁怀市高中教育联盟2022-2023学年高一下学期5月期中考试化学试题
名校
9 . 化学电池的发明,改变了人们的生活。
(1)如图所示装置中, 片作
片作___________ (填“正极”或“负极”)。
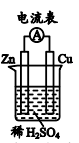
(2) 片上发生反应的电极反应式为
片上发生反应的电极反应式为___________ ;能证明化学能转化为电能的实验现象是:___________ 、铜片上产生大量气泡。
(3)常见的锌锰干电池构造示意图如下。
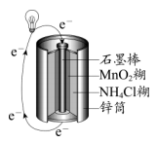
已知:电池的总反应为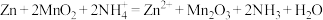
下列说法正确的是___________ (填字母)。
a.锌筒作负极
b. 发生氧化反应
发生氧化反应
(1)如图所示装置中,
 片作
片作
(2)
 片上发生反应的电极反应式为
片上发生反应的电极反应式为(3)常见的锌锰干电池构造示意图如下。

已知:电池的总反应为
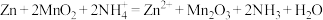
下列说法正确的是
a.锌筒作负极
b.
 发生氧化反应
发生氧化反应
您最近一年使用:0次
解题方法
10 . 回答下列问题。
(1)补齐物质及其用途的连线。

________________ 。
(2)化学电池的发明,是贮能和供能技术的巨大进步。
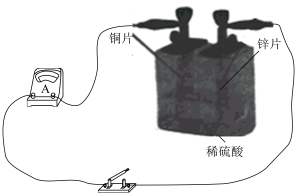
①上图所示装置中, 片作
片作___________ (填“正极”或“负极”), 片上发生反应的电极反应式为
片上发生反应的电极反应式为___________ 。
②上图所示装置可将___________ (写离子反应方程式)反应释放的能量直接转变为电能;能证明产生电能的实验现象是___________ 。
(3)镁、石墨、海水溶解氧可构成原电池,为水下小功率设备长时间供电,其结构示意图如下图所示。该原电池的总反应为: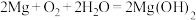 。
。
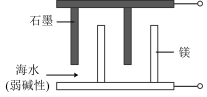
下列说法正确的是___________ (填字母)。
a.石墨是电池的负极
b. 发生氧化反应
发生氧化反应
c.当有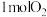 参与反应时转移电子
参与反应时转移电子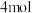
(1)补齐物质及其用途的连线。

(2)化学电池的发明,是贮能和供能技术的巨大进步。

①上图所示装置中,
 片作
片作 片上发生反应的电极反应式为
片上发生反应的电极反应式为②上图所示装置可将
(3)镁、石墨、海水溶解氧可构成原电池,为水下小功率设备长时间供电,其结构示意图如下图所示。该原电池的总反应为:
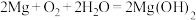 。
。
下列说法正确的是
a.石墨是电池的负极
b.
 发生氧化反应
发生氧化反应c.当有
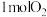 参与反应时转移电子
参与反应时转移电子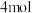
您最近一年使用:0次



