1 . 如图所示,组成原电池,回答下列问题。
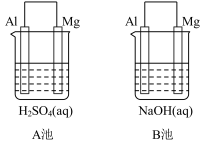
(1)该装置是把___________ 能转化为_________ 能的装置。
(2)A池中Mg电极是__________ (填“正”或“负”)极,其在反应中_____ (填“得到”或“失去”)电子,该极发生的反应是__________ (填“氧化”或“还原”)反应,其电极反应为________________________ ,该装置中电流的方向是由_____ 到 ______ 。
(3)B池中负极材料是_________ ,该装置中电子的移动方向是由_____ 到 ______ 。

(1)该装置是把
(2)A池中Mg电极是
(3)B池中负极材料是
您最近一年使用:0次
2019-06-17更新
|
293次组卷
|
2卷引用:(鲁科版2019)必修第二册 第2章 化学键 化学反应规律 第2节 化学反应与能量转化 第2课时 化学反应能量转化的重要应用——化学电池
2 . (1)下列装置属于原电池的是___________ ;
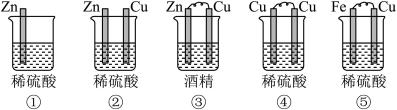
(2)在选出的原电池中,______ 是负极,发生______ (氧化、还原) 反应 ,______ 是正极 ,该极的现象___________________________ ;
(3)在该原电池的内电路中,硫酸根离子移向_________ (正、负)极。
(4)此原电池反应的化学方程式为___________________________ 。

(2)在选出的原电池中,
(3)在该原电池的内电路中,硫酸根离子移向
(4)此原电池反应的化学方程式为
您最近一年使用:0次
名校
解题方法
3 . 将纯锌片和纯铜片按图方式插入100 mL相同浓度的稀硫酸中一段时间,请回答下列问题:
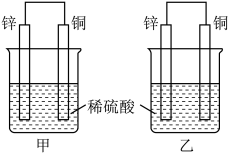
(1)下列说法正确的是________ 。
A.甲、乙均为化学能转变为电能的装置
B.乙中铜片上没有明显变化
C.甲中铜片质量减少、乙中锌片质量减少
D.两烧杯中溶液的pH均增大
(2)在相同时间内,两烧杯中产生气泡的速度:甲____ 乙(填“>”、“<“或“=”)。
(3)当甲中产生1.12L(标准状况)气体时,通过导线的电子数目为__________ 。
(4)当乙中产生1.12L(标准状况)气体时,将锌、铜片取出,再将烧杯中的溶液稀释至1 L,测得溶液中c(H+)=0.1 mol·L-1(设反应前后溶液体积不变)。试确定原稀硫酸的物质的量浓度为______ 。
(5)利用下列反应:Fe+2Fe3+=3Fe2+制一个化学电池(给出若干导线和一个小灯泡,电极材料和电解液自选),画出实验装置图,注明电解质溶液名称和正负极材料,标出电流方向,写出电极反应式。___

_______ 是正极,正极反应式:_____________ ;
________ 是负极,负极反应式:____________
(6)1958年世界上第一个心脏起搏器在瑞典植入人体成功,使用寿命长达10年之久。这种能源起搏器中安装寿命最长、可靠性最高的锂一碳电池,这种电池容量大,电压稳定,能在-56.7~71.1℃温度范围内正常工作。现已在火箭、移动电话、笔记本电脑中广泛使用。它采用锂和石墨作电极,四氯化铝锂(LiAlCl4)溶解在亚硫酰氯中(SOCl2)组成电解质溶液。电池总反应为:8Li+3SOCl2=6LiCl+Li2SO3+2S,此电池中__ 作正极,负极的电极反应为_______ 。

(1)下列说法正确的是
A.甲、乙均为化学能转变为电能的装置
B.乙中铜片上没有明显变化
C.甲中铜片质量减少、乙中锌片质量减少
D.两烧杯中溶液的pH均增大
(2)在相同时间内,两烧杯中产生气泡的速度:甲
(3)当甲中产生1.12L(标准状况)气体时,通过导线的电子数目为
(4)当乙中产生1.12L(标准状况)气体时,将锌、铜片取出,再将烧杯中的溶液稀释至1 L,测得溶液中c(H+)=0.1 mol·L-1(设反应前后溶液体积不变)。试确定原稀硫酸的物质的量浓度为
(5)利用下列反应:Fe+2Fe3+=3Fe2+制一个化学电池(给出若干导线和一个小灯泡,电极材料和电解液自选),画出实验装置图,注明电解质溶液名称和正负极材料,标出电流方向,写出电极反应式。

(6)1958年世界上第一个心脏起搏器在瑞典植入人体成功,使用寿命长达10年之久。这种能源起搏器中安装寿命最长、可靠性最高的锂一碳电池,这种电池容量大,电压稳定,能在-56.7~71.1℃温度范围内正常工作。现已在火箭、移动电话、笔记本电脑中广泛使用。它采用锂和石墨作电极,四氯化铝锂(LiAlCl4)溶解在亚硫酰氯中(SOCl2)组成电解质溶液。电池总反应为:8Li+3SOCl2=6LiCl+Li2SO3+2S,此电池中
您最近一年使用:0次
2019-04-19更新
|
394次组卷
|
2卷引用:高中化学苏教2019版必修第二册-专题6 第三单元 第1课时 化学能转化为电能
解题方法
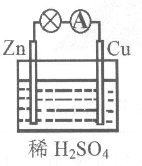
4 . 某原电池装置如图所示。
(1)负极的电极反应式是________ ,该反应属于_______ (填“氧化”或“还原”)反应。
(2)电子由________ (填“锌片”或“铜片”)沿导线流出。
(3)当铜表面析出0.224 L氢气(标准状况)时,导线中通过了________ mol电子。
(1)负极的电极反应式是
(2)电子由
(3)当铜表面析出0.224 L氢气(标准状况)时,导线中通过了
您最近一年使用:0次
2018-09-20更新
|
369次组卷
|
4卷引用:北京市第三十一中学2020—2021学年度高一下学期期中考试化学试题
北京市第三十一中学2020—2021学年度高一下学期期中考试化学试题【全国区级联考】北京市西城区2017-2018学年下学期高一年级期末考试化学试题(已下线)2019年4月9日《每日一题》 必修2 原电池极性的判断与电极反应式的书写湖北省黄冈市黄梅国际育才高级中学2019-2020学年高一下学期期中考试化学试题
名校
5 . 在银锌原电池中,以硫酸铜为电解质溶液,锌为_____ 极,电极上发生的是_____ 反应(“氧化”或“还原”).电极反应式为_____ ,锌片上观察到的现象为_____ 银为_____ 极,电极上发生的是_____ 反应(“氧化”或“还原”),电极反应式是_____ ,银片上观察到的现象是_____ .
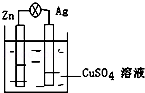

您最近一年使用:0次
2018-04-10更新
|
850次组卷
|
10卷引用:广西钦州市第四中学2020-2021学年高一下学期4月月考化学试题2
广西钦州市第四中学2020-2021学年高一下学期4月月考化学试题2河北省故城县高级中学2017-2018学年高一3月月考化学试题宁夏青铜峡市高级中学2017-2018学年高一下学期期中考试化学试题陕西省渭南市临渭区尚德中学2019-2020学年高一下学期网络教学调研评估检测化学试题黑龙江省鸡西市鸡东县第二中学2019-2020学年高一下学期线上考试化学试题甘肃省靖远县第四中学2019-2020学年高一下学期期中考试化学(普通班)试题云南省玉龙纳西族自治县田家炳民族中学2019-2020学年高一下学期期中考试化学(理)试题河北省石家庄市元氏县第四中学2019-2020学年高一下学期期中考试化学试题吉林省汪清县第六中学2020-2021学年高二上学期期末考试化学试题陕西省安康市汉滨区江北高级中学2020-2021学年高一下学期第二次月考化学试题
名校
解题方法
6 . 原电池是一种将________ 能转化为_______ 能的装置。如图所示的原电池装置中,锌片发生_________ (填“氧化”或“还原”)反应。铜片上能够观察到的现象是_______________ ,该电极反应式是____________________________ 。
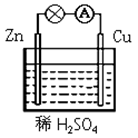

您最近一年使用:0次
2017-06-30更新
|
875次组卷
|
4卷引用:安徽省安庆市九一六学校2020—2021学年高一4月月考化学试题
名校
7 . 有甲、乙两位学生均想利用原电池反应检测金属的活动性顺序,两人均使用镁片与铝片作电极,但甲同学将电极放入2mol•L﹣1H2SO4溶液中,乙同学将电极放入2mol•L﹣1的NaOH溶液中,如图所示:

(1)甲池中,镁片上发生_____ (填“氧化”或“还原”)反应,硫酸根离子往_____ (填“正极”或“负极”)迁移;写出甲池中正极的电极反应式:_____ 。
(2)写出乙池中负极的电极反应式:_____ 。
(3)如果甲与乙同学均认为“构成原电池的电极材料如果都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出_____ 活动性更强,而乙会判断出_____ 活动性更强(填写元素符号)。
(4)由此实验,以下结论正确的是_____ 。
A.利用原电池反应判断金属活动顺序时应注意选择合适的介质
B.镁的金属性不一定比铝的金属性强
C.该实验说明金属活动顺序表已过时,已没有实用价值
D.该实验说明化学研究对象复杂、反应受条件影响较大,因此应具体问题具体分析

(1)甲池中,镁片上发生
(2)写出乙池中负极的电极反应式:
(3)如果甲与乙同学均认为“构成原电池的电极材料如果都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出
(4)由此实验,以下结论正确的是
A.利用原电池反应判断金属活动顺序时应注意选择合适的介质
B.镁的金属性不一定比铝的金属性强
C.该实验说明金属活动顺序表已过时,已没有实用价值
D.该实验说明化学研究对象复杂、反应受条件影响较大,因此应具体问题具体分析
您最近一年使用:0次
2016-12-09更新
|
225次组卷
|
5卷引用:黑龙江省牡丹江市海林市朝鲜族中学2020-2021学年高一5月月考化学试题
8 . 利用化学反应将存储在物质内部的化学能转化为电能,科学家设计出了原电池,从而为人类生产、生活提供能量。
(1)甲同学认为,所有的氧化还原反应都可以设计成原电池,你是否同意________ (填“是”或“否”)。若不同意,请你试举一例,写出相应的化学方程式:_________________
(2)乙同学依据氧化还原反应:2Ag+ +Cu=Cu2+ + 2Ag设计的原电池如图所示:
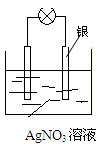
①负极的材料是___ ,发生的电极反应为____________ ;
②外电路中的电子是从____ 电极流向____ 电极。(写出电极材料的名称)
③当反应进行到一段时间后取出电极材料,测得某一电极增重了5.4g,则该原电池反应共转移了的电子数目是____________ ;
④请指出该原电池装置的一个缺点:____________ 。
(1)甲同学认为,所有的氧化还原反应都可以设计成原电池,你是否同意
(2)乙同学依据氧化还原反应:2Ag+ +Cu=Cu2+ + 2Ag设计的原电池如图所示:

①负极的材料是
②外电路中的电子是从
③当反应进行到一段时间后取出电极材料,测得某一电极增重了5.4g,则该原电池反应共转移了的电子数目是
④请指出该原电池装置的一个缺点:
您最近一年使用:0次
2016-12-09更新
|
297次组卷
|
3卷引用:吉林省长白朝鲜族自治县实验中学2020-2021学年高一下学期第二次月考化学试题
真题
名校
9 . Li—SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解质溶液是LiAlCl4—SOCl2。电池的总反应可表示为4Li+2SOCl2===4LiCl+S+SO2↑。请回答下列问题:
(1)电池的负极材料为________ ,发生的电极反应为__________________ 。
(2)电池正极发生的电极反应为___________________________ 。
(3)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。如果把少量水滴到SOCl2中,实验现象是___________________ ,反应的化学方程式为______ 。
(4)组装该电池必须在无水、无氧的条件下进行,原因是__________________ 。
(1)电池的负极材料为
(2)电池正极发生的电极反应为
(3)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。如果把少量水滴到SOCl2中,实验现象是
(4)组装该电池必须在无水、无氧的条件下进行,原因是
您最近一年使用:0次
2016-12-09更新
|
2981次组卷
|
22卷引用:云南省新平一中2020-2021学年高一下学期期中考试化学试题
云南省新平一中2020-2021学年高一下学期期中考试化学试题(已下线)2010—2011浙江省嘉兴一中高一下学期期中考试化学试卷(已下线)2012-2013学年四川省成都七中高一下学期期末考试化学试卷江西省南昌市八一中学、洪都中学、麻丘中学等六校2016-2017学年高一5月联考化学试题高中化学人教版 选修四 第四章 电化学基础 第二节 化学电源 化学电源2017-2018学年高一化学人教版必修2:第二章检测题(已下线)2019年3月24日 《每日一题》 必修2 每周一测人教版本必修二高中化学第二章《化学反应与能量》测试卷(已下线)1.2.2 化学电源(备作业)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)课后-6.1.3 设计原电池、化学电源-人教2019必修第二册湖北省襄阳市襄州区第二高级中学2021-2022学年高一下学期期中考试化学试题山东省临沂第四中学2022-2023学年高一下学期6月月考化学试题山西省阳泉市城区瑞源教育培训学校2023-2024学年高一下学期4月联考化学试题2009年普通高等学校招生统一考试化学试题(海南卷)(已下线)2011-2012学年江苏省南京三中高二下学期期末考试化学选修试卷2015-2016学年河北省文安一中高二上学期第一次月考化学试卷(已下线)同步君 选修4 第4章 第2节 化学电源陕西省西安市长安区第一中学2017-2018学年高二上学期第二次月考化学试题(已下线)2018年11月26日 《每日一题》人教选修4 - 一次电池的工作原理(已下线)2019年11月25日《每日一题》化学人教版(选修4)—— 一次电池的工作原理2020届高考化学二轮复习大题精准训练——高考大题中方程式(电极、氧化还原、热化学)书写专练(已下线)1.2.2 化学电源 练习《新教材同步备课》(鲁科版选择性必修1)
9-10高一下·河北石家庄·期末
10 . 下图为Zn-Cu原电池的示意图,请回答:
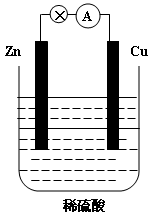
(1)锌片为原电池的______________ (填“正”或“负”)极,该极的电极反应式是___________ 。该反应属于_______________ (填“氧化”或“还原”)反应。
(2)__________ (填“电子”或“电流”)从锌片通过导线流向铜片,溶液中H+的从_________ (填“锌片”或“铜片”)获得电子。
(3)原电池工作一段时间后,H2SO4溶液的浓度_________ (填“增大”或“减小”,下同),烧杯中溶液的质量__________ 。
(4)若锌片质量减轻6.5g,则另一极放出气体的体积为_________ L(标准状况)。

(1)锌片为原电池的
(2)
(3)原电池工作一段时间后,H2SO4溶液的浓度
(4)若锌片质量减轻6.5g,则另一极放出气体的体积为
您最近一年使用:0次
2015-12-15更新
|
343次组卷
|
4卷引用:新疆巴楚县第一中学2020-2021学年高一年级下学期化学期中考试试题



