名校
1 . 浓差电池是一种利用电解质溶液浓度差产生电势差而形成的电池,理论上当电解质溶液的浓度相等时停止放电。图1为浓差电池,图2为电渗析法制备磷酸二氢钠,用浓差电池为电源完成电渗析法制备磷酸二氢钠。下列说法正确的是
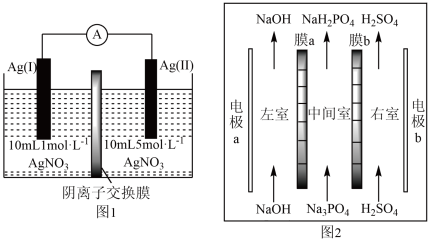
| A.电极Ag(II)的电极反应式为:Ag-e-=Ag+ |
| B.电渗析装置中膜a、b均为阳离子交换膜 |
| C.电渗析过程中左室中NaOH浓度增大,右室H2SO4的浓度减小 |
| D.电池从开始到停止放电,理论上可制备2.4gNaH2PO4 |
您最近一年使用:0次
2024-03-11更新
|
270次组卷
|
2卷引用:四川省成都外国语学校2023-2024学年高三上学期期末考试理科综合试题-高中化学
2 . (1)下列装置属于原电池的是___________ ;
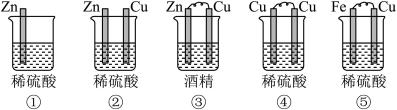
(2)在选出的原电池中,______ 是负极,发生______ (氧化、还原) 反应 ,______ 是正极 ,该极的现象___________________________ ;
(3)在该原电池的内电路中,硫酸根离子移向_________ (正、负)极。
(4)此原电池反应的化学方程式为___________________________ 。

(2)在选出的原电池中,
(3)在该原电池的内电路中,硫酸根离子移向
(4)此原电池反应的化学方程式为
您最近一年使用:0次
名校
3 . Ⅰ.(1)将锌片和银片浸入稀硫酸中组成原电池,两电极间连接一个电流表。原电池工作时电子是从_____ 到______ (填锌片或银片),锌片电极上发生的是_______________ 反应(“氧化”或“还原”)。电极反应式为_________________________________ ,锌片上观察到的现象为___________
(2)银片上发生的是____________ 反应(“氧化”或“还原”),电极反应式是__________ ,银片上观察到的现象是______________________ 溶液中的C(H+)____________ (填“增大”或“减小”)。
(3)若该电池中两电极的总质量为60 g,工作一段时间后,取出锌片和银片洗净干燥后称重,总质量为47 g,试计算:产生氢气的体积为________ L(标准状况);导线中通过的电子数为______ 。
Ⅱ.根据反应:CuCl2 + Fe= FeCl2 + Cu 设计原电池:
(1)在该原电池中,以__________ (写名称)为电解质溶液,铁为______ 极,电极反应式为_______ ,
(2)在该原电池中,选__________ (写名称)作正极,电极反应式是__________________________
(3)画出装置图,标出正、负极材料及电解质溶液名称____________________ 。
(2)银片上发生的是
(3)若该电池中两电极的总质量为60 g,工作一段时间后,取出锌片和银片洗净干燥后称重,总质量为47 g,试计算:产生氢气的体积为
Ⅱ.根据反应:CuCl2 + Fe= FeCl2 + Cu 设计原电池:
(1)在该原电池中,以
(2)在该原电池中,选
(3)画出装置图,标出正、负极材料及电解质溶液名称
您最近一年使用:0次
名校
4 . 由A、B、C、D四种金属按下表中装置进行实验。
根据实验现象回答下列问题:
(1)装置甲中作正极的是__________________ (填“A”或“B”) ;
(2)装置乙溶液中C电极反应:__________________________________ ;装置乙中反应一段时间后,测得C电极 的质量增加12.8克,则该电池反应转移电子的物质的量为___________ mol
(3)装置丙中金属A上电极反应属于______________ (填“氧化反应”或“还原反应”);
(4)四种金属活动性由强到弱的顺序是_______________________ 。
| 装置 | 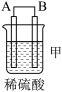 | 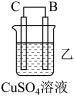 | 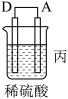 |
| 现象 | 金属A不断溶解 | C的质量增加 | A上有气体产生 |
(1)装置甲中作正极的是
(2)装置乙溶液中C电极反应:
(3)装置丙中金属A上电极反应属于
(4)四种金属活动性由强到弱的顺序是
您最近一年使用:0次
2019-03-28更新
|
531次组卷
|
3卷引用:【全国百强校】山东省邹平市第一中学2018-2019学年高一下学期第一次阶段性考试化学试题
解题方法
5 . 过氧化氢溶液可用于医用伤口消毒、环境消毒和食品消毒。科技工作者研究电化学时,采用空气和水通过电解法可制备H2O2,其装置如图所示,乙中管道将d极产生的气体送至c极。已知溶液的pH过高时H2O2会分解。下列有关说法正确的是
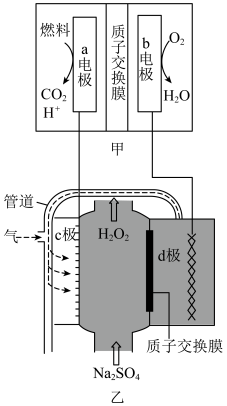

| A.甲为原电池装置,其中的b电极是负极 |
| B.乙中c极为阴极,电极反应为O2+2e-+2H2O= H2O2 +2OH- |
C.若甲中燃料是甲烷,a电极反应为CH4-8e-+ 10OH-=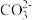 +7H2O +7H2O |
| D.反应进行一段时间后,乙中d极附近溶液pH明显增大 |
您最近一年使用:0次
名校
6 . 为探究原电池的形成条件和反应原理,某同学设计了如下实验并记录了现象:
① 向一定浓度的稀硫酸中插入锌片,看到有气泡生成;
② 向上述稀硫酸中插入铜片,没有看到有气泡生成;
③ 将锌片与铜片上端用导线连接,一起插入稀硫酸中,看到铜片上有气泡生成,且生成气泡的速率比实验①中快
④ 在锌片和铜片中间接上电流计,再将锌片和铜片插入稀硫酸中,发现电流计指针偏转。
下列关于以上实验设计及现象的分析,不正确 的是
① 向一定浓度的稀硫酸中插入锌片,看到有气泡生成;
② 向上述稀硫酸中插入铜片,没有看到有气泡生成;
③ 将锌片与铜片上端用导线连接,一起插入稀硫酸中,看到铜片上有气泡生成,且生成气泡的速率比实验①中快
④ 在锌片和铜片中间接上电流计,再将锌片和铜片插入稀硫酸中,发现电流计指针偏转。
下列关于以上实验设计及现象的分析,
| A.实验①、②说明锌能与稀硫酸反应产生氢气,而铜不能 |
| B.实验③说明发生原电池反应时会加快化学反应速率 |
| C.实验③说明在该条件下铜可以与稀硫酸反应生成氢气 |
| D.实验④说明该装置可形成原电池 |
您最近一年使用:0次
名校
解题方法
7 . 某化学研究性学习小组针对原电池形成条件,设计了实验方案,进行如下探究。
(1)请填写有关实验现象并得出相关结论。
①通过实验2和3,可得出原电池的形成条件是______________________________ 。
②通过实验1和3,可得出原电池的形成条件是______________________________ 。
③若将3装置中硫酸换成乙醇,电流计指针将不发生偏转,从而可得出原电池形成条件是___________________ 。
(2)分别写出实验3中Zn棒和Cu棒上发生的电极反应式:
Zn棒:______________________________ 。
Cu棒:______________________________ 。
(3)实验3的电流是从________ 棒流出(填“Zn”或“Cu”),反应过程中若有0.4mol电子发生了转移,则Zn电极质量减轻___________ g。
(1)请填写有关实验现象并得出相关结论。
| 编号 | 实验装置 | 实验现象 |
| 1 | 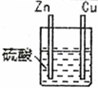 | 锌棒逐渐溶解,表面有气体生成;铜棒表面无现象 |
| 2 | 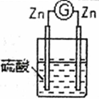 | 两锌棒逐渐溶解,表面均有气体生成;电流计指针不偏转 |
| 3 | 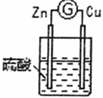 | 铜棒表面的现象是 |
①通过实验2和3,可得出原电池的形成条件是
②通过实验1和3,可得出原电池的形成条件是
③若将3装置中硫酸换成乙醇,电流计指针将不发生偏转,从而可得出原电池形成条件是
(2)分别写出实验3中Zn棒和Cu棒上发生的电极反应式:
Zn棒:
Cu棒:
(3)实验3的电流是从
您最近一年使用:0次
2018-07-16更新
|
645次组卷
|
6卷引用:【全国市级联考】河北省唐山市2017-2018学年高一下学期期末考试(A)化学试题
名校
8 . 电化学原理在电池制造、能量转换、物质合成等方面应用广泛。
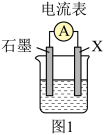
(1)若用如图1装置,依据反应Cu+2Fe3+=2Fe2++Cu2+设计原电池,则电极X应为_____ (填化学式),石墨电极的电极反应式为_____ 。将石墨换成铁电极后,电池总反应变为_____ 。
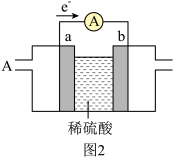
(2)燃料电池必须从电池外部源源不断地向电池提供天然气、甲烷、煤气等含氢化合物作为燃料。基于甲烷(CH4)-空气燃料电池,其工作原理如图2,a、b均为惰性电极。a为_____ 极,正极的电极反应式为_____ 。当通入4.48L(标准状况下)甲烷气体时,测得电路中转移1.1mol电子,则甲烷的利用率为_____ 。(保留小数点后1位)。
(3)在固态金属氧化物电解池中,高温共电解H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图3所示:

已知H2O在电极附近发生电极反应H2O+2e-=H2+O2-,则CO2发生的电极反应为_____ 。当H2和CO共生成2mol时,生成标准状况下O2的体积为_____ 。
(1)若用如图1装置,依据反应Cu+2Fe3+=2Fe2++Cu2+设计原电池,则电极X应为

(2)燃料电池必须从电池外部源源不断地向电池提供天然气、甲烷、煤气等含氢化合物作为燃料。基于甲烷(CH4)-空气燃料电池,其工作原理如图2,a、b均为惰性电极。a为

(3)在固态金属氧化物电解池中,高温共电解H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图3所示:

已知H2O在电极附近发生电极反应H2O+2e-=H2+O2-,则CO2发生的电极反应为
您最近一年使用:0次
2023-04-29更新
|
237次组卷
|
2卷引用:山东省菏泽市2022-2023学年高一下学期期中考试化学(A)试题
解题方法
9 . 我国科研人员将单独脱除 的反应与制备
的反应与制备 的反应相结合,实现协同转化。
的反应相结合,实现协同转化。
已知:反应①单独制备 :
: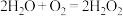 ,不能自发进行;
,不能自发进行;
反应②单独脱除 :
: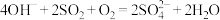 ,能自发进行。
,能自发进行。
协同转化装置如图(在电场作用下,双极膜中间层的 解离为
解离为 和
和 ,并向两极迁移)。下列分析错误的是
,并向两极迁移)。下列分析错误的是

 的反应与制备
的反应与制备 的反应相结合,实现协同转化。
的反应相结合,实现协同转化。已知:反应①单独制备
 :
: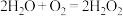 ,不能自发进行;
,不能自发进行;反应②单独脱除
 :
: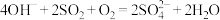 ,能自发进行。
,能自发进行。协同转化装置如图(在电场作用下,双极膜中间层的
 解离为
解离为 和
和 ,并向两极迁移)。下列分析错误的是
,并向两极迁移)。下列分析错误的是
| A.反应②释放的能量可以用于反应① |
B.产生 的电极反应: 的电极反应: |
C.当生成0.1 mol  时,负极区溶液质量增重9.8 g 时,负极区溶液质量增重9.8 g |
D.协同转化总反应: |
您最近一年使用:0次
2023-04-14更新
|
1221次组卷
|
5卷引用:辽宁省大连市2023届高三下学期一模化学试题
辽宁省大连市2023届高三下学期一模化学试题(已下线)广东省广州市天河区2023届高三二模化学试题变式题(选择题11-16)(已下线)专题九 电化学装置图(练)广东省广州市广外、铁一、广附三校2022-2023学年高一下学期期末联考化学试题(已下线)考点18 原电池 化学电源(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)
22-23高一下·广东深圳·期中
名校
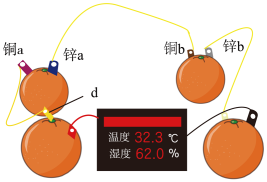
10 . 电池是人类生产和生活中的重要能量来源。人们应用原电池原理制作了多种电池以满足不同的需要。在现代生活、生产和科学技术发展中,电池发挥着越来越重要的作用。
(1)知识源于实践。学习原电池知识后,某学习小组以 和
和 为电极材料,制作了如图所示的水果电池(水果果汁中含游离的
为电极材料,制作了如图所示的水果电池(水果果汁中含游离的 )。该组电池放电时,下列说法正确的是_______(填字母)。
)。该组电池放电时,下列说法正确的是_______(填字母)。
(2)生活中利用原电池原理生产了各种各样的电池,下列有关电池的叙述正确的是_______(填字母)。
(3)将 设计成燃料电池,共利用率更高,装置如图所示(
设计成燃料电池,共利用率更高,装置如图所示( 、
、 为多孔碳棒)
为多孔碳棒)
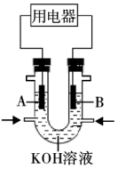
实验测得电子定向移向 电极,则
电极,则_______ (填“ ”或“
”或“ ”)电极入口通甲烷,其电极反应式为
”)电极入口通甲烷,其电极反应式为_______ 。
(4)高铁电池是一种新型可充电电池,与普通电池相比,该电池能较长时间保持稳定的放电电压。高铁电池的总反应式为: ,请回答下列问题:
,请回答下列问题:
①放电时,正极反应式为_______ 。
②放电时,负极附近溶液的碱性_______ 。(填“增强”或“减弱”)
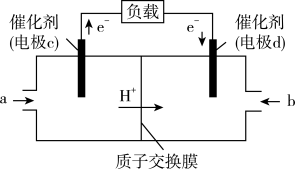
(5) 与
与 反应还可制备
反应还可制备 ,
, 可作为燃料使用,用
可作为燃料使用,用 和
和 组合形成的质子交换膜燃料电池的结构示意图如图:
组合形成的质子交换膜燃料电池的结构示意图如图:
电池总反应为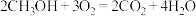 ,则
,则 电极反应式为
电极反应式为_______ ,若线路中转移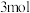 电子,则上述
电子,则上述 燃料电池,消耗的
燃料电池,消耗的 的质量为
的质量为_______  。
。
(1)知识源于实践。学习原电池知识后,某学习小组以
 和
和 为电极材料,制作了如图所示的水果电池(水果果汁中含游离的
为电极材料,制作了如图所示的水果电池(水果果汁中含游离的 )。该组电池放电时,下列说法正确的是_______(填字母)。
)。该组电池放电时,下列说法正确的是_______(填字母)。
A.每个水果果汁中的 移向正极 移向正极 |
B.锌 、 、 发生的电极反应式为 发生的电极反应式为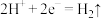 |
C.四个水果电池串联,则电极 为铜片 为铜片 |
D.铜 为电池正极,发生氧化反应 为电池正极,发生氧化反应 |
| A.锌锰电池工作一段时间后碳棒会变细 |
| B.氢氧燃料电池具有高效的特点,能量转化率可达100% |
| C.太阳能电池的主要材料是高纯度的二氧化硅 |
D.铅蓄电池负极是 ,正极是 ,正极是 |
 设计成燃料电池,共利用率更高,装置如图所示(
设计成燃料电池,共利用率更高,装置如图所示( 、
、 为多孔碳棒)
为多孔碳棒)
实验测得电子定向移向
 电极,则
电极,则 ”或“
”或“ ”)电极入口通甲烷,其电极反应式为
”)电极入口通甲烷,其电极反应式为(4)高铁电池是一种新型可充电电池,与普通电池相比,该电池能较长时间保持稳定的放电电压。高铁电池的总反应式为:
 ,请回答下列问题:
,请回答下列问题:①放电时,正极反应式为
②放电时,负极附近溶液的碱性
(5)
 与
与 反应还可制备
反应还可制备 ,
, 可作为燃料使用,用
可作为燃料使用,用 和
和 组合形成的质子交换膜燃料电池的结构示意图如图:
组合形成的质子交换膜燃料电池的结构示意图如图:
电池总反应为
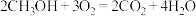 ,则
,则 电极反应式为
电极反应式为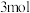 电子,则上述
电子,则上述 燃料电池,消耗的
燃料电池,消耗的 的质量为
的质量为 。
。
您最近一年使用:0次



