10-11高一下·贵州遵义·期末
名校
解题方法
1 . 如图所示,电流表指针发生偏转,同时A极质量减少,B极上有气泡产生,C为电解质溶液,下列说法错误的是
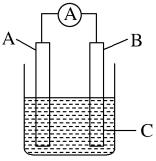

| A.B极为原电池的正极 | B.A、B、C可能分别为Zn、Cu、稀硫酸 |
| C.C中阳离子向A极移动 | D.A极发生氧化反应 |
您最近一年使用:0次
2021-04-24更新
|
1211次组卷
|
31卷引用:福建省莆田第七中学2019-2020学年高二上学期期中复习检测化学试题2
福建省莆田第七中学2019-2020学年高二上学期期中复习检测化学试题2(已下线)2010-2011年贵州省遵义四中高一下学期期末考试2014-2015学年黑龙江省双鸭山市一中高一下期末化学试卷云南省建水县民中2017-2018学年高一下学期6月份考试化学试题甘肃省岷县第一中学2018-2019学年高一下学期第一次月考化学试题新疆自治区阿克苏地区沙雅县第二中学2018-2019学年高一下学期期中考试化学试题人教版高中化学必修二第二单元《化学反应与能量》测试卷云南省玉溪市元江县一中2019-2020学年高二12月月考试化学试题6.1.2 化学反应与电能——2020年春高一新人教版第二册化学一课一练四川省武胜烈面中学校2019-2020学年高一下学期开学考试化学试题2020年春高一化学新人教版第二册课后同步:6.1.2 化学反应与电能吉林省延边市长白山第一高级中学2019-2020学年高一下学期验收考试化学试题江西省都昌县三叉港中学2019?2020学年高一下学期五月月考化学试题广东省深圳市第二高级中学2019-2020学年高一下学期第四学段考试化学试题山东省泰安市2019-2020学年高一下学期期末考试化学试题广东省东莞高级中学2019-2020学年高一下学期期中教学质量检测化学试题山东省章丘市第一中学2020-2021学年高二上学期9月月考化学试题(已下线)4.1.1 原电池的工作原理(练习)-2020-2021学年上学期高二化学同步精品课堂(新教材人教版选择性必修1)福建省莆田八中2020-2021学年高一下学期第二次月考化学(A卷) 试题辽宁省盘锦市第二高级中学2020-2021学年高一下学期第一次阶段考试化学试题山东省实验中学2020~2021学年高一下学期期中考试化学试题重庆市凤鸣山中学2020-2021学年高一下学期期中考试化学试题(已下线)专题05 化学反应与电能【专项训练】-2020-2021学年高一化学下学期期末专项复习(人教版2019必修第二册)新疆昌吉教育共同体2020-2021学年高一下学期期末质量检测化学试题(已下线)4.1.1 原电池的工作原理(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)(已下线)第08讲 化学反应与电能(讲义)-【寒假自学课】2023年高一化学寒假精品课(人教版2019必修第二册)重庆市沙坪坝实验中学校2021-2022学年高二上学期12月月考化学试题山东省滨州市沾化区实验高级中学2021-2022学年高一下学期期中考试化学试题(已下线)第四章 化学反应与电能(A卷·知识通关练)-【单元测试】2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修1) 黑龙江省大庆市大庆中学2022-2023学年高二下学期开学考试化学试题第1课时 原电池的工作原理
名校
解题方法
2 . 图为某锌-铜原电池示意图,下列说法正确的是
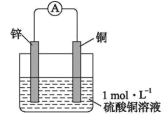

| A.电流由铜片通过导线流向锌片 |
| B.锌片为负极,且发生还原反应 |
| C.正极电极反应式:2H++ 2e-= H2↑ |
| D.该装置能将化学能完全转变为电能 |
您最近一年使用:0次
2021-04-21更新
|
616次组卷
|
6卷引用:福建省莆田第十五中学2020-2021学年高一下学期期中考试化学试题
解题方法
3 . 按要求填空
I.某研究小组为探究元素周期表中元素性质的递变规律,设计了如下实验。
(1)将钠、钾、镁、铝各1mol分别投入到足量的同浓度的盐酸中,试预测实验结果:___________ 与盐酸反应最剧烈,___________ 与盐酸反应产生的气体最多。
(2)向Na2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为___________ 。
II.甲、乙两同学想利用原电池反应检验金属的活动性强弱,两人均用镁片和铝片作电极,但甲同学将两电极放入1mol/L的H2SO4溶液中,乙同学将两电极放入6mol/L的NaOH溶液中,装置如图所示。

(1)①中负极材料为___________ 。②中负极材料为___________ 。
(2)写出①中发生的正极反应式:___________ 。
I.某研究小组为探究元素周期表中元素性质的递变规律,设计了如下实验。
(1)将钠、钾、镁、铝各1mol分别投入到足量的同浓度的盐酸中,试预测实验结果:
(2)向Na2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为
II.甲、乙两同学想利用原电池反应检验金属的活动性强弱,两人均用镁片和铝片作电极,但甲同学将两电极放入1mol/L的H2SO4溶液中,乙同学将两电极放入6mol/L的NaOH溶液中,装置如图所示。

(1)①中负极材料为
(2)写出①中发生的正极反应式:
您最近一年使用:0次
解题方法
4 . 如图是某课外活动小组设计的用化学电池使LED灯发光的装置。下列说法错误的是( )
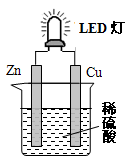

| A.铜表面有气泡生成 | B.Zn为负极,Cu为正极 |
| C.正极反应为:Zn-2e-=Zn2+ | D.装置中存在“化学能→电能→光能”的转换 |
您最近一年使用:0次
9-10高一下·浙江·期中
名校
解题方法
5 . 银锌电池的充电和放电过程可以表示为Ag2O+Zn+H2O 2Ag+Zn(OH)2。此电池放电时,正极上发生反应的物质是
2Ag+Zn(OH)2。此电池放电时,正极上发生反应的物质是
 2Ag+Zn(OH)2。此电池放电时,正极上发生反应的物质是
2Ag+Zn(OH)2。此电池放电时,正极上发生反应的物质是| A.Ag | B.Zn(OH)2 | C.Ag2O | D.Zn |
您最近一年使用:0次
2021-03-29更新
|
380次组卷
|
23卷引用:2015-2016学年福建省宁德市霞浦七中高二上期中(理)化学试卷
2015-2016学年福建省宁德市霞浦七中高二上期中(理)化学试卷(已下线)2010年浙江省浙东北三校高一第二学期期中联考化学试题(已下线)2011-2012学年内蒙古巴彦淖尔市中学巴市一中高二上学期12月月考化学试卷(已下线)2012年鲁科版高中化学选修1 3.1电池探秘练习卷(已下线)2012年苏教版高中化学必修2 2.3化学能与电能的转化练习卷2014-2015黑龙江省鸡西市龙东南四校高二上学期期末联考化学试卷2015-2016学年陕西省西安中学高二上诊断检测化学试卷吉林省汪清县第六中学2016-2017学年高一下学期期中考试化学试题广东省揭阳市第三中学2017-2018学年高一下学期期中考试(文)化学试题【全国百强校】安徽省铜陵市第一中学2018-2019学年高二上学期1月月考化学试题浙江省台州市书生中学2018-2019学年高一下学期第一次月考化学试题河北省唐山市第十一中学2019-2020学年高二上学期期中考试化学(理)试题河北省石家庄市六校2019-2020学年高二上学期期中考试化学试题宁夏回族自治区吴忠市青铜峡市高级中学2019-2020学年高二上学期期末考试化学试题2019-2020学年人教版鲁科版高中化学必修2第二章《化学键 化学反应与能量》单元测试卷人教版高中化学必修2第二章《化学反应与能量》测试卷4人教版 高中化学 必修2 第二章 《化学反应与能量》 单元能力检测江苏省徐州市郑集高级中学2020-2021学年高一下学期3月考化学试题广东省中山市第二中学2020-2021学年高一下学期第一次段考化学试题海南省华中师范大学琼中附属中学2020-2021学年高一下学期期中考试化学试题6.3.2化学电源(课后)-2019苏教版必修2课前课中课后吉林省长春市第二实验中学2022-2023学年高一下学期期中考试化学试题山西省朔州市怀仁市大地学校高中部2023-2024学年高二上学期12月月考化学试题
9-10高一下·河南许昌·期末
名校
解题方法
6 . 如图所示,下列对于该原电池的叙述正确的是
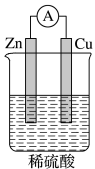
| A.铜是负极,铜片上有气泡产生 |
| B.铜片质量逐渐减小 |
| C.电流从锌片经导线流向铜片 |
| D.氢离子在铜片表面被还原 |
您最近一年使用:0次
2021-03-09更新
|
2612次组卷
|
26卷引用:2010年河南省许昌市六校联考高一下学期期末考试化学试题
(已下线)2010年河南省许昌市六校联考高一下学期期末考试化学试题(已下线)2011-2012学年河北省迁安市高二第一学期期中考试化学试卷(已下线)2011-2012学年河北省元氏一中高二上学期期中考试化学试卷(已下线)2014年高一下学期化学必修2 2-2-1 化学能转化为电能练习卷河南省安阳市第三十五中学2016-2017学年高一下学期期末考试化学试题云南省昆明市黄冈实验学校2017-2018学年高二上学期第二次月考(文)化学试题安徽省砀山县第二中学2018-2019学年高一下学期第二次月考化学试题陕西省吴起高级中学2018-2019学年高一下学期第二次月考基础卷化学试题云南省河口县高级中学2019-2020学年高二上学期期末考试化学试题辽宁省大连市大连海湾高级中学2019-2020学年高一下学期第一次质量检测化学试题北京市人大附中朝阳学校2019~2020年高一下学期阶段练习化学试题(选考班)(已下线)练习13 原电池-2020-2021学年【补习教材·寒假作业】高二化学(人教版)福建省福州第一中学2022-2023学年高三上学期第一次调研测试化学试题(已下线)6.1.2 化学反应与电能(练好题)(基础过关)-2020-2021学年高一化学新教材新理念新设计同步课堂(人教2019必修第二册)(已下线)第2章 化学反应与能量(培优提升卷)-2020-2021学年高一化学必修2章末集训必刷卷(人教版)江苏省扬州市江都区邵伯高级中学2020-2021学年高一下学期期中考试化学试题山东省临沂市罗庄区2021-2022学年高一下学期5月期中考试化学试题(已下线)第15练 化学反应与能量变化-2023年高考化学一轮复习小题多维练(全国通用)江西省九江市第一中学2021-2022学年高二上学期期末化学试题云南红河县第一中学2021-2022学年高一下学期期末考试化学试题四川省凉山宁南中学2020-2021学年高一下学期第二次月考化学试题甘肃省定西市文峰中学2021-2022学年高二上学期期中考试化学(理科)试题(已下线)【知识图鉴】单元讲练测必修第二册第六单元02基础练北京市第一六一中学2022-2023学年高一下学期期中考试化学试题陕西省咸阳市武功县普集高级中学2020-2021学年高一下学期第三次月考化学试题广东省江门市第一中学2023-2024学年高一下学期第一次段考化学试题
解题方法
7 . 如图为铜锌原电池装置,下列叙述错误的是


| A.Zn片为负极,Cu片为正极 | B.Zn片上发生氧化反应 |
| C.Cu片上发生氧化反应 | D.Cu 片上有气泡产生 |
您最近一年使用:0次
2021-01-13更新
|
315次组卷
|
3卷引用:福建省莆田第十五中学2019-2020学年高二上学期期末考试化学试题
14-15高三上·北京石景山·期末
名校
8 . 如图是某同学设计的原电池装置,下列叙述中正确的是
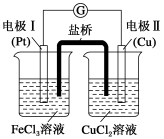

| A.电极Ⅰ上发生还原反应,作原电池的负极 |
| B.该原电池的总反应为2Fe3++Cu=Cu2++2Fe2+ |
| C.电极Ⅱ的电极反应为Cu2++2e-=Cu |
| D.盐桥中装有含琼胶的氯化钾饱和溶液,其作用是传递电子 |
您最近一年使用:0次
2021-01-06更新
|
310次组卷
|
26卷引用:福建省福清西山学校高中部2020-2021学年高二9月月考化学试题
福建省福清西山学校高中部2020-2021学年高二9月月考化学试题福建省三明市泰宁第一中学2020-2021学年高二上学期学分认定暨第一次阶段考试化学试题(已下线)2014届北京市石景山区高三上学期期末考试化学试卷(已下线)2013-2014浙江省温州中学高二下学期期中化学试卷(已下线)2014届浙江省温州中学高二下学期期中化学试卷 2017届海南省琼海市嘉积中学高三下学期第一次月考化学试卷内蒙古通辽实验中学2018-2019学年高二上学期期中考试化学试题山东省泰安市宁阳一中2018-2019学年高二上学期阶段性考试三(12月)化学试题重庆市涪陵高级中学校2019-2020学年高二上学期第一次诊断性考试化学试题海南省海口市第四中学2019-2020学年高二上学期期末考试化学试题辽宁省凌源市第三中学2019-2020学年高二下学期第一次月考化学试题内蒙古阿拉善盟2020届高三上学期月考化学试题内蒙古赤峰市赤峰二中2019-2020学年高二下学期第一次月考化学试题北京市中央民族大学附属中学2019-2020学年高二下学期期末考试化学试题河南省鹤壁市外国语中学2019-2020学年高一下学期段考化学试题宁夏石嘴山市第三中学2020-2021学年高二上学期第一次月考化学试题安徽省淮北市孙疃中学2020-2021学年高二上学期第一次月考化学(实验班)试题安徽省淮北市孙疃中学2020-2021学年高二上学期第一次月考化学试题辽宁省大连市普兰店区第三十八中学2020-2021学年高二上学期第三次月考化学试题江西省南昌市新建区第一中学2020-2021学年高二上学期第二次月考化学试题陕西省西安市长安区第一中学2017-2018学年高二上学期第四次教学质量检测化学试题(已下线)模块八 电化学基础(模块检测)-2022年高考化学一轮复习小题多维练(全国通用)山西省长治市第二中学校2021-2022学年高二上学期第二次月考化学试题四川省宜宾市叙州区第一中学校2021-2022学年高二下学期期中考试化学试题(已下线)第34练 原电池-2023年高考化学一轮复习小题多维练(全国通用)云南省曲靖二中云师高级中学 第二中学 兴教学校2023-2024学年高二上学期12月期中联考化学试题
解题方法
9 . 燃料电池是一种将燃料所具有的化学能直接转换成电能的化学装置。
(1)以多孔铂为电极,如图甲装置中A、B口分别通入CH3CH2OH和O2构成乙醇燃料电池,则b电极是______ (填“正极”或“负极”),该电池的负极电极反应式为___________ 。
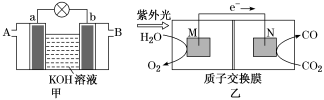
(2)科学家研究了转化温室气体的方法,利用图乙所示装置可以将CO2转化为气体燃料CO,该电池负极反应式为_________________________ ,
(3)铅蓄电池是常用的化学电源,其电极材料分别是Pb和PbO2,电解液为硫酸。该电池总反应式为Pb+PbO2+2H2SO4 2PbSO4+2H2O。(已知:硫酸铅为不溶于水的白色沉淀,生成时附着在电极上)
2PbSO4+2H2O。(已知:硫酸铅为不溶于水的白色沉淀,生成时附着在电极上)
①该蓄电池放电时,电解质溶液中阴离子移向________ (填“正极”或“负极”);正极附近溶液的酸性__________ (填“增强”“减弱”或“不变”),当外电路通过1 mol电子时,理论上正极板的质量增加____________ g。
(1)以多孔铂为电极,如图甲装置中A、B口分别通入CH3CH2OH和O2构成乙醇燃料电池,则b电极是

(2)科学家研究了转化温室气体的方法,利用图乙所示装置可以将CO2转化为气体燃料CO,该电池负极反应式为
(3)铅蓄电池是常用的化学电源,其电极材料分别是Pb和PbO2,电解液为硫酸。该电池总反应式为Pb+PbO2+2H2SO4
 2PbSO4+2H2O。(已知:硫酸铅为不溶于水的白色沉淀,生成时附着在电极上)
2PbSO4+2H2O。(已知:硫酸铅为不溶于水的白色沉淀,生成时附着在电极上)①该蓄电池放电时,电解质溶液中阴离子移向
您最近一年使用:0次
名校
解题方法
10 . 氨是化学实验室及化工生产中的重要物质,应用广泛。
N2(g)+3H2(g) 2NH3(g) ΔH= -92.2 kJ/mol
2NH3(g) ΔH= -92.2 kJ/mol
(1)在恒温恒容密闭容器中进行合成氨反应,起始投料时各物质浓度如下表:
①按投料Ⅰ进行反应,测得达到化学平衡状态时H2的转化率为40%,则该温度下合成氨反应的平衡常数K=_____________ 。
②按投料Ⅱ进行反应,起始时反应进行的方向为________ (填“正向”或“逆向”)。
③若升高温度,则合成氨反应的化学平衡常数________ (填“变大”、“变小”或“不变”)。
(2) L(L1、L2)、X可分别代表压强或温度。如图表示L一定时,合成氨反应中H2(g)的平衡转化率随X的变化关系。

①X代表的物理量是______ 。
②判断L1、L2的大小关系,并简述理由:______ 。
(3)电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下:
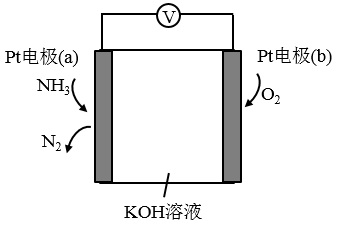
①电极b上发生的是______ 反应(填“氧化”或“还原”)
②写出电极a的电极反应式:_________ 。
N2(g)+3H2(g)
 2NH3(g) ΔH= -92.2 kJ/mol
2NH3(g) ΔH= -92.2 kJ/mol(1)在恒温恒容密闭容器中进行合成氨反应,起始投料时各物质浓度如下表:
| N2 | H2 | NH3 | |
| 投料Ⅰ | 1.0 mol/L | 3.0 mol /L | 0 |
| 投料Ⅱ | 0.5 mol/L | 1.5 mol/L | 1.0 mol/L |
①按投料Ⅰ进行反应,测得达到化学平衡状态时H2的转化率为40%,则该温度下合成氨反应的平衡常数K=
②按投料Ⅱ进行反应,起始时反应进行的方向为
③若升高温度,则合成氨反应的化学平衡常数
(2) L(L1、L2)、X可分别代表压强或温度。如图表示L一定时,合成氨反应中H2(g)的平衡转化率随X的变化关系。

①X代表的物理量是
②判断L1、L2的大小关系,并简述理由:
(3)电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下:

①电极b上发生的是
②写出电极a的电极反应式:
您最近一年使用:0次



