1 . 尿素 合成的发展体现了化学科学与技术的不断进步。
合成的发展体现了化学科学与技术的不断进步。
(1)十九世纪初,用氰酸银 与
与 在一定条件下反应制得
在一定条件下反应制得 ,实现了由无机物到有机物的合成。该反应的化学方程式是
,实现了由无机物到有机物的合成。该反应的化学方程式是____________________ 。
(2)二十世纪初,工业上以 和
和 为原料在一定温度和压强下合成尿素。反应分两步:
为原料在一定温度和压强下合成尿素。反应分两步:
ⅰ. 和
和 生成
生成 ;
;
ⅱ. 分解生成尿素。
分解生成尿素。
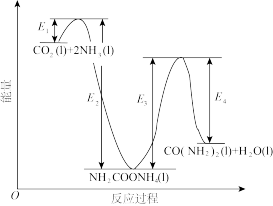
结合反应过程中能量变化示意图,下列说法正确的是__________ (填序号)。
a.活化能:反应ⅰ<反应ⅱ
b.ⅰ为放热反应,ⅱ为吸热反应
c.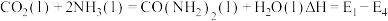
(3)近年研究发现,电催化 和含氮物质(
和含氮物质( 等)在常温常压下合成尿素,有助于实现碳中和及解决含氮废水污染问题。向一定浓度的
等)在常温常压下合成尿素,有助于实现碳中和及解决含氮废水污染问题。向一定浓度的 溶液通
溶液通 至饱和,在电极上反应生成
至饱和,在电极上反应生成 ,电解原理如图所示。
,电解原理如图所示。
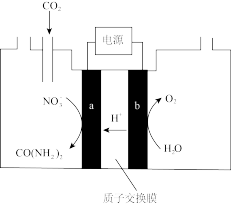
①电极 是电解池的
是电解池的__________ 极。
②电解过程中生成尿素的电极反应式是_____________ 。
(4)尿素样品含氮量的测定方法如下。
已知:溶液中 不能直接用
不能直接用 溶液准确滴定。
溶液准确滴定。

①消化液中的含氮粒子是__________ 。
②步骤ⅳ中标准 溶液的浓度和消耗的体积分别为
溶液的浓度和消耗的体积分别为 和
和 ,计算样品含氮量还需要的实验数据有
,计算样品含氮量还需要的实验数据有__________ 。
 合成的发展体现了化学科学与技术的不断进步。
合成的发展体现了化学科学与技术的不断进步。(1)十九世纪初,用氰酸银
 与
与 在一定条件下反应制得
在一定条件下反应制得 ,实现了由无机物到有机物的合成。该反应的化学方程式是
,实现了由无机物到有机物的合成。该反应的化学方程式是(2)二十世纪初,工业上以
 和
和 为原料在一定温度和压强下合成尿素。反应分两步:
为原料在一定温度和压强下合成尿素。反应分两步:ⅰ.
 和
和 生成
生成 ;
;ⅱ.
 分解生成尿素。
分解生成尿素。
结合反应过程中能量变化示意图,下列说法正确的是
a.活化能:反应ⅰ<反应ⅱ
b.ⅰ为放热反应,ⅱ为吸热反应
c.
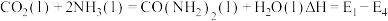
(3)近年研究发现,电催化
 和含氮物质(
和含氮物质( 等)在常温常压下合成尿素,有助于实现碳中和及解决含氮废水污染问题。向一定浓度的
等)在常温常压下合成尿素,有助于实现碳中和及解决含氮废水污染问题。向一定浓度的 溶液通
溶液通 至饱和,在电极上反应生成
至饱和,在电极上反应生成 ,电解原理如图所示。
,电解原理如图所示。
①电极
 是电解池的
是电解池的②电解过程中生成尿素的电极反应式是
(4)尿素样品含氮量的测定方法如下。
已知:溶液中
 不能直接用
不能直接用 溶液准确滴定。
溶液准确滴定。
①消化液中的含氮粒子是
②步骤ⅳ中标准
 溶液的浓度和消耗的体积分别为
溶液的浓度和消耗的体积分别为 和
和 ,计算样品含氮量还需要的实验数据有
,计算样品含氮量还需要的实验数据有
您最近一年使用:0次
2023-06-28更新
|
8744次组卷
|
9卷引用:2023年高考北京卷化学真题
2023年高考北京卷化学真题(已下线)专题17 原理综合题(已下线)专题17 原理综合题(已下线)2023年北京卷高考真题变式题(原理综合题)(已下线)专题15 化学反应原理综合题-2023年高考化学真题题源解密(全国通用)(已下线)第25讲电解池与金属的电化学腐蚀北京市育才学校2023-2024学年高一上学期化学期中试题北京市育才学校2023-2024学年高二上学期期中考试化学试题2024届河北省实验中学高三年级上学期第一次月考化学试题
2 . 超纯 是制备第三代半导体的支撑源材料之一,近年来,我国科技工作者开发了超纯纯化、超纯分析和超纯灌装一系列高新技术,在研制超纯
是制备第三代半导体的支撑源材料之一,近年来,我国科技工作者开发了超纯纯化、超纯分析和超纯灌装一系列高新技术,在研制超纯 方面取得了显著成果,工业上以粗镓为原料,制备超纯
方面取得了显著成果,工业上以粗镓为原料,制备超纯 的工艺流程如下:
的工艺流程如下: 的化学性质和
的化学性质和 相似,
相似, 的熔点为
的熔点为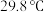 ;
;
② (乙醚)和
(乙醚)和 (三正辛胺)在上述流程中可作为配体;
(三正辛胺)在上述流程中可作为配体;
③相关物质的沸点:
回答下列问题:
(1)晶体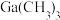 的晶体类型是
的晶体类型是_______ ;
(2)“电解精炼”装置如图所示,电解池温度控制在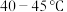 的原因是
的原因是_______ ,阴极的电极反应式为_______ ;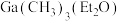 ”工序中的产物还包括
”工序中的产物还包括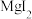 和
和 ,写出该反应的化学方程式:
,写出该反应的化学方程式:_______ ;
(4)“残渣”经纯水处理,能产生可燃性气体,该气体主要成分是_______ ;
(5)下列说法错误的是_______;
(6)直接分解 不能制备超纯
不能制备超纯 ,而本流程采用“配体交换”工艺制备超纯
,而本流程采用“配体交换”工艺制备超纯 的理由是
的理由是_______ ;
(7)比较分子中的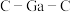 键角大小:
键角大小:
_______  (填“>”“<”或“=”),其原因是
(填“>”“<”或“=”),其原因是_______ 。
 是制备第三代半导体的支撑源材料之一,近年来,我国科技工作者开发了超纯纯化、超纯分析和超纯灌装一系列高新技术,在研制超纯
是制备第三代半导体的支撑源材料之一,近年来,我国科技工作者开发了超纯纯化、超纯分析和超纯灌装一系列高新技术,在研制超纯 方面取得了显著成果,工业上以粗镓为原料,制备超纯
方面取得了显著成果,工业上以粗镓为原料,制备超纯 的工艺流程如下:
的工艺流程如下: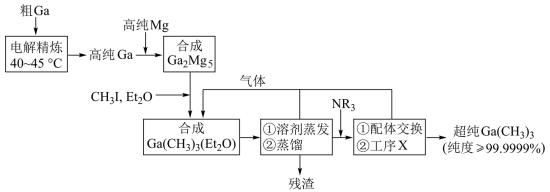
 的化学性质和
的化学性质和 相似,
相似, 的熔点为
的熔点为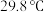 ;
;②
 (乙醚)和
(乙醚)和 (三正辛胺)在上述流程中可作为配体;
(三正辛胺)在上述流程中可作为配体;③相关物质的沸点:
| 物质 | 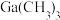 |  | 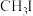 | 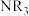 |
沸点/ | 55.7 | 34.6 | 42.4 | 365.8 |
(1)晶体
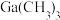 的晶体类型是
的晶体类型是(2)“电解精炼”装置如图所示,电解池温度控制在
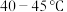 的原因是
的原因是
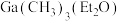 ”工序中的产物还包括
”工序中的产物还包括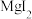 和
和 ,写出该反应的化学方程式:
,写出该反应的化学方程式:(4)“残渣”经纯水处理,能产生可燃性气体,该气体主要成分是
(5)下列说法错误的是_______;
A.流程中 得到了循环利用 得到了循环利用 |
B.流程中,“合成 ”至“工序X”需在无水无氧的条件下进行 ”至“工序X”需在无水无氧的条件下进行 |
C.“工序X”的作用是解配 ,并蒸出 ,并蒸出 |
D.用核磁共振氢谱不能区分 和 和 |
 不能制备超纯
不能制备超纯 ,而本流程采用“配体交换”工艺制备超纯
,而本流程采用“配体交换”工艺制备超纯 的理由是
的理由是(7)比较分子中的
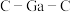 键角大小:
键角大小:
 (填“>”“<”或“=”),其原因是
(填“>”“<”或“=”),其原因是
您最近一年使用:0次
2023-06-16更新
|
10046次组卷
|
11卷引用:2023年高考湖南卷化学真题
2023年高考湖南卷化学真题(已下线)专题18 工艺流程题(已下线)专题18 工艺流程题(已下线)专题18 工艺流程题(已下线)2023年湖南卷高考真题变式题(工业流程题)(已下线)专题13 工艺流程综合题-2023年高考化学真题题源解密(新高考专用)(已下线)专题13 工艺流程综合题-2023年高考化学真题题源解密(全国通用)(已下线)考点47 无机工艺流程(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)福建省厦门市 第一中学2023-2024上学期高三上学期12月考化学试题福建省漳州市华安县第一中学2023-2024学年高三上学期12月月考化学试题(已下线)题型四 无机化工流程题解题策略-备战2024年高考化学答题技巧与模板构建
3 . H2O2是一种重要的化学品,其合成方法不断发展。
(1)早期制备方法:Ba(NO3)2 BaO
BaO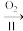 BaO2
BaO2
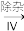 滤液
滤液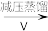 H2O2
H2O2
①I为分解反应,产物除BaO、O2外,还有一种红棕色气体。该反应的化学方程式是____ 。
②II为可逆反应,促进该反应正向进行的措施是____ 。
③III中生成H2O2,反应的化学方程式是____ 。
④减压能够降低蒸馏温度,从H2O2的化学性质角度说明V中采用减压蒸馏的原因:____ 。
(2)电化学制备方法:已知反应2H2O2=2H2O+O2↑能自发进行,反向不能自发进行,通过电解可以实现由H2O和O2为原料制备H2O2,如图为制备装置示意图。

①a极的电极反应式是____ 。
②下列说法正确的是____ 。
A.该装置可以实现电能转化为化学能
B.电极b连接电源负极
C.该方法相较于早期制备方法具有原料廉价,对环境友好等优点
(1)早期制备方法:Ba(NO3)2
 BaO
BaO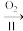 BaO2
BaO2
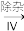 滤液
滤液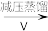 H2O2
H2O2①I为分解反应,产物除BaO、O2外,还有一种红棕色气体。该反应的化学方程式是
②II为可逆反应,促进该反应正向进行的措施是
③III中生成H2O2,反应的化学方程式是
④减压能够降低蒸馏温度,从H2O2的化学性质角度说明V中采用减压蒸馏的原因:
(2)电化学制备方法:已知反应2H2O2=2H2O+O2↑能自发进行,反向不能自发进行,通过电解可以实现由H2O和O2为原料制备H2O2,如图为制备装置示意图。

①a极的电极反应式是
②下列说法正确的是
A.该装置可以实现电能转化为化学能
B.电极b连接电源负极
C.该方法相较于早期制备方法具有原料廉价,对环境友好等优点
您最近一年使用:0次
2020-08-19更新
|
5446次组卷
|
9卷引用:2020年北京市高考化学试卷
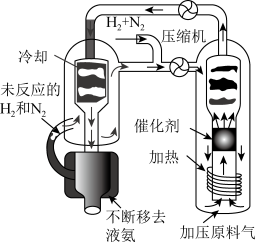
4 . (一)合成氨工艺(流程如图所示)是人工固氮最重要的途径。
2018年是合成氨工业先驱哈伯(P•Haber)获得诺贝尔奖100周年。N2和H2生成NH3的反应为:1/2N2(g)+3/2H2(g) NH3(g)∆H(298K)=-46.2KJ•mol-1,在Fe催化剂作用下的反应历程为(*表示吸附态)
NH3(g)∆H(298K)=-46.2KJ•mol-1,在Fe催化剂作用下的反应历程为(*表示吸附态)
化学吸附:N2(g)→2N*;H2(g)→2H*;
表面反应:N*+H* NH*;
NH*; ;NH2*+H*
;NH2*+H* NH3*
NH3*
脱附:NH3* NH3(g)
NH3(g)
其中,N2的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。请回答:
(1)利于提高合成氨平衡产率的条件有__________ 。
A.低温 B.高温 C.低压 D.高压 E.催化剂
(2)标准平衡常数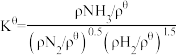 ,其中
,其中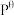 为标准压强(1X105Pa),pNH3、pN2和pH2为各组分的平衡分压,如pNH3=xNH3p,p为平衡总压,xNH3为平衡系统中NH3的物质的量分数。
为标准压强(1X105Pa),pNH3、pN2和pH2为各组分的平衡分压,如pNH3=xNH3p,p为平衡总压,xNH3为平衡系统中NH3的物质的量分数。
①N2和H2起始物质的量之比为1:3,反应在恒定温度和标准压强下进行,NH3的平衡产率为w,则 =
=_____________ (用含w的最简式表示)
②下图中可以示意标准平衡常数 随温度T变化趋势的是
随温度T变化趋势的是_______ 。
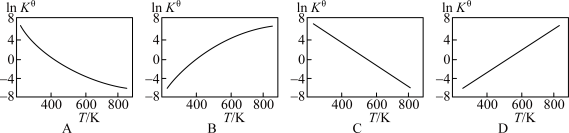
(3)实际生产中,常用工艺条件,Fe作催化剂,控制温度773K,压强3.0X105Pa,原料中N2和H2物质的量之比为1:2.8。
①分析说明原料气中N2过量的理由________________________ 。
②关于合成氨工艺的下列理解,正确的是_______ 。
A.合成氨反应在不同温度下的∆H和∆S都小于零
B.控制温度(773K)远高于室温,是为了保证尽可能的平衡转化率和快的反应速率
C.当温度、压强一定时,在原料气(N2和H2的比例不变)中添加少量惰性气体,有利于提高平衡转化率
D.基于NH3有较强的分子间作用力可将其液化,不断将液氨移去,利于反应正向进行
E.分离空气可得N2,通过天然气和水蒸气转化可得H2,原料气须经过净化处理,以防止催化剂中毒和安全事故发生。
(二)高铁酸钾(K2FeO4)可用作水处理剂。某同学通过“化学-电解法”探究的合成,其原理如图所示。接通电源,调节电压,将一定量Cl2通入KOH溶液,然后滴入含Fe3+的溶液,控制温度,可制得K2FeO4。
(1)请写出“化学法”得到FeO42-的离子方程式___________________________ 。
(2)请写出阳极的电极反应式(含FeO42-)___________________________________ 。
2018年是合成氨工业先驱哈伯(P•Haber)获得诺贝尔奖100周年。N2和H2生成NH3的反应为:1/2N2(g)+3/2H2(g)
 NH3(g)∆H(298K)=-46.2KJ•mol-1,在Fe催化剂作用下的反应历程为(*表示吸附态)
NH3(g)∆H(298K)=-46.2KJ•mol-1,在Fe催化剂作用下的反应历程为(*表示吸附态)化学吸附:N2(g)→2N*;H2(g)→2H*;
表面反应:N*+H*
 NH*;
NH*; ;NH2*+H*
;NH2*+H* NH3*
NH3*脱附:NH3*
 NH3(g)
NH3(g)其中,N2的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。请回答:
(1)利于提高合成氨平衡产率的条件有
A.低温 B.高温 C.低压 D.高压 E.催化剂
(2)标准平衡常数
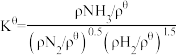 ,其中
,其中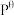 为标准压强(1X105Pa),pNH3、pN2和pH2为各组分的平衡分压,如pNH3=xNH3p,p为平衡总压,xNH3为平衡系统中NH3的物质的量分数。
为标准压强(1X105Pa),pNH3、pN2和pH2为各组分的平衡分压,如pNH3=xNH3p,p为平衡总压,xNH3为平衡系统中NH3的物质的量分数。①N2和H2起始物质的量之比为1:3,反应在恒定温度和标准压强下进行,NH3的平衡产率为w,则
 =
=②下图中可以示意标准平衡常数
 随温度T变化趋势的是
随温度T变化趋势的是
(3)实际生产中,常用工艺条件,Fe作催化剂,控制温度773K,压强3.0X105Pa,原料中N2和H2物质的量之比为1:2.8。
①分析说明原料气中N2过量的理由
②关于合成氨工艺的下列理解,正确的是
A.合成氨反应在不同温度下的∆H和∆S都小于零
B.控制温度(773K)远高于室温,是为了保证尽可能的平衡转化率和快的反应速率
C.当温度、压强一定时,在原料气(N2和H2的比例不变)中添加少量惰性气体,有利于提高平衡转化率
D.基于NH3有较强的分子间作用力可将其液化,不断将液氨移去,利于反应正向进行
E.分离空气可得N2,通过天然气和水蒸气转化可得H2,原料气须经过净化处理,以防止催化剂中毒和安全事故发生。
(二)高铁酸钾(K2FeO4)可用作水处理剂。某同学通过“化学-电解法”探究的合成,其原理如图所示。接通电源,调节电压,将一定量Cl2通入KOH溶液,然后滴入含Fe3+的溶液,控制温度,可制得K2FeO4。

(1)请写出“化学法”得到FeO42-的离子方程式
(2)请写出阳极的电极反应式(含FeO42-)
您最近一年使用:0次
2018-11-07更新
|
4857次组卷
|
5卷引用:2018年11月浙江省普通高校招生选考科目考试化学试题



