1 . 氯化亚铜晶体呈白色,不溶于水、乙醇及稀硫酸,露置于潮湿空气中易被氧化。氯化铜、氯化亚铜是重要的化工原料。实验室中以粗铜(含杂质Fe)为原料,一种制备铜的氯化物的流程如下。(已知:CuCl溶于NaCl的浓溶液可生成CuCl ,CuCl
,CuCl 的溶液用水稀释后可生成CuCl沉淀)
的溶液用水稀释后可生成CuCl沉淀)
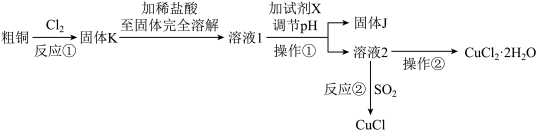
按要求回答下列问题:
(1)“操作①”调节溶液的pH范围为3.2≤pH<5.6,便于将Fe3+ 转化为Fe(OH)3沉淀除去,加入的“试剂X”可以是__________ 。
A CuO B NH3·H2O C NaOH溶液 D Cu2(OH)2CO3
(2)“反应②”是向溶液2中加入食盐并通入SO2可生成CuCl ,CuCl
,CuCl 的溶液用水稀释后可生成CuCl沉淀,过滤、洗涤、干燥密封包装即得产品,据此回答下列问题:
的溶液用水稀释后可生成CuCl沉淀,过滤、洗涤、干燥密封包装即得产品,据此回答下列问题:
①写出向溶液2中加入食盐并通入SO2可生成CuCl 的离子方程式
的离子方程式__________ 。
②用无水乙醇洗涤沉淀,在真空干燥机内于70℃干燥2小时,冷却。于70℃真空干燥的目的是_____________________ 。
(3)在氯化氢气流中得到CuCl2·2H2O固体的“操作②”具体步骤为________ 、过滤、洗涤。
(4)氯化亚铜的定量分析:
①称取样品0.250g和10mL过量的FeCl3溶液于250mL锥形瓶中,充分溶解。
②用0.100mol·L-1 硫酸铈[Ce(SO4)2]标准溶液滴定。
已知:CuCl+FeCl3=CuCl2+FeCl2、Fe2++Ce4+=Fe3++Ce3+。三次平行实验结果如下(平行实验结果相差不能超过1%):
则样品中CuCl的纯度为________ 。
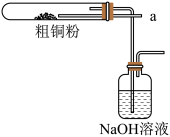
(5)如图所示将氯气从a通入与粗铜反应(铁架台、铁夹、酒精灯省略),反应后,盛有NaOH溶液的广口瓶中溶液具有漂白、消毒作用,若用钢铁(含Fe、C)制品盛装该溶液会发生电化学腐蚀,钢铁制品表面生成红褐色沉淀,溶液会失去漂白、杀菌消毒功效。该电化学腐蚀过程中的正极反应式为___________ 。
 ,CuCl
,CuCl 的溶液用水稀释后可生成CuCl沉淀)
的溶液用水稀释后可生成CuCl沉淀)
按要求回答下列问题:
(1)“操作①”调节溶液的pH范围为3.2≤pH<5.6,便于将Fe3+ 转化为Fe(OH)3沉淀除去,加入的“试剂X”可以是
A CuO B NH3·H2O C NaOH溶液 D Cu2(OH)2CO3
(2)“反应②”是向溶液2中加入食盐并通入SO2可生成CuCl
 ,CuCl
,CuCl 的溶液用水稀释后可生成CuCl沉淀,过滤、洗涤、干燥密封包装即得产品,据此回答下列问题:
的溶液用水稀释后可生成CuCl沉淀,过滤、洗涤、干燥密封包装即得产品,据此回答下列问题:①写出向溶液2中加入食盐并通入SO2可生成CuCl
 的离子方程式
的离子方程式②用无水乙醇洗涤沉淀,在真空干燥机内于70℃干燥2小时,冷却。于70℃真空干燥的目的是
(3)在氯化氢气流中得到CuCl2·2H2O固体的“操作②”具体步骤为
(4)氯化亚铜的定量分析:
①称取样品0.250g和10mL过量的FeCl3溶液于250mL锥形瓶中,充分溶解。
②用0.100mol·L-1 硫酸铈[Ce(SO4)2]标准溶液滴定。
已知:CuCl+FeCl3=CuCl2+FeCl2、Fe2++Ce4+=Fe3++Ce3+。三次平行实验结果如下(平行实验结果相差不能超过1%):
| 平行实验次数 | 1 | 2 | 3 |
| 0.250g样品消耗硫酸铈标准溶液的体积(mL) | 20.35 | 20.05 | 19.95 |
(5)如图所示将氯气从a通入与粗铜反应(铁架台、铁夹、酒精灯省略),反应后,盛有NaOH溶液的广口瓶中溶液具有漂白、消毒作用,若用钢铁(含Fe、C)制品盛装该溶液会发生电化学腐蚀,钢铁制品表面生成红褐色沉淀,溶液会失去漂白、杀菌消毒功效。该电化学腐蚀过程中的正极反应式为

您最近一年使用:0次
18-19高二·浙江·期中
2 . 将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)腐蚀而变暗,在液滴外沿棕色铁锈环(b),加图所示。下列说法不正确 的是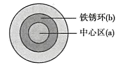

| A.铁片腐蚀过程发生的总化学方程式为:2Fe+2H2O+O2=2Fe(OH)2 |
| B.液滴之下氧气含量少,铁片作负极,发生的氧化反应为:Fe-3e-=Fe3+ |
| C.液滴边缘是正极区,发生的电极反应为:O2+2H2O+4e-=4OH- |
| D.铁片腐蚀最严重区域不是生锈最多的区域 |
您最近一年使用:0次
名校
3 . 下列说法正确 的是
A.钢铁发生电化学腐蚀的负极反应: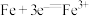 |
B.常温下 通入 通入 溶液,当溶液中约 溶液,当溶液中约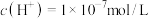 ,一定存在 ,一定存在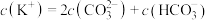 |
C.向 稀溶液中加入 稀溶液中加入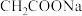 固体,则 固体,则 的值变小 的值变小 |
D.向 溶液中滴加少量 溶液中滴加少量 溶液,产生黑色沉淀, 溶液,产生黑色沉淀, 水解程度增大 水解程度增大 |
您最近一年使用:0次
名校
解题方法
4 . 某同学做了如下实验:
下列说法中正确的是
| 装置 | 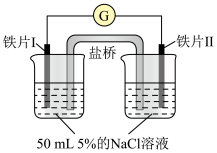 | 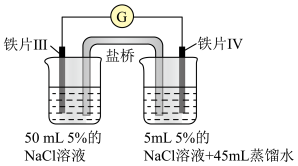 |
| 现象 | 电流计指针未发生偏转 | 电流计指针发生偏转 |
下列说法中正确的是
| A.加热铁片Ⅰ所在烧杯,电流表指针会发生偏转 |
| B.用KSCN溶液检验铁片Ⅲ、Ⅳ附近溶液,可判断电池的正、负极 |
| C.铁片Ⅰ、Ⅲ的腐蚀速率相等 |
| D.“电流计指针未发生偏转”,说明铁片Ⅰ、铁片Ⅱ均未被腐蚀 |
您最近一年使用:0次
2019-03-08更新
|
1018次组卷
|
6卷引用:湖北省武汉市2017届高三高中毕业生五月模拟考试理综化学试题
5 . 有关金属腐蚀的说法中正确的是
| A.电化学腐蚀要比化学腐蚀普遍的多,但腐蚀速度要比化学腐蚀慢得多 |
| B.纯银器表面在空气中因电化学腐蚀而逐渐变暗 |
| C.钢柱在水下部分比在空气与水交界处更容易腐蚀 |
| D.钢铁发生电化学腐蚀时,碳相当于微小原电池的正极 |
您最近一年使用:0次
名校
6 . 下列关于金属防护的说法中正确的是
| A.当镀锌铁制品的镀层破损时,镀层仍能对铁制品起保护作用 |
| B.地下输油钢管与外加直流电源的正极相连可保护其不受腐蚀 |
| C.在轮船船体四周镶嵌锌块保护船体不受腐蚀的方法叫阳极电化学保护法 |
| D.不锈钢有较强的抗腐蚀能力是因为在钢铁表面镀上了铬 |
您最近一年使用:0次
2019-02-04更新
|
590次组卷
|
3卷引用:【校级联考】安徽省宿州市十三所重点中学2018-2019学年高二(文)第一学期期末质量检测化学试题
名校
7 . 下图所示各烧杯中均盛有海水,铁在其中被腐蚀最快和被保护最好的分别为( )
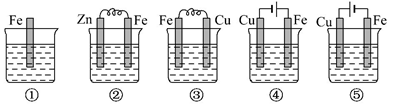

| A.①⑤ | B.③② | C.④⑤ | D.④① |
您最近一年使用:0次
2018-12-24更新
|
638次组卷
|
4卷引用:河北省唐山市玉田县2018-2019学年高二上学期期中考试化学试题
名校
8 . 铁是人类最早使用的金属,它在日常生活中的应用十分广泛。
I.用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一。
(1)Fe还原水体中NO3-的反应原理如下图所示:

①作负极的物质是______________ 。
②正极的电极反应式是_________________________________ 。
(2)将足量铁粉投入水体中,经24小时测定NO3-的去除率和pH,结果如下:
pH=4.5时,NO3-的去除率低。其原因是_____________________________ 。

II.铁生锈是比较常见的现象,某实验小组为研究铁生锈的条件,设计了以下快速、易行的方法:首先检查制氧气装置的气密性,然后按上图连接好装置,点燃酒精灯给药品加热,持续3分钟左右,观察到实验现象为:①硬质玻璃管中干燥的团状细铁丝表面依然光亮,没有发生锈蚀;②硬质玻璃管中潮湿的团状细铁丝表面颜色变得灰暗,发生锈蚀;③烧杯中潮湿的团状细铁丝依然光亮。
试回答以下问题:
(1)由于与金属接触的介质不同,金属腐蚀分成不同类型,本实验中铁生锈属于_______ 。能表示其原理的正极反应式为________________________ 。
(2)大试管中发生的反应方程式为______________________________________ 。
(3)仪器A的名称为_______________ ,其中装的药品可以是_______________ 。
(4)有实验可知,决定铁生锈快慢的一个重要因素是___________________ 。
I.用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一。
(1)Fe还原水体中NO3-的反应原理如下图所示:

①作负极的物质是
②正极的电极反应式是
(2)将足量铁粉投入水体中,经24小时测定NO3-的去除率和pH,结果如下:
| 初始pH | pH=2.5 | pH=4.5 |
| NO3-去除率 | 接近100% | <50% |
| 24小时pH | 接近中性 | 接近中性 |
| 铁的最终物质形态 | 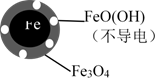 |  |
pH=4.5时,NO3-的去除率低。其原因是

II.铁生锈是比较常见的现象,某实验小组为研究铁生锈的条件,设计了以下快速、易行的方法:首先检查制氧气装置的气密性,然后按上图连接好装置,点燃酒精灯给药品加热,持续3分钟左右,观察到实验现象为:①硬质玻璃管中干燥的团状细铁丝表面依然光亮,没有发生锈蚀;②硬质玻璃管中潮湿的团状细铁丝表面颜色变得灰暗,发生锈蚀;③烧杯中潮湿的团状细铁丝依然光亮。
试回答以下问题:
(1)由于与金属接触的介质不同,金属腐蚀分成不同类型,本实验中铁生锈属于
(2)大试管中发生的反应方程式为
(3)仪器A的名称为
(4)有实验可知,决定铁生锈快慢的一个重要因素是
您最近一年使用:0次
名校
9 . 下列装置中Fe片腐蚀最慢的是
A.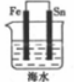 | B. | C. | D.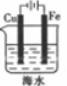 |
您最近一年使用:0次
2018-01-31更新
|
211次组卷
|
2卷引用:河北省承德市联校2017-2018学年高二上学期期末考试化学试题
10 . 防止金属锈蚀的方法有多种,如图表示保护铁管的方法为


| A.牺牲阳极的阴极保护法 | B.改变金属的组成和结构法 |
| C.外加电流的阴极保护法 | D.表面覆盖保护层法 |
您最近一年使用:0次



