1 . 如图1是元素周期表的一部分。回答下列问题:
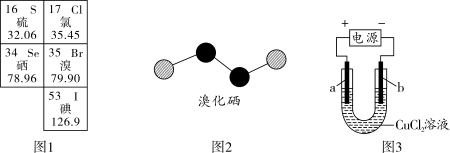
(1)硒是人体必需的微量元素。
①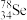 与
与 互称为
互称为_______ 。
②硒元素的气态氢化物的化学式为_______ 。
(2)溴被称为海洋元素。
①溴元素在周期表中的位置为_______ 。
②表中与溴同主族的元素中,最高价氧化物对应的水化物酸性最强的是_______ (填化学式)。
③溴化硒是一种重要的电子元件材料,其分子的球棍模型如图2所示。下列说法正确的是_______ (填字母)。
a.溴化硒属于离子化合物 b.原子半径:r(Se)>r(Br)
c.Se元素的非金属性比Br的强 d.溴化硒的相对分子质量为317.72
(3)氯是卤族元素之一,电解氯化铜溶液可以得到Cl2,实验装置如图3所示。(已知a、b均为石墨电极)
①分别用湿润的淀粉碘化钾试纸置于a、b上方,可观察到的现象是_______ 。
②a电极上的电极反应式为_______ 。
(4)下列事实不能说明氯的非金属性比硫强的是_______ (填字母)。
a.化合物SCl2中硫显正价而氯显负价
b.热稳定性:HCl>H2S
c.将氯气通入Na2S溶液中,有淡黄色沉淀生成
d.次氯酸的氧化性比稀硫酸的氧化性强

(1)硒是人体必需的微量元素。
①
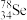 与
与 互称为
互称为②硒元素的气态氢化物的化学式为
(2)溴被称为海洋元素。
①溴元素在周期表中的位置为
②表中与溴同主族的元素中,最高价氧化物对应的水化物酸性最强的是
③溴化硒是一种重要的电子元件材料,其分子的球棍模型如图2所示。下列说法正确的是
a.溴化硒属于离子化合物 b.原子半径:r(Se)>r(Br)
c.Se元素的非金属性比Br的强 d.溴化硒的相对分子质量为317.72
(3)氯是卤族元素之一,电解氯化铜溶液可以得到Cl2,实验装置如图3所示。(已知a、b均为石墨电极)
①分别用湿润的淀粉碘化钾试纸置于a、b上方,可观察到的现象是
②a电极上的电极反应式为
(4)下列事实不能说明氯的非金属性比硫强的是
a.化合物SCl2中硫显正价而氯显负价
b.热稳定性:HCl>H2S
c.将氯气通入Na2S溶液中,有淡黄色沉淀生成
d.次氯酸的氧化性比稀硫酸的氧化性强
您最近一年使用:0次
2 . 根据题给信息回答问题
(1)某元素原子的价电子构型为4s24p1,它属于第___________ 周期第___________ 族,属于___________ 区元素。
(2)在1~18号元素中,除稀有气体元素外,原子半径最大的元素是___________ (用元素符号表示,下同),电负性最大的元素是___________ ;第一电离能最大的元素是___________ 。第三周期原子半径最小的主族元素的价电子排布式为___________ 。
(3)写出Cu+的核外电子排布式:___________ 。按电子排布,可将周期表中的元素划分成五个区域,第四周期元素中属于s区的元素有___________ 种,
(4)某元素原子的3p轨道有1个未成对电子,该元素为___________ (用元素符号表示)。
(1)某元素原子的价电子构型为4s24p1,它属于第
(2)在1~18号元素中,除稀有气体元素外,原子半径最大的元素是
(3)写出Cu+的核外电子排布式:
(4)某元素原子的3p轨道有1个未成对电子,该元素为
您最近一年使用:0次
2021-07-20更新
|
502次组卷
|
5卷引用:吉林省通化县综合高级中学2020-2021学年高二下学期期末考试化学试题
吉林省通化县综合高级中学2020-2021学年高二下学期期末考试化学试题(已下线)第一章 原子结构与性质 章节过关检测-2021-2022学年高二化学链接教材精准变式练(人教版2019选择性必修2)黑龙江省齐齐哈尔市第八中学2021-2022学年高二下学期开学考试化学试题广西钦州市第四中学2022-2023学年高二下学期2月考试化学试题(已下线)专题01 物质的结构与性质-备战2023-2024学年高二化学下学期期末真题分类汇编(辽宁、黑龙江、吉林专用)
20-21高一下·浙江·阶段练习
解题方法
3 . 按要求回答下列问题:
(1)异丁烷的结构简式为___________ 。
(2)地壳中含量最高的金属元素在元素周期表中的位置___________ 。
(3)NaOH的电子式为___________ 。
(4)二氧化氮溶于水时生成硝酸和一氧化氮,工业上利用这一原理生成硝酸。写出该反应的化学方程式___________ 。
(1)异丁烷的结构简式为
(2)地壳中含量最高的金属元素在元素周期表中的位置
(3)NaOH的电子式为
(4)二氧化氮溶于水时生成硝酸和一氧化氮,工业上利用这一原理生成硝酸。写出该反应的化学方程式
您最近一年使用:0次
名校
4 . 图中是4种粒子的结构示意图:
A.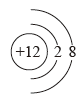 B.
B. 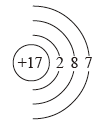 C.
C. 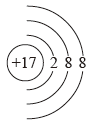 D.
D. 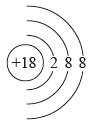
图中粒子共能表示_______ 种元素,图中表示的阴离子是_______ (用电子式表示), 图中A所表示的元素在元素周期表中的位置_______ 。
A.
 B.
B.  C.
C.  D.
D. 
图中粒子共能表示
您最近一年使用:0次
名校
5 . (I)下面是我们熟悉的物质:①O2 ②金刚石 ③NaBr ④H2SO4 ⑤Na2CO3
⑥NH4Cl ⑦NaHSO4 ⑧Ne ⑨Na2O2 ⑩NaOH
(1)这些物质中,属于共价化合物的是_____ 。
(2) NaHSO4熔融状态下电离,其电离方程式:_____________ 。
(3) NaOH中含有的化学键为离子键和____________ (极性共价键或非极性共价键)。
(Ⅱ)下表列出了①~⑦七种元素在周期表中的位置:
请按要求回答下列问题。
(1)元素④的原子结构示意图是________ 。
(2)在相同条件下,元素②③④的单质分别与盐酸反应,反应最慢的是________ (填化学式),这三种元素最高价氧化物对应水化物有两者能相互反应,其反应离子方程式为__________ 。
(3)元素⑤⑥⑦的气态氢化物中稳定性最弱的是________ (填化学式),沸点最高的是_____ (填化学式),其沸点最高的原因为________ 。
⑥NH4Cl ⑦NaHSO4 ⑧Ne ⑨Na2O2 ⑩NaOH
(1)这些物质中,属于共价化合物的是
(2) NaHSO4熔融状态下电离,其电离方程式:
(3) NaOH中含有的化学键为离子键和
(Ⅱ)下表列出了①~⑦七种元素在周期表中的位置:
| IA | 0 | |||||||
| 一 | ① | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | |
| 二 | ⑤ | |||||||
| 三 | ② | ③ | ④ | ⑥ | ||||
| 四 | ⑦ | |||||||
请按要求回答下列问题。
(1)元素④的原子结构示意图是
(2)在相同条件下,元素②③④的单质分别与盐酸反应,反应最慢的是
(3)元素⑤⑥⑦的气态氢化物中稳定性最弱的是
您最近一年使用:0次
6 . 元素周期表的建立是化学发展史上重要的里程碑之一,它揭示了元素之间的内在联系。如图是元素周期表的短周期示意图,相应方格中每个序号代表处于该位置的一种元素。
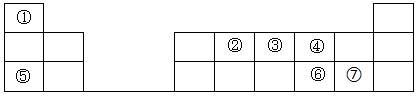
请回答下列问题:
(1)元素①的名称为___ 。
(2)元素③的最高价氧化物的水化物为___ (填化学式)
(3)⑥和⑦两种元素的气态氢化物中稳定性较强的是___ (填化学式)。
(4)②和④两种元素形成的常见气态化合物中化学键类型为___ 。
(5)⑤和⑦两种元素形成的化合物的电子式为___ 。

请回答下列问题:
(1)元素①的名称为
(2)元素③的最高价氧化物的水化物为
(3)⑥和⑦两种元素的气态氢化物中稳定性较强的是
(4)②和④两种元素形成的常见气态化合物中化学键类型为
(5)⑤和⑦两种元素形成的化合物的电子式为
您最近一年使用:0次
名校
解题方法
7 . 如图是元素周期表中的一部分,请结合元素周期表和元素周期律回答下列问题。
(1)画出N的原子结构示意图:___ 。
(2)Na与Cl相比,原子半径较大的是:___ 。
(3)F、Cl分别形成的气态氢化物中,更稳定的氢化物是___ 。
周期 族 | ⅠA | 0 | |||||||
| 1 | H | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | He | |
| 2 | Li | Be | B | C | N | O | F | Ne | |
| 3 | Na | Mg | ...... | Al | Si | P | S | Cl | Ar |
(2)Na与Cl相比,原子半径较大的是:
(3)F、Cl分别形成的气态氢化物中,更稳定的氢化物是
您最近一年使用:0次
20-21高一下·浙江·阶段练习
解题方法
8 . (1)①写出52号元素在元素周期表中的位置___ 。
②用电子式表示MgCl2的形成过程___ 。
(2)现在需配制0.1mol/L的Na2CO3溶液480mL,需要用托盘天平称量Na2CO3固体__ g。
(3)写出碳酸钠溶液和过量盐酸反应的离子方程式___ 。
②用电子式表示MgCl2的形成过程
(2)现在需配制0.1mol/L的Na2CO3溶液480mL,需要用托盘天平称量Na2CO3固体
(3)写出碳酸钠溶液和过量盐酸反应的离子方程式
您最近一年使用:0次
20-21高一下·浙江·阶段练习
解题方法
9 . 1869年,俄国化学家门捷列夫制作出了第一张元素周期表,揭示了化学元素间的内在联系,成为化学发展史上的重要里程碑之一。下表是元素周期表的一部分:
注意:用元素符号或化学式填空。
(1)①到⑩号元素中,所形成的氢化物最稳定的是___________ ,最高价氧化物对应的水化物酸性最强的是___________ 。③号元素在元素周期表中的位置是___________ 。
(2)实验室制备②的气态氢化物的化学方程式为___________ 。
(3)元素⑤的最高价氧化物对应水化物含有的化学键类型为:___________ (选填“离子键”“极性键”“非极性键”),其与⑦的最高价氧化物所对应的水化物能相互反应,反应的离子方程式是:___________ 。
(4)下列说法正确的是___________
A.碱金属单质的金属性很强,均易与氧气发生反应,加热时生成的氧化物为R2O
B.一定条件下,随着核电荷数的增加,卤素单质与H2化合越来越难
C.随着核电荷数的增加,卤族单质的氧化性逐渐增强
D.周期表七行七个周期,18列16族
| ① | ||||||||
| ② | ③ | ④ | ||||||
| ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ||||
| 过渡元素 | ⑩ |
注意:用元素符号或化学式填空。
(1)①到⑩号元素中,所形成的氢化物最稳定的是
(2)实验室制备②的气态氢化物的化学方程式为
(3)元素⑤的最高价氧化物对应水化物含有的化学键类型为:
(4)下列说法正确的是
A.碱金属单质的金属性很强,均易与氧气发生反应,加热时生成的氧化物为R2O
B.一定条件下,随着核电荷数的增加,卤素单质与H2化合越来越难
C.随着核电荷数的增加,卤族单质的氧化性逐渐增强
D.周期表七行七个周期,18列16族
您最近一年使用:0次



