1 . 铍可应用于飞机、火箭制造业和原子能工业。素有“中国铍业一枝花”之称的湖南水口山六厂改进国外生产工艺,以硅铍石(主要成分为 、
、 、
、 、
、 、
、 )为原料提取铍,具体流程如下:
)为原料提取铍,具体流程如下:
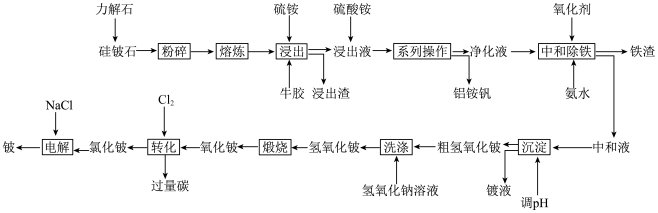
已知:①铍和铝在元素周期表中处于对角线位置,电负性相近,其单质及化合物在结构与性质等方面具有相似性。
②铝铵钒在不同温度下的溶解度:
回答下列问题:
(1)流程中“系列操作”为___________ 。
(2)将“中和液”沉淀时,调节溶液的 不能过大或过小。
不能过大或过小。 过大时发生反应的离子方程式为
过大时发生反应的离子方程式为___________ 。
(3)已知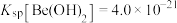 ,
,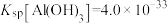 。若
。若 浓度为0.40
浓度为0.40 的中和液开始沉淀时,溶液中
的中和液开始沉淀时,溶液中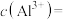
___________  。
。
(4)若在实验室洗涤粗 ,操作为
,操作为___________ ;洗涤时加入 溶液除去表面吸附的少量氢氧化铝,反应的离子方程式为
溶液除去表面吸附的少量氢氧化铝,反应的离子方程式为___________ 。
(5)氧化铍转化为氯化铍的化学方程式为___________ 。
(6) 的电子式为
的电子式为___________ ;电解时须加入氯化钠的作用是___________ 。
 、
、 、
、 、
、 、
、 )为原料提取铍,具体流程如下:
)为原料提取铍,具体流程如下:
已知:①铍和铝在元素周期表中处于对角线位置,电负性相近,其单质及化合物在结构与性质等方面具有相似性。
②铝铵钒在不同温度下的溶解度:
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 60 |
| 溶解度/g | 2.10 | 5.00 | 7.74 | 10.9 | 14.9 | 26.7 |
(1)流程中“系列操作”为
(2)将“中和液”沉淀时,调节溶液的
 不能过大或过小。
不能过大或过小。 过大时发生反应的离子方程式为
过大时发生反应的离子方程式为(3)已知
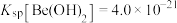 ,
,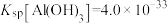 。若
。若 浓度为0.40
浓度为0.40 的中和液开始沉淀时,溶液中
的中和液开始沉淀时,溶液中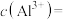
 。
。(4)若在实验室洗涤粗
 ,操作为
,操作为 溶液除去表面吸附的少量氢氧化铝,反应的离子方程式为
溶液除去表面吸附的少量氢氧化铝,反应的离子方程式为(5)氧化铍转化为氯化铍的化学方程式为
(6)
 的电子式为
的电子式为
您最近一年使用:0次
2021-05-11更新
|
1097次组卷
|
4卷引用:山东省青岛市2021届高三二模化学试题
山东省青岛市2021届高三二模化学试题(已下线)专题16 工艺流程综合题-备战2022年高考化学真题及地市好题专项集训【山东专用】湖北省宜昌英杰学校2021-2022学年高三上学期10月月考化学试题(已下线)05 无机化工流程题(5) (解析)-备战2023年高考化学大题逐空突破系列(全国通用)
名校
2 . X、Y、Z、M、N分别为五种原子序数不大于20的元素,X的原子的基态价电子排布式为2s2,Y的基态原子核外有5种运动状态不同的电子,Z元素形成的化合物在自然界中种类最多,M的阳离子通常存在于硝石、明矾和草木灰中,N的原子序数比M大1。下列说法正确的是
| A.熔点:Y4Z晶体低于单质Z |
| B.X与Al的某些化学性质相似,XO是两性氧化物 |
| C.M的阳离子半径是同周期主族元素的简单离子中半径最大的 |
| D.NZ2仅含离子键,可用于制备乙炔 |
您最近一年使用:0次
2020-09-25更新
|
276次组卷
|
4卷引用:山东省济南市历城第二中学2022届高三上学期开学考试化学试卷(A)
山东省济南市历城第二中学2022届高三上学期开学考试化学试卷(A)山东省聊城市第二中学2022-2023学年高三上学期开学考试化学试题北京市清华大学附属中学中学生标准学术能力基础性测试2021届高三9月测试化学试题(已下线)北京市清华大学附属中学2021届高三上学期9月月考化学试题
名校
3 . 化学的特征之一是从微观的层面认识物质。通过结合元素周期表与周期律,建立“位置·结构·性质”思维模型,我们可以更好地认识物质世界。
(一) X、Y、Z、M、W、Q、R是分布在周期表中三个短周期的主族元素,已知其原子半径及主要化合价如下:
(1)X在周期表中的位置是________ ;Y、Q各自形成的简单离子中,半径较大的是______ (填离子符号)。W和R按原子个数比1:4构成的阳离子中所含的化学键类型为_________ 。
(2)M与Z相比,非金属性较强的是____________ (填元素名称),两元素最高价氧化物的水化物中,酸性较强的是________________ (填化学式)。
(二)周期表中位于斜对角线(左上与右下)的两种元素性质十分相似,称为对角线法则。如锂与镁、铍与铝等,其单质或化合物的性质可参照对角线法则进行认识。
(3)锂在空气中燃烧主要产物的电子式是___________ ,同时生成微量的________ 、______ (写化学式)。
(4)下列关于铍的判断正确的是___________
A.氧化铍的化学式为Be2O3 B.Be(OH)2可溶于水
C.BeCl2是离子化合物 D.Be(OH)2具有两性
(5)Be(OH)2和Mg(OH)2可用试剂________________ 鉴别。
(一) X、Y、Z、M、W、Q、R是分布在周期表中三个短周期的主族元素,已知其原子半径及主要化合价如下:

(1)X在周期表中的位置是
(2)M与Z相比,非金属性较强的是
(二)周期表中位于斜对角线(左上与右下)的两种元素性质十分相似,称为对角线法则。如锂与镁、铍与铝等,其单质或化合物的性质可参照对角线法则进行认识。
(3)锂在空气中燃烧主要产物的电子式是
(4)下列关于铍的判断正确的是
A.氧化铍的化学式为Be2O3 B.Be(OH)2可溶于水
C.BeCl2是离子化合物 D.Be(OH)2具有两性
(5)Be(OH)2和Mg(OH)2可用试剂
您最近一年使用:0次
名校
4 . X、Y、Z、M、Q、R是6种短周期元素,其原子半径及主要化合价如下:
(1)Z在元素中期表中的位置是______________________________ 。
(2)X、Y、Q各自形成简单离子,其中离子半径最大的是__________ (填离子符号)。
(3)周期表中有些处于对角线(左上→右下)位置的元素,它们的单质及其化合物的性质相似,则M的氧化物与强碱溶液反应的离子方程式______________________________ 。
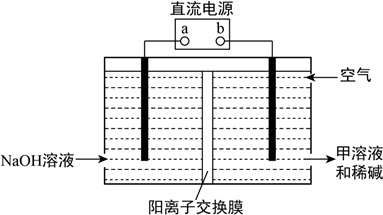
(4)Q和R按原子个数比1:1组成的化合物甲是一种“绿色”氧化剂。
①甲中所含共价键类型是____________________ 。
②空气阴极法电解制备甲的装置如图所示。在碱性溶液中,利用空气中的氧气还原得到甲和稀碱的溶液。图中a是__________ 极,阴极的电极反应式是____________________ 。
| 元素代号 | X | Y | Z | M | Q | R |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 | 0.037 |
| 主要化合价 | +2 | +3 | +6,-2 | +2 | -2 | +1 |
(1)Z在元素中期表中的位置是
(2)X、Y、Q各自形成简单离子,其中离子半径最大的是
(3)周期表中有些处于对角线(左上→右下)位置的元素,它们的单质及其化合物的性质相似,则M的氧化物与强碱溶液反应的离子方程式
(4)Q和R按原子个数比1:1组成的化合物甲是一种“绿色”氧化剂。
①甲中所含共价键类型是
②空气阴极法电解制备甲的装置如图所示。在碱性溶液中,利用空气中的氧气还原得到甲和稀碱的溶液。图中a是

您最近一年使用:0次
2018-01-10更新
|
237次组卷
|
4卷引用:2016届山东省枣庄三中高三上学期12月质检化学试卷



