名校
1 . 已知 为短周期主族元素,
为短周期主族元素, 、
、 为第四周期元素,它们的原子序数依次增大。
为第四周期元素,它们的原子序数依次增大。
(1)已知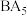 为离子化合物,写出其电子式
为离子化合物,写出其电子式___________ 。
(2)B基态原子中能量最高的电子,其电子云在空间有___________ 个方向,原子轨道呈___________ 形。
(3)实验室制备 的单质的离子反应方程式为
的单质的离子反应方程式为___________ 。
(4)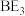 在常温下是一种淡黄色的液体,其遇水即发生反应可生成一种具有漂白性的物质,写出反应的化学方程式
在常温下是一种淡黄色的液体,其遇水即发生反应可生成一种具有漂白性的物质,写出反应的化学方程式___________ ;该反应说明其中B和 中非金属性较强的是
中非金属性较强的是___________ (填元素的符号)。
(5)C与D的第一电离能大小为___________ 。D与 的最高价氧化物对应水化物相互反应的离子方程式为
的最高价氧化物对应水化物相互反应的离子方程式为___________ 。
(6) 价电子排布图为
价电子排布图为___________ ,位于___________ 区。 元素的原子结构示意图为
元素的原子结构示意图为___________ ,前四周期中未成对电子数最多的元素在周期表中位置为___________ 。
 为短周期主族元素,
为短周期主族元素, 、
、 为第四周期元素,它们的原子序数依次增大。
为第四周期元素,它们的原子序数依次增大。| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
B元素原子的核外 电子数比 电子数比 电子数少1 电子数少1 |
C原子的第一至第四电离能分别是: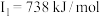 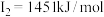 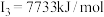 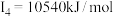 |
| D元素简单离子半径是该周期中最小的 |
| E元素是该周期电负性最大的元素 |
| F所在族的元素种类是周期表中最多的 |
| G在周期表的第十一列 |
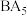 为离子化合物,写出其电子式
为离子化合物,写出其电子式(2)B基态原子中能量最高的电子,其电子云在空间有
(3)实验室制备
 的单质的离子反应方程式为
的单质的离子反应方程式为(4)
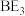 在常温下是一种淡黄色的液体,其遇水即发生反应可生成一种具有漂白性的物质,写出反应的化学方程式
在常温下是一种淡黄色的液体,其遇水即发生反应可生成一种具有漂白性的物质,写出反应的化学方程式 中非金属性较强的是
中非金属性较强的是(5)C与D的第一电离能大小为
 的最高价氧化物对应水化物相互反应的离子方程式为
的最高价氧化物对应水化物相互反应的离子方程式为(6)
 价电子排布图为
价电子排布图为 元素的原子结构示意图为
元素的原子结构示意图为
您最近一年使用:0次
名校
解题方法
2 . 短周期元素a、b、c、d的原子序数依次增大,在下列转化关系中,甲、乙、丙、丁、戊为上述元素组成的二元或三元化合物。其中A为d元素组成的单质,常温下乙为液体,丁物质常用于消毒、漂白。下列说法错误的是

| A.简单离子半径:c>b |
| B.丙中既有离子键又有极性键 |
| C.b、c形成的化合物中阴、阳离子数目比为1∶2 |
| D.b、c、d形成的化合物中,d的杂化方式是sp3 |
您最近一年使用:0次
名校
3 . 一种化合物的结构如图所示,Q、X、Y、Z、W为原子序数依次增大的短周期主族元素,W元素的最外层电子数等于其电子总数的三分之一、下列说法正确的是
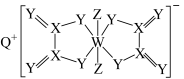

| A.简单氢化物的稳定性Y>Z |
| B.X、Y的氢化物分子中均只含有极性键 |
| C.最高价氧化物对应水化物的酸性w>X |
| D.Q的单质在空气中燃烧的产物具有强氧化性 |
您最近一年使用:0次
名校
4 . 如表为部分元素的特点
请回答下列问题:
(1)若火灾现场存放大量Y,需要用______ 灭火;化合物Y2X2中存在的化学键类型为______ 。
(2)向含+3价L离子的溶液中滴加KI溶液,再滴入淀粉溶液,溶液呈______ 色,说明还原性有:L2+______ I-(填“>”或“<”);
(3)混合物甲由两种常见化合物组成,每种化合物含X、Y、Z、Q四种元素中的至少三种元素,在向甲中逐滴滴加盐酸的过程中,产生的QX2气体的物质的量与滴加的盐酸体积关系如图所示:
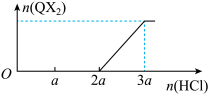
由此可知,混合物甲的组成为______ (填化学式),两者的物质的量之比为______ 。
(4)使用下列装置再添加合适的药品,可以证明R和Q两种元素的非金属性强弱顺序,可供选择的药品为:①浓硫酸 ②稀硫酸 ③盐酸 ④Na2CO3固体 ⑤CaCO3⑥澄清石灰水 ⑦NaOH溶液
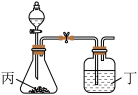
请选择装置丙、丁两处应该加入的药品代号:丙______ 、丁______ 。
| 特点 | 元素代号 |
| 地壳中含量最高的元素 | X |
| +1价阳离子L层充满电子 | Y |
| 原子半径最小的原子 | Z |
| 一种同位素可以用于考古 | Q |
| 与上述代号为Z的元素形成分子Z2R,其摩尔质量为34g/mol | R |
| 其合金用量最大,用途最广 | L |
(1)若火灾现场存放大量Y,需要用
(2)向含+3价L离子的溶液中滴加KI溶液,再滴入淀粉溶液,溶液呈
(3)混合物甲由两种常见化合物组成,每种化合物含X、Y、Z、Q四种元素中的至少三种元素,在向甲中逐滴滴加盐酸的过程中,产生的QX2气体的物质的量与滴加的盐酸体积关系如图所示:

由此可知,混合物甲的组成为
(4)使用下列装置再添加合适的药品,可以证明R和Q两种元素的非金属性强弱顺序,可供选择的药品为:①浓硫酸 ②稀硫酸 ③盐酸 ④Na2CO3固体 ⑤CaCO3⑥澄清石灰水 ⑦NaOH溶液

请选择装置丙、丁两处应该加入的药品代号:丙
您最近一年使用:0次
2023-03-09更新
|
269次组卷
|
2卷引用:黑龙江省双鸭山市第一中学2023-2024学年高一下学期开学化学试题
名校
解题方法
5 . 几种短周期元素的原子半径及主要化合价如表所示:
下列叙述正确的是
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 75 | 74 |
| 主要化合价 | +2 | +3 | +5、-3 | -2 |
A.X、Y的最高价氧化物对应水化物的碱性: |
B.简单离子的半径: |
| C.Y与W形成的化合物既能与酸反应又能与强碱反应 |
| D.Y与Z形成的化合物中既含有离子键又含有共价键 |
您最近一年使用:0次
名校
解题方法
6 . A、X、W、D、E为短周期主族元素,且原子序数依次增大。A、D同主族,X、W同周期, X形成的气态氢化物化学式为XH3,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等。
(1)E元素在周期表中的位置为___________ 。W的原子结构示意图为___________ 。
(2)D单质在空气中燃烧的化学方程式是___________ 。
(3)D、E的最高价氧化物的水化物反应的离子方程式是___________ 。
(4)离子半径关系:r(A-)___________ r(Li+)(填“>”、“=”或“<”)
(5)下列事实能说明W元素的非金属性比硫元素的非金属性强的是___________ (填字母)。
A.W单质与H2S溶液反应,溶液变浑浊
B.在氧化还原反应中,1 mol W单质比1 mol S得电子多
C.W和S两元素的简单氢化物受热分解,前者的分解温度高
(6)废印刷电路板上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解。现在改用A2W2和稀硫酸浸泡废印刷电路板既达到上述目的,又保护了环境,试写出反应的离子方程式___________ 。
(1)E元素在周期表中的位置为
(2)D单质在空气中燃烧的化学方程式是
(3)D、E的最高价氧化物的水化物反应的离子方程式是
(4)离子半径关系:r(A-)
(5)下列事实能说明W元素的非金属性比硫元素的非金属性强的是
A.W单质与H2S溶液反应,溶液变浑浊
B.在氧化还原反应中,1 mol W单质比1 mol S得电子多
C.W和S两元素的简单氢化物受热分解,前者的分解温度高
(6)废印刷电路板上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解。现在改用A2W2和稀硫酸浸泡废印刷电路板既达到上述目的,又保护了环境,试写出反应的离子方程式
您最近一年使用:0次
2021-12-27更新
|
529次组卷
|
2卷引用:黑龙江省哈尔滨师范大学青冈实验中学校2021-2022学年高一下学期开学考试化学试题
名校
7 . 短周期主族元素X、Y、Z、W原子序数依次增大,X原子最外层有6个电子,Y是至今发现的非金属性最强的元素,Z在周期表中处于周期序数等于族序数的位置,W的单质可用作计算机芯片。下列叙述正确的是
| A.原子半径由大到小的顺序:W、Z、Y、X |
| B.简单气态氢化物的稳定性由强到弱的顺序:Y、W、X |
| C.半导体器件的研制开始于W元素 |
| D.元素Z可以形成离子化合物也可以形成共价化合物 |
您最近一年使用:0次
名校
解题方法
8 . 短周期元素W、X、Y和Z的原子序数依次增大。W、X位于同周期,X、Z的原子最外层电子数分别是其电子层数的2倍,元素Y是地壳中含量最丰富的金属元素,W和Y的原子最外层电子数之和等于Z的原子最外层电子数与最内层电子数之差。下列说法正确的是
| A.常温下,元素X与氢形成的化合物都是气体 |
| B.元素W、X的氯化物中,各原子均满足8电子稳定结构 |
| C.元素Z与元素X形成的化合物中仅含有极性共价键 |
| D.元素Y的最高价氧化物对应的水化物可溶于氨水 |
您最近一年使用:0次
2021-07-07更新
|
139次组卷
|
6卷引用:黑龙江省双鸭山市第一中学2021-2022学年高三下学期开学考试理综化学试题
名校
9 . X、Y、Z、M、W为五种短周期元素,X、Y、Z是原子序数依次增大的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76g·L−1;W的质子数是X、Y、Z、M四种元素质子数之和的 。下列说法正确的是
。下列说法正确的是
 。下列说法正确的是
。下列说法正确的是| A.简单离子半径:W+>Y3->X2->M+ |
| B.化合物W2Z2的阴阳离子个数之比为1:1,水溶液显碱性 |
| C.1molWM溶于足量水中完全反应,共转移2mol电子 |
| D.由X、Y、Z、M四种元素形成的化合物中可能含有离子键 |
您最近一年使用:0次
2021-03-15更新
|
264次组卷
|
3卷引用:黑龙江省哈尔滨市第六中学2020-2021学年高一下学期线下开学考试化学试题
10 . 短周期主族元素X、Y、Z、W的原子序数依次增大,X原子最外层电子数是内层电子数的2倍,Y是地壳中含量最多的元素,Z元素的金属性在短周期中最强,W与Y位于同一主族。下列说法正确的是
| A.简单离子半径:Y<Z< W |
| B.Y与Z组成的化合物中不可能含共价键 |
| C.X的简单气态氢化物的热稳定性比Y的弱 |
| D.X的最高价氧化物对应水化物的酸性比W的强 |
您最近一年使用:0次
2021-03-14更新
|
432次组卷
|
2卷引用:黑龙江省绥化市重点高中2021-2022学年高二上学期返校验收考试化学试题



