名校
解题方法
1 . 部分短周期主族元素的原子半径和主要化合价的关系如图所示,其中E、G、T位于同一周期。回答下列问题:

(1)B位于第_______ 周期第______ 族。
(2)FDB的电子式为_______ ;T的原子结构示意图为_______ 。
(3)设计简单实验证明D的非金属性比C的强:________ 。
(4)A和D的简单氢化物相遇产生“白烟”,其生成物的化学式是_______ 。
(5)在上述元素的最高价氧化物对应的水化物中,酸性最强的是_______ (填化学式,下同),碱性最强的是_______ ;上述非金属元素的简单氢化物中,沸点最高的是_______ ,还原性最强的是_______ 。
(6)G、D的最高价氧化物对应的水化物之间发生反应的化学方程式为_______ 。

(1)B位于第
(2)FDB的电子式为
(3)设计简单实验证明D的非金属性比C的强:
(4)A和D的简单氢化物相遇产生“白烟”,其生成物的化学式是
(5)在上述元素的最高价氧化物对应的水化物中,酸性最强的是
(6)G、D的最高价氧化物对应的水化物之间发生反应的化学方程式为
您最近半年使用:0次
2023-10-27更新
|
170次组卷
|
2卷引用:湖南省炎德·英才·名校联考联合体2023-2024学年高三上学期第三次联考化学试题
名校
解题方法
2 . 已知A、B、C、D为原子序数依次增大的短周期元素,E为地壳中含量最高的过渡金属元素,A与D同主族,B与C同周期,且C与D的原子序数之和为20,C单质能与无色无味液体m反应置换出B单质,D单质也能与m反应置换出A单质,A、B、C均能与D形成离子化合物,下列说法不正确 的是
| A.B、E两元素的形成的化合物都为黑色固体 | B.B、D形成的离子化合物可能含有共价键 |
| C.D的单质只有还原性,没有氧化性 | D.A、B、C分别与D形成的化合物水溶液均显碱性 |
您最近半年使用:0次
2020-10-10更新
|
461次组卷
|
3卷引用:辽宁省实验中学东戴河校区2021届高三上学期第一次月考化学试题
名校
解题方法
3 . 短周期主族元素X、Y、Z、W的原子序数依次增大。在如图所示的物质转化关系中,p、q、m、n分别是元素W、X、Y、Z的气体单质,p和s均为有色气体,v的水溶液呈碱性。常温下,0.1mol·L-1t溶液与0.1mol·L−1u溶液的pH均为1。下列说法不正确的是( )
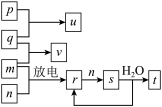

| A.Y、W的最高价氧化物对应的水化物均为强酸 |
| B.元素的非金属性:Z>Y>X,原子半径:X<Z<Y |
| C.s溶于水的反应中,氧化剂与还原剂的物质的量之比为1:2 |
| D.v只有还原性,r既有还原性又有氧化性 |
您最近半年使用:0次
名校
4 . Q、R、X、Y、Z、A是原子序数依次增大的短周期元素,在短周期的所有元素中Q的原子半径与Z的原子半径之比最小(不包括稀有气体),R、X、Y三种元素的原子核外电子层数相同,同一周期中R的一种单质的熔点最高,Y与Q、R、X、Z均能形成多种常见化合物。元素A、Y在周期表中位于同一主族。
(1)X原子核外有_______ 种不同形状的电子云。这六种元素中,最外层有两个未成对电子的元素是_______ (用元素符号表示)。
(2)Q分别与X、Y形成的最简单化合物的稳定性_______ >_______ (用分子式表示)。
(3)Q与R两元素组成的分子构型可能是_______(填写序号)。
(4)化合物 和
和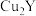 可发生如下转化(其中D是淀粉水解的最终产物):
可发生如下转化(其中D是淀粉水解的最终产物):
Cu2A 澄清溶液
澄清溶液 悬浊液
悬浊液 Cu2Y
Cu2Y
澄清溶液呈_______ 色,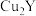 显
显_______ 色。
 的氧化性随pH的减小而增大。其在酸性介质中还原产物是
的氧化性随pH的减小而增大。其在酸性介质中还原产物是 ;在中性或碱性介质中还原产物主要是
;在中性或碱性介质中还原产物主要是 。
。
(5)应该在_______ (选填“酸性”、“碱性”或“中性”)介质中制备 。
。
(6)三氯乙烯 是地下水有机污染物的主要成分,研究显示在地下水中加入
是地下水有机污染物的主要成分,研究显示在地下水中加入 溶液可将其中的三氯乙烯除去,氧化产物只有
溶液可将其中的三氯乙烯除去,氧化产物只有 ,完成反应的化学方程式
,完成反应的化学方程式_______
_______ _______
_______ _______KCl+_______
_______KCl+_______ _______
_______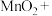 _______HCl
_______HCl
(7)加入过量的 才能将水中的三氯乙烯彻底除去。已知
才能将水中的三氯乙烯彻底除去。已知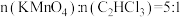 时,水样中的三氯乙烯基本完全去除。某地下水样品中三氯乙烯的质量浓度为
时,水样中的三氯乙烯基本完全去除。某地下水样品中三氯乙烯的质量浓度为 ,计算每处理
,计算每处理 该地下水,需
该地下水,需
_______ g。
(1)X原子核外有
(2)Q分别与X、Y形成的最简单化合物的稳定性
(3)Q与R两元素组成的分子构型可能是_______(填写序号)。
| A.直线型 | B.平面形 | C.三角锥形 | D.正四面体 |
 和
和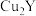 可发生如下转化(其中D是淀粉水解的最终产物):
可发生如下转化(其中D是淀粉水解的最终产物):Cu2A
 澄清溶液
澄清溶液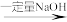 悬浊液
悬浊液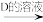 Cu2Y
Cu2Y澄清溶液呈
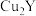 显
显 的氧化性随pH的减小而增大。其在酸性介质中还原产物是
的氧化性随pH的减小而增大。其在酸性介质中还原产物是 ;在中性或碱性介质中还原产物主要是
;在中性或碱性介质中还原产物主要是 。
。(5)应该在
 。
。(6)三氯乙烯
 是地下水有机污染物的主要成分,研究显示在地下水中加入
是地下水有机污染物的主要成分,研究显示在地下水中加入 溶液可将其中的三氯乙烯除去,氧化产物只有
溶液可将其中的三氯乙烯除去,氧化产物只有 ,完成反应的化学方程式
,完成反应的化学方程式_______
 _______
_______ _______KCl+_______
_______KCl+_______ _______
_______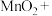 _______HCl
_______HCl(7)加入过量的
 才能将水中的三氯乙烯彻底除去。已知
才能将水中的三氯乙烯彻底除去。已知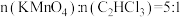 时,水样中的三氯乙烯基本完全去除。某地下水样品中三氯乙烯的质量浓度为
时,水样中的三氯乙烯基本完全去除。某地下水样品中三氯乙烯的质量浓度为 ,计算每处理
,计算每处理 该地下水,需
该地下水,需
您最近半年使用:0次
名校
解题方法
5 . 短周期元素 X、Y、Z、W 的原子序数依次增加。Y 的简单氢化物常温下呈液态,X 的简单氢化物溶于水,溶液显碱性,Z 是短周期中还原性最强的元素,W 元素的最高价氧 化物的对应水化物是短周期中酸性最强的无机含氧酸。下列说法正确的是
| A.原子半径:W<Z<Y |
| B.X 形成的含氧酸一定是强酸 |
| C.Z 的单质与 CuSO4 溶液反应,可置换出 Cu |
| D.W 元素可形成具有消毒作用的化合物 |
您最近半年使用:0次
2020-12-21更新
|
226次组卷
|
2卷引用:山西省运城市夏县第二中学2021届高三上学期11月联考化学试题
名校
6 . 2019年是元素周期表诞生150周年,元素周期表在学习、研究和生产实践中有很重要的作用。已知 、
、 、
、 、
、 是中学常见的四种元素.原子序数依次增大。
是中学常见的四种元素.原子序数依次增大。 的原子最外层电子数是次外层的2倍。
的原子最外层电子数是次外层的2倍。 的氧化物属于两性氧化物,
的氧化物属于两性氧化物, 、
、 位于同周期,
位于同周期, 、
、 、
、 的原子最外层电子数之和为14,
的原子最外层电子数之和为14, 是人体必需的微量元素,缺乏
是人体必需的微量元素,缺乏 会导致贫血症状。
会导致贫血症状。
(1)硒是人体必需的微量元素。人体内产生的活性氧能加速人体衰老,被称为“生命杀手”。化学家尝试用 及其他富硒物质清除人体内的活性氧,此时
及其他富硒物质清除人体内的活性氧,此时 表现出
表现出_______ 性。
(2)下列事实能用元素周期律解释的是_______ (填序号)。
a. 的最高价氧化物对应水化物的碱性弱于
的最高价氧化物对应水化物的碱性弱于
b. 的气态氢化物的稳定性小于
的气态氢化物的稳定性小于
c.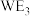 的溶液可用于刻蚀铜制的印刷电路板
的溶液可用于刻蚀铜制的印刷电路板
(3) 的单质可用于处理酸性废水中的
的单质可用于处理酸性废水中的 ,使其转换为
,使其转换为 ,同时生成有磁性的
,同时生成有磁性的 的氧化物
的氧化物 ,再进行后续处理。
,再进行后续处理。
①上述反应的离子方程式为_______ 。
② 的单质与
的单质与 在高温下反应的化学方程式为
在高温下反应的化学方程式为_______ 。
(4)铅和 元素同主族,可发生反应
元素同主族,可发生反应 。请写出草酸的电子式:
。请写出草酸的电子式:_______ 。 与
与 性质相似,
性质相似, 与氢氧化钠溶液反应的离子方程式是
与氢氧化钠溶液反应的离子方程式是_______ 。
(5)金属镓有“电子工业脊梁”的美誉,它与 同主族,其氧化物和氢氧化物均为两性化合物。工业上通常用电解精炼法提纯镓。某待提纯的粗镓内含
同主族,其氧化物和氢氧化物均为两性化合物。工业上通常用电解精炼法提纯镓。某待提纯的粗镓内含 、
、 、
、 杂质,以
杂质,以 水溶液为电解质溶液。在电流作用下使粗镓溶解进入电解质溶液,通过某种离子迁移技术到达阴极,并在阴极放电析出高纯镓。(离子氧化性顺序为:
水溶液为电解质溶液。在电流作用下使粗镓溶解进入电解质溶液,通过某种离子迁移技术到达阴极,并在阴极放电析出高纯镓。(离子氧化性顺序为: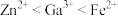 )下列有关电解精炼镓的说法正确的是_______(填序号)。
)下列有关电解精炼镓的说法正确的是_______(填序号)。
 、
、 、
、 、
、 是中学常见的四种元素.原子序数依次增大。
是中学常见的四种元素.原子序数依次增大。 的原子最外层电子数是次外层的2倍。
的原子最外层电子数是次外层的2倍。 的氧化物属于两性氧化物,
的氧化物属于两性氧化物, 、
、 位于同周期,
位于同周期, 、
、 、
、 的原子最外层电子数之和为14,
的原子最外层电子数之和为14, 是人体必需的微量元素,缺乏
是人体必需的微量元素,缺乏 会导致贫血症状。
会导致贫血症状。(1)硒是人体必需的微量元素。人体内产生的活性氧能加速人体衰老,被称为“生命杀手”。化学家尝试用
 及其他富硒物质清除人体内的活性氧,此时
及其他富硒物质清除人体内的活性氧,此时 表现出
表现出(2)下列事实能用元素周期律解释的是
a.
 的最高价氧化物对应水化物的碱性弱于
的最高价氧化物对应水化物的碱性弱于
b.
 的气态氢化物的稳定性小于
的气态氢化物的稳定性小于
c.
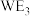 的溶液可用于刻蚀铜制的印刷电路板
的溶液可用于刻蚀铜制的印刷电路板(3)
 的单质可用于处理酸性废水中的
的单质可用于处理酸性废水中的 ,使其转换为
,使其转换为 ,同时生成有磁性的
,同时生成有磁性的 的氧化物
的氧化物 ,再进行后续处理。
,再进行后续处理。①上述反应的离子方程式为
②
 的单质与
的单质与 在高温下反应的化学方程式为
在高温下反应的化学方程式为(4)铅和
 元素同主族,可发生反应
元素同主族,可发生反应 。请写出草酸的电子式:
。请写出草酸的电子式: 与
与 性质相似,
性质相似, 与氢氧化钠溶液反应的离子方程式是
与氢氧化钠溶液反应的离子方程式是(5)金属镓有“电子工业脊梁”的美誉,它与
 同主族,其氧化物和氢氧化物均为两性化合物。工业上通常用电解精炼法提纯镓。某待提纯的粗镓内含
同主族,其氧化物和氢氧化物均为两性化合物。工业上通常用电解精炼法提纯镓。某待提纯的粗镓内含 、
、 、
、 杂质,以
杂质,以 水溶液为电解质溶液。在电流作用下使粗镓溶解进入电解质溶液,通过某种离子迁移技术到达阴极,并在阴极放电析出高纯镓。(离子氧化性顺序为:
水溶液为电解质溶液。在电流作用下使粗镓溶解进入电解质溶液,通过某种离子迁移技术到达阴极,并在阴极放电析出高纯镓。(离子氧化性顺序为: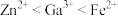 )下列有关电解精炼镓的说法正确的是_______(填序号)。
)下列有关电解精炼镓的说法正确的是_______(填序号)。A.阳极发生氧化反应,其主要电极反应式: |
| B.电解过程中,阳极质量的减少与阴极质量的增加相等 |
C.在阴极除了析出高纯度的镓之外,还可能有 产生 产生 |
D.电解后,电解槽底部的阳极泥中只有 和 和 |
您最近半年使用:0次
名校
解题方法
7 . 共价化合物分子中各原子有一定的连接方式,某分子可用球棍模型表示如图,A的原子半径最小,C、D位于同周期,D的常见单质常温下为气态,下列说法正确的是( )
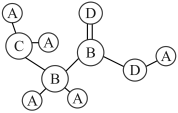

| A.B的同素异形体数目最多2种 |
| B.A与C不可以形成离子化合物 |
| C.通过含氧酸酸性可以比较元素B和C的非金属性 |
| D.C与D形成的阴离子CD2-既有氧化性,又有还原性 |
您最近半年使用:0次
2020-03-25更新
|
346次组卷
|
5卷引用:河北省邯郸市2020年高三空中课堂备考检测理综化学试题
10-11高三·西藏拉萨·阶段练习
名校
8 . 原子序数依次增大的四种常见元素W、X、Y、Z,均可形成一种或多种氧化物。其中W、Y的氧化物是导致酸雨的主要物质,X的氧化物既可以和强酸、亦可以和强碱反应,Z则具有砖红色和黑色的两种氧化物。
(1)W元素在元素周期表的位置为____________ ,用电子式表示其气态氢化物________ 。
(2)含有X的某种物质常用作净水剂,用离子方程式表示其净水的原理是_____________ 。
(3)Y的一种氧化物,属于酸性氧化物,它既具有氧化性,也具有还原性,还具有漂白性。设计实验,验证该氧化物具有还原性,其操作方法是______________ 。
(4)一定物质的量的稀硝酸恰能将Z的砖红色的氧化物氧化,自身被还原成NO。则反应中氧化剂与还原剂的物质的量的比为____________ 。
(1)W元素在元素周期表的位置为
(2)含有X的某种物质常用作净水剂,用离子方程式表示其净水的原理是
(3)Y的一种氧化物,属于酸性氧化物,它既具有氧化性,也具有还原性,还具有漂白性。设计实验,验证该氧化物具有还原性,其操作方法是
(4)一定物质的量的稀硝酸恰能将Z的砖红色的氧化物氧化,自身被还原成NO。则反应中氧化剂与还原剂的物质的量的比为
您最近半年使用:0次
9 . A、B、C、D、E为原子序数递增的短周期元素,在周期表中A是原子半径最小的元素,B、C左右相邻,C、D同主族,D和E的气态氢化物具有相同的电子数,C的单质只有氧化性。
(1)写出实验室制取E2反应的离子方程式_______________________________ ;
(2)A、C元素按原子个数比为1:1形成化合物的电子式_________________ ;
(3)某小组设计如图所示的装置(图中夹持和加热装置略去),分别研究DC2和E2的性质.
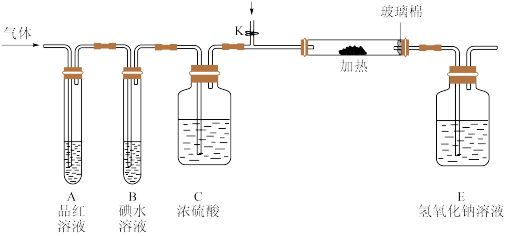
①分别通入DC2和E2,在装置A中观察到的现象是否相同(填“相同”或“不相同”)________ ;若装置D中装的是铁粉,当通入E2时D中观察到的现象为____________ ;若装置D中装的是五氧化二钒,当通入DC2时,打开K通入适量C2,化学反应方程式为________________________________ 。
②若装置B中装有5.0mL l.0×10-3mol/L的碘水,当通入足量E2完全反应后,转 移了5.0×10-5mol电子,则该反应的化学方程式为_______________________________ 。
(4)某同学将足量的DC2通入一支装有氯化钡溶液的试管,未见沉淀生成,向该试管中加入过量(填字母)_________ ,可以看到白色沉淀生成;
A、氨水 B、稀盐酸 C、稀硝酸 D、氯化钙
(5)若由元素D和C组成一2价酸根Z,Z中D和C的质量比为D:C=4:3,当E2与含Z的溶液完全反应后,有浅黄色沉淀产生,取上层清液加入氯化铡溶液,有白色沉淀产生.与出E2与Z的溶液完全反应产生浅黄色沉淀的离子方程式______________________________ 。
(6)A、B、C三种元素组成的碱性物质N,A、B、C、D和一种常见金属元素组成相对分子质量为392的化合物M,1molM中含有6mol结晶水,对化合物M进行如下实验:
a.取含有0.1molM的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和4.48L(标况)无色刺激性气味气体,经一段时间白色沉淀变为灰绿色,最终变为红褪色;
b.另以含有0.1molM的溶液,加入过量BaCl2溶液产生46.6g白色沉淀,加盐酸沉淀不溶解。
①M的化学式为____________________________ 。
②在25℃下,测定浓度均为amol/L的化合物N和M的混合溶液pH=7,且含金属离子的浓度为bmol/L,则溶液里除H+、金属阳离子外的阳离子浓度为__________ mol/L。
(1)写出实验室制取E2反应的离子方程式
(2)A、C元素按原子个数比为1:1形成化合物的电子式
(3)某小组设计如图所示的装置(图中夹持和加热装置略去),分别研究DC2和E2的性质.

①分别通入DC2和E2,在装置A中观察到的现象是否相同(填“相同”或“不相同”)
②若装置B中装有5.0mL l.0×10-3mol/L的碘水,当通入足量E2完全反应后,转 移了5.0×10-5mol电子,则该反应的化学方程式为
(4)某同学将足量的DC2通入一支装有氯化钡溶液的试管,未见沉淀生成,向该试管中加入过量(填字母)
A、氨水 B、稀盐酸 C、稀硝酸 D、氯化钙
(5)若由元素D和C组成一2价酸根Z,Z中D和C的质量比为D:C=4:3,当E2与含Z的溶液完全反应后,有浅黄色沉淀产生,取上层清液加入氯化铡溶液,有白色沉淀产生.与出E2与Z的溶液完全反应产生浅黄色沉淀的离子方程式
(6)A、B、C三种元素组成的碱性物质N,A、B、C、D和一种常见金属元素组成相对分子质量为392的化合物M,1molM中含有6mol结晶水,对化合物M进行如下实验:
a.取含有0.1molM的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和4.48L(标况)无色刺激性气味气体,经一段时间白色沉淀变为灰绿色,最终变为红褪色;
b.另以含有0.1molM的溶液,加入过量BaCl2溶液产生46.6g白色沉淀,加盐酸沉淀不溶解。
①M的化学式为
②在25℃下,测定浓度均为amol/L的化合物N和M的混合溶液pH=7,且含金属离子的浓度为bmol/L,则溶液里除H+、金属阳离子外的阳离子浓度为
您最近半年使用:0次
名校
10 . 下图所示的两种化合物可应用于阻燃材料和生物材料的合成。其中W、X、Y、Z为原子序数依次增大的短周期元素,X和Z同主族,Y原子序数为W原子价电子数的3倍。请回答下列问题:
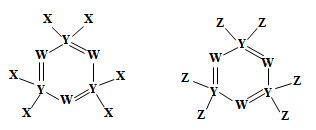
(1)元素Y在周期表中的位置为___________ ,元素Z的最高价氧化物的水化物的化学式为_____ 。
(2)元素W、X、Y、Z的简单阴离子半径由大到小的顺序为_____ 。
(3)Z、W和氢三种元素形成的同时含有离子键和共价键化合物的电子式为_____ 。
(4)研究Y、Z非金属性强弱的方案中不可行的是___________(填序号)。
(5)许多含元素Z的化合物均可作为杀菌消毒剂,将ZO2通入到NaOH和H2O2混合溶液中,可制备NaZO2。
查阅资料:NaZO2晶体易溶于水,难溶于乙醇。NaZO2饱和溶液在温度低于38 ℃时析出NaZO2·3H2O晶体,高于38 ℃时析出NaZO2晶体,高于60 ℃时NaZO2分解成NaZO3和NaZ。
①写出由ZO2制备NaZO2的离子方程式_____ 。
②从上述NaZO2溶液获得干燥的NaZO2晶体的操作步骤为:将溶液在减压和55 ℃条件下蒸发至大量晶体析出后,___________ ,___________ ,低于60℃干燥,得到NaZO2晶体 (补全实验步骤)。

(1)元素Y在周期表中的位置为
(2)元素W、X、Y、Z的简单阴离子半径由大到小的顺序为
(3)Z、W和氢三种元素形成的同时含有离子键和共价键化合物的电子式为
(4)研究Y、Z非金属性强弱的方案中不可行的是___________(填序号)。
| A.比较其简单氢化物的沸点 | B.比较其单质与氢气反应的难易程度 |
| C.比较其简单阴离子的还原性 | D.比较其氧化物的水化物的酸性 |
查阅资料:NaZO2晶体易溶于水,难溶于乙醇。NaZO2饱和溶液在温度低于38 ℃时析出NaZO2·3H2O晶体,高于38 ℃时析出NaZO2晶体,高于60 ℃时NaZO2分解成NaZO3和NaZ。
①写出由ZO2制备NaZO2的离子方程式
②从上述NaZO2溶液获得干燥的NaZO2晶体的操作步骤为:将溶液在减压和55 ℃条件下蒸发至大量晶体析出后,
您最近半年使用:0次



