1 . 一种由短周期主族元素组成的化合物(如图所示),具有良好的储氢性能,其中元素W、X、Y、Z的原子序数依次增大,且原子序数总和为24,X原子的价电子数为3。下列有关叙述不正确 的是
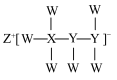
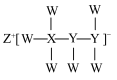
| A.该化合物中,W、X、Y之间均为共价键 |
| B.Z的单质既能与水反应,也可与甲醇反应 |
| C.Y的最高化合价氧化物的水化物为强酸 |
D.X的氟化物 中原子均为8电子稳定结构 中原子均为8电子稳定结构 |
您最近一年使用:0次
2 . 某元素原子最外层只有1个电子,它跟卤素相结合时,所形成的化学键
| A.一定是共价键 | B.一定是离子键 |
| C.可能是共价键,也可能是离子键 | D.以上说法均不正确 |
您最近一年使用:0次
解题方法
3 . 随着原子序数的递增,a~g七种短周期元素的最高正价或最低负价与原子序数的关系如图所示。下列说法中正确的是


| A.在a、b、f、g四种元素中,非金属性最强的元素位于第三周期第IVA族 |
B.a、b、f三种元素的原子半径: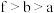 |
| C.元素e的最高价氧化物对应的水化物能与氢氧化钠溶液反应 |
| D.元素c与d只能形成一种化合物 |
您最近一年使用:0次
4 . 通常情况下,微粒 A、B 为分子,C、E 为阳离子,D为阴离子,它们都含有10个电子;B 溶于 A 后所得的物质可电离出 C、D;A、B、E 三种微粒反应后可得 C 和一种白色沉淀。请回答:
(1)用化学符号表示下列 4 种微粒:A.__ 、B. __ 、C. __ 、D. __ 。
(2)写出A、B、E 三种微粒反应的离子方程式:__
(3)某元素原子的最外层电子数为次外层电子层数的 3 倍。该元素原子的简单离子的结构示意图为_______ 。该元素在化学反应容易_______ 电子,具有_______ 性。
(1)用化学符号表示下列 4 种微粒:A.
(2)写出A、B、E 三种微粒反应的离子方程式:
(3)某元素原子的最外层电子数为次外层电子层数的 3 倍。该元素原子的简单离子的结构示意图为
您最近一年使用:0次
解题方法
5 . A、B、C、D、E五种元素,它们的核电荷数依次增大,且都小于20,其中A为非金属元素,C是金属元素;A、C元素原子的最外层都只有一个电子;B和D元素原子的最外层电子数相同,且B元素原子L层电子数是K层电子数的3倍,E元素原子最外层电子数比次外层电子数少1。
回答下列问题:
(1)写出五种元素的元素符号:
A_______ ,B_______ ,C_______ ,D_______ ,E_______ 。
(2)画出B、C的原子结构示意图:B_______ ,C_______ 。画出D的简单离子结构示意图:_______ 。
(3)从原子核外电子排布的角度分析C元素的化合价为什么为+1价?_____________ 。
回答下列问题:
(1)写出五种元素的元素符号:
A
(2)画出B、C的原子结构示意图:B
(3)从原子核外电子排布的角度分析C元素的化合价为什么为+1价?
您最近一年使用:0次
解题方法
6 . 如图是部分1~18号元素化合价与原子序数的关系图,下列说法正确的是


| A.原子半径:Z>Y>X |
| B.离子半径:X>Y>Z |
| C.元素R的最高化合价和最低化合价的代数和为6 |
| D.Y和W的最高价氧化物对应的水化物不能相互反应 |
您最近一年使用:0次
解题方法
7 . 某元素R原子最外层电子数是它的电子总数的 ,该元素的氧化物可能是
,该元素的氧化物可能是
 ,该元素的氧化物可能是
,该元素的氧化物可能是| A.R2O | B.R2O5 | C.RO2 | D.RO3 |
您最近一年使用:0次
名校
8 . 下表列出了9种元素在元素周期表(元素周期表中给出部分)中的位置。
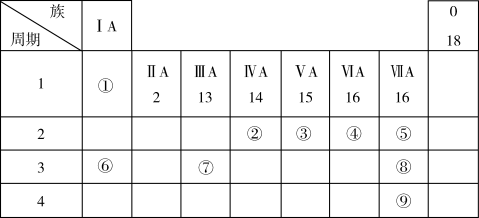
请回答下列问题:
(1)考古工作者利用某元素的一种核素测定一些文物的年代,这种核素的符号是_______ 。
(2)画出元素⑧形成的简单离子的结构示意图:_______ 。
(3)元素⑥的最高价氧化物对应的水化物与元素⑦的最高价氧化物对应的水化物反应的离子方程式为_______ 。
(4)③、④、⑤二种元素的简单气态氢化物,稳定性顺序是_______ (填化学式,用“>”连接)。
(5)元素③的氢化物与氯化氢形成的盐中的化学键类型为_______ (填“极性共价键”“离子键”或“非极性共价键”)。
(6)表中的ⅠA族、ⅡA族元素全部是金属元素,这种判断_______ (填“正确”或者“错误”);根据元素周期律,自然界中最强的碱是_______ (填“化学式”);元素④与元素①形成的原子个数比为1:2的化合物沸点高的原因是_______ 。
(7)通常所说的“芯片”是指集成电路,它是微电子技术的主要产品,制造芯片的核心元素在周期表中的位置是_______ 。

请回答下列问题:
(1)考古工作者利用某元素的一种核素测定一些文物的年代,这种核素的符号是
(2)画出元素⑧形成的简单离子的结构示意图:
(3)元素⑥的最高价氧化物对应的水化物与元素⑦的最高价氧化物对应的水化物反应的离子方程式为
(4)③、④、⑤二种元素的简单气态氢化物,稳定性顺序是
(5)元素③的氢化物与氯化氢形成的盐中的化学键类型为
(6)表中的ⅠA族、ⅡA族元素全部是金属元素,这种判断
(7)通常所说的“芯片”是指集成电路,它是微电子技术的主要产品,制造芯片的核心元素在周期表中的位置是
您最近一年使用:0次
2022-12-12更新
|
206次组卷
|
2卷引用:福建省莆田第二十四中学2021-2022学年高一下学期开学摸底考试化学(1卷)试题
名校
9 . 金属元素钫(Fr)在自然界中含量极少。它的21个已知同位素都有放射性。它是碱金属元素中最重的元素。根据它在周期表中的位置预言其性质,其中不正确的是
| A.在已知碱金属元素中具有最大的原子半径 |
| B.在空气中燃烧时生成氧化物Fr2O |
| C.氧化物对应的水化物是极强的碱 |
| D.其单质的熔点比金属钠的熔点低 |
您最近一年使用:0次
2022-11-04更新
|
130次组卷
|
2卷引用:河南省南召现代中学2021-2022学年高一下学期开学检测化学试题
名校
10 . 如图是部分1~18号元素化合价与原子序数的关系图,下列说法正确的是

| A.原子半径:Z>Y>X |
| B.离子半径:Z>Y>X |
| C.元素W的最高价和最低价代数和为4 |
| D.Y和Z两者最高价氧化物对应的水化物不能相互反应 |
您最近一年使用:0次
2022-11-04更新
|
684次组卷
|
7卷引用:河南省南召现代中学2021-2022学年高一下学期开学检测化学试题



