9-10高一下·黑龙江·期中
1 . 短周期元素A、B、C、D、E原子序数依次递增,A原子最外层电子数是次外层电子数的2倍,B的单质为双原子分子,其氢化物能使湿润的红色石蕊试纸变蓝,C在同周期元素中原子半径最大,D的最外层电子数等于电子层数,E的最高正价是+7价。
(1)写出E元素在周期表中的位置___________________ 。
(2)写出A元素气态氢化物的结构式_____________________ 。
(3)B的氢化物和E的氢化物反应所得生成物的电子式为________ 。
(4)D单质和C的最高价氧化物对应的水化物的溶液反应的离子方程式为___________ 。
(5)A单质与B的最高价氧化物对应的水化物的浓溶液反应的化学方程式为____ 。
(1)写出E元素在周期表中的位置
(2)写出A元素气态氢化物的结构式
(3)B的氢化物和E的氢化物反应所得生成物的电子式为
(4)D单质和C的最高价氧化物对应的水化物的溶液反应的离子方程式为
(5)A单质与B的最高价氧化物对应的水化物的浓溶液反应的化学方程式为
您最近一年使用:0次
名校
解题方法
2 . 有A、B、C、D、E、F、G7种元素,试按下述所给的条件推断:
①A、B、C是同一周期的金属元素,已知原子核外均有3个电子层,A的原子半径在所属周期中最大且原子半径A>B>C;
②D、E是非金属元素,它们跟氢化合可生成气态氢化物HD和HE,在室温时,D的单质是液体,E的单质是固体;
③F的单质在常温下是气体,性质很稳定,是除氢外最轻的气体;
④G是除氢外原子半径最小的主族元素
(1)A的名称是____ ,B位于周期表中第____ 周期____ 族,C的原子结构示意图是________________ 。
(2)E的单质颜色是_______ 。
(3)A元素与D元素形成的化合物的电子式是_________ 。
(4)G的单质与水反应的化学方程式是________ 。
(5)F的元素符号是__________ 。
(6)在上述七种元素中,最高价氧化物对应的水化物碱性最强的是_____ (填化学式,下同),酸性最强的是_______ ,气态氢化物最稳定的是__________ 。
(7)将C的氧化物对应的水化物投入到A的氧化物对应的水化物中反应的离子方程式是_______________ 。
①A、B、C是同一周期的金属元素,已知原子核外均有3个电子层,A的原子半径在所属周期中最大且原子半径A>B>C;
②D、E是非金属元素,它们跟氢化合可生成气态氢化物HD和HE,在室温时,D的单质是液体,E的单质是固体;
③F的单质在常温下是气体,性质很稳定,是除氢外最轻的气体;
④G是除氢外原子半径最小的主族元素
(1)A的名称是
(2)E的单质颜色是
(3)A元素与D元素形成的化合物的电子式是
(4)G的单质与水反应的化学方程式是
(5)F的元素符号是
(6)在上述七种元素中,最高价氧化物对应的水化物碱性最强的是
(7)将C的氧化物对应的水化物投入到A的氧化物对应的水化物中反应的离子方程式是
您最近一年使用:0次
2017-04-25更新
|
1866次组卷
|
4卷引用:黑龙江省牡丹江市第一高级中学2017-2018学年高二4月月考化学试题
解题方法
3 . 有A、B、C、D、E5种短周期元素,A与B可形成BA型化合物,A元素的单质常用于自来水消毒;金属B的原子核内质子数比它前一周期同主族元素原子的质子数多8;C元素有3种同位素C1、C2、C3,自然界里含量最多的是C1,C3原子的质量数是C1的3倍,C2原子的质量数是C1的2倍;D的气态氢化物的水溶液呈碱性,而其最高价氧化物对应的水化物为强酸;E元素原子的最外层电子数比次外层电子数多4。
(1)写出下列元素的元素名称:A_________ ,B_________ 。
(2)写出C1、C3两种原子的符号:C1____________ ,C3___________ 。
(3)A、B、E形成的一种化合物是某种家用消毒液的有效成分,其电子式是___________ 。
(4)D的最高价氧化物的水化物与其氢化物反应形成化合物的化学式是___________ ,其所含化学键的类型是____________ ,由最常见的E原子与C2原子形成的最简单分子0.5mol中,所含中子的数目是___________ 。
(5)C、E的单质在碱性(KOH溶液)条件下可设计成一种燃料电池,其正极的电极反应式为_________ 。
(1)写出下列元素的元素名称:A
(2)写出C1、C3两种原子的符号:C1
(3)A、B、E形成的一种化合物是某种家用消毒液的有效成分,其电子式是
(4)D的最高价氧化物的水化物与其氢化物反应形成化合物的化学式是
(5)C、E的单质在碱性(KOH溶液)条件下可设计成一种燃料电池,其正极的电极反应式为
您最近一年使用:0次
10-11高二下·黑龙江·期中
4 . A、B、C、D四种短周期元素,0.5molA的元素的离子得到NA个电子后被还原为中性原子;0.4gA的氧化物恰好与100mL0.2mol/L的盐酸完全反应;A元素原子核内质子数与中子数相等。B元素原子核外电子数比A元素原子核外电子数多1;Cˉ离子核外电子层数比A元素的离子核外电子层数多1;D元素原子最外层电子数是次外层电子数的2倍。请填写下列空格:
(1)推断A、B、C、D四种元素的符号A______ ;B______ ;C______ ;D______ ;
(2)D元素的最高价氧化物的电子式是______ 结构式______ 该分子内含有______ 键(填极性或非极性)。
(1)推断A、B、C、D四种元素的符号A
(2)D元素的最高价氧化物的电子式是
您最近一年使用:0次
5 . 已知X、Y和Z三种元素的原子序数之和等于48。X的一种1∶1型氢化物分子中既有σ键又有π键。Z是金属元素,Z的单质和化合物有广泛的用途。已知Z的核电荷数小于28,且次外层有2个未成对电子。工业上利用ZO2和碳酸钡在熔融状态下制取化合物M(M可看做一种含氧酸盐)。M有显著的“压电性能”,应用于超声波的发生装置。经X射线分析,M晶体的最小重复单元为正方体(如图),边长为4.03×10-10 m,顶点位置为Z4+所占,体心位置为Ba2+所占,所有棱心位置为O2-所占。
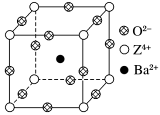
(1) Y在周期表中位于______________ ;Z4+的核外电子排布式为___________________ 。
(2)X的该种氢化物分子构型为________ ,X在该氢化物中以_______ 方式杂化。X和Y形成的化合物的熔点应该_______ (填“高于”或“低于”)X的氢化物的熔点。
(3)①制备M的化学方程式是_____________ 。
②在M晶体中,若将Z4+置于正方体的体心,Ba2+置于正方体的顶点,则O2-处于正方体的________ 。
③在M晶体中,Z4+的氧配位数为________ 。
④已知O2-半径为1.40×10-10 m,则Z4+半径为____ m。

(1) Y在周期表中位于
(2)X的该种氢化物分子构型为
(3)①制备M的化学方程式是
②在M晶体中,若将Z4+置于正方体的体心,Ba2+置于正方体的顶点,则O2-处于正方体的
③在M晶体中,Z4+的氧配位数为
④已知O2-半径为1.40×10-10 m,则Z4+半径为
您最近一年使用:0次
2016-12-09更新
|
1124次组卷
|
5卷引用:黑龙江省齐齐哈尔市第八中学2017-2018学年高二6月月考化学试题
黑龙江省齐齐哈尔市第八中学2017-2018学年高二6月月考化学试题新疆奎屯市第一高级中学2018-2019学年高二下学期第一次月考化学试题(已下线)2011届江西省重点中学协作体高三第二次联考(理综)化学部分苏教版2017届高三单元精练检测十一化学试题山东省章丘市第四中学2019届高三上学期第二次质量检测理综化学试题
解题方法
6 . A、B、C为短周期元素,在周期表中所处的位置如图所示。A、C两元素的原子核外电子数之和等于B原子的质子数。B原子核内质子数和中子数相等。
(1)写出A、B、C三元素名称:________ 、________ 、________ 。
(2)C在元素周期表中的位置是__________________________________ 。
(3)B的原子结构示意图为________ ,C的氢化物与B的氢化物的稳定性强弱顺序为________ >________ (填化学式)。
(4)比较A、C的原子半径:A________ (填“>”或“<”)C,写出A的气态氢化物与A的最高价氧化物对应水化物反应的化学方程式:________________________________________________ 。
| A | C | |
| B |
(2)C在元素周期表中的位置是
(3)B的原子结构示意图为
(4)比较A、C的原子半径:A
您最近一年使用:0次
2012-10-28更新
|
1335次组卷
|
9卷引用:黑龙江省青冈县一中2018-2019学年高二上学期开学考试化学试题
黑龙江省青冈县一中2018-2019学年高二上学期开学考试化学试题步步为赢 高二化学暑假作业:作业六 物质结构 元素周期律(已下线)2012年人教版高中化学必修二 1.2 元素周期律练习卷(已下线)2014学年高一化学人教版必修2 1.2.1电子的排布元素周期律练习卷云南省河口县民中2017-2018学年高一下学期期中考试化学试题云南省华宁县第二中学2018-2019学年高一下学期开学考试化学试题甘肃省武威市第五中学2018-2019学年高一下学期第一次月考化学试题安徽省合肥市2019—2020学年高一下学期期中考试化学试题山东省东平明湖中学2022-2023学年高一下学期学情调研化学试题



