名校
1 . 元素周期表和元素周期律是我们高中化学中的重要理论知识,试回答下列问题:
(1)X元素原子的核电荷数为8,其原子核内的质子数为_____ ,该元素原子的二价阴离子中,核外电子数为_____ ,离子结构示意图为______ ,中子数为9的核素表示为______ 。
(2)向 溶液中通入氯气出现黄色浑浊,可证明非金属性:Cl
溶液中通入氯气出现黄色浑浊,可证明非金属性:Cl_____ S(填“>”或“<”),反应的离子方程式为___________ 。
(3)最近,德国科学家实现了铷原子气体超流体态与绝缘态的可逆转换,该成果将在量子计算机研究方面带来重大突破。已知铷是37号元素,相对原子质量是85。
①铷在元素周期表中的位置是___________ 。
②下列关于铷的说法不正确的是___________ (填序号)。
a.与水反应比钠更剧烈 b.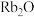 在空气中易吸收水和二氧化碳
在空气中易吸收水和二氧化碳
c.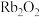 与水能剧烈反应并释放出
与水能剧烈反应并释放出 d.单质具有很强的氧化性
d.单质具有很强的氧化性
e.RbOH的碱性比同浓度的NaOH弱
(4)关于元素周期表、周期律,下列说法正确的是___________(填序号)。
(1)X元素原子的核电荷数为8,其原子核内的质子数为
(2)向
 溶液中通入氯气出现黄色浑浊,可证明非金属性:Cl
溶液中通入氯气出现黄色浑浊,可证明非金属性:Cl(3)最近,德国科学家实现了铷原子气体超流体态与绝缘态的可逆转换,该成果将在量子计算机研究方面带来重大突破。已知铷是37号元素,相对原子质量是85。
①铷在元素周期表中的位置是
②下列关于铷的说法不正确的是
a.与水反应比钠更剧烈 b.
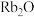 在空气中易吸收水和二氧化碳
在空气中易吸收水和二氧化碳c.
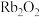 与水能剧烈反应并释放出
与水能剧烈反应并释放出 d.单质具有很强的氧化性
d.单质具有很强的氧化性e.RbOH的碱性比同浓度的NaOH弱
(4)关于元素周期表、周期律,下列说法正确的是___________(填序号)。
| A.在金属和非金属分界处可以找到半导体材料 |
| B.在过渡元素中寻找制造催化剂和耐高温、耐腐蚀合金的元素 |
| C.通常农药所含有的元素位于元素周期表左下方区域 |
| D.稀有气体原子都满足8电子稳定结构 |
您最近一年使用:0次
名校
2 . 五种短周期元素在元素周期表中的位置如图,已知Y原子最外层电子数是其电子层数的2倍,下列说法不正确 的是( )
| M | W | ||
| X | Y | Z |
| A.五种元素中原子半径最大的是X,离子半径最大的是Y单核离子 |
| B.X与M、X与Z形成的化合物晶体类型不同,但化学键类型相同 |
| C.工业上M单质可以制X单质,这个事实可证明非金属性M>X |
| D.五种元素均能与氢元素组成18电子分子 |
您最近一年使用:0次
2019-10-12更新
|
103次组卷
|
2卷引用:浙江省杭州市第二中学2020届高三上学期第一次月考化学试题
解题方法
3 . 有A、B、C、D、E五种短周期主族元素,原子序数由A到E逐渐增大。
①A元素最外层电子数是次外层电子数的2倍。
②B的阴离子和C的阳离子与氖原子的电子层结构相同。
③在通常状况下,B的单质是气体,0.1molB的气体与足量的氢气完全反应共有0.4mol电子转移。
④C的单质在点燃时与B的单质充分反应,生成淡黄色的固体。
⑤D的气态氢化物有臭鸡蛋气味。请写出:
(1)A元素的最高价氧化物的结构式_______
(2)C元素在周期表中的位置_______
(3)B单质与C单质在点燃时反应的生成物中所含化学键类型有_______
(4)D元素的低价氧化物与E的单质的水溶液反应的化学方程式为_______
(5)元素D与元素E相比,非金属性较弱的是_______ (用元素符号表示),下列表述中能证明这一事实的是_______ (填选项序号)。
a.常温下D的单质和E的单质状态不同
b.E的氢化物水溶液酸性比D的氢化物水溶液酸性强
c.一定条件下D和E的单质都能与钠反应
d.D的最高价含氧酸酸性弱于E的最高价含氧酸
e.D的单质能与E的氢化物反应生成E单质。
(6)C分别与B、E形成的简单化合物中,熔沸点较高的是_______
①A元素最外层电子数是次外层电子数的2倍。
②B的阴离子和C的阳离子与氖原子的电子层结构相同。
③在通常状况下,B的单质是气体,0.1molB的气体与足量的氢气完全反应共有0.4mol电子转移。
④C的单质在点燃时与B的单质充分反应,生成淡黄色的固体。
⑤D的气态氢化物有臭鸡蛋气味。请写出:
(1)A元素的最高价氧化物的结构式
(2)C元素在周期表中的位置
(3)B单质与C单质在点燃时反应的生成物中所含化学键类型有
(4)D元素的低价氧化物与E的单质的水溶液反应的化学方程式为
(5)元素D与元素E相比,非金属性较弱的是
a.常温下D的单质和E的单质状态不同
b.E的氢化物水溶液酸性比D的氢化物水溶液酸性强
c.一定条件下D和E的单质都能与钠反应
d.D的最高价含氧酸酸性弱于E的最高价含氧酸
e.D的单质能与E的氢化物反应生成E单质。
(6)C分别与B、E形成的简单化合物中,熔沸点较高的是
您最近一年使用:0次
名校
解题方法
4 . 现有七种短周期主族元素,其原子序数按A、B、C、D、E、F、G的顺序递增。A元素的最高正化合价和最低负化合价的代数和等于0,且A的氧化物能够造成温室效应;A、B、C三种元素都能形成10电子分子,且C与F位于同一主族;D与C可形成离子化合物DC;E的简单阳离子是同周期元素所形成的简单离子中半径最小的。回答下列问题:
(1)B位于周期表第______ 周期第______ 族。
(2)请写出B的氢化物可能的电子式_________ 、_________ 。
(3)元素M位于E与F元素之间,且M单质是优良的半导体材料,广泛用于太阳能电池。M、F、G的气态氢化物的稳定性由强到弱的顺序为__________ (用化学式表示)。
(4)A的单质与F的最高价氧化物的水化物浓溶液反应的化学方程式为:_________ 。
(5)A、M、F、G的最高价氧化物对应水化物的酸性由强到弱的顺序为__________ (用化学式表示)。
(6)下列实验方法能证明D与E的金属性强弱关系的是____ (填字母序号)。
A.比较D和E的单质分别与等浓度的稀硫酸反应产生气泡的快慢
B.比较D和E的单质分别与同浓度的氢氧化钠溶液反应产生气泡的快慢
C.比较D和E的单质分别与氯气、氧气、硫等非金属单质反应的产物的价态
D.比较D和E最高价氧化物的水化物的碱性强弱
(7)4 mol D 单质与含有10 mol B的最价氧化物的水化物溶液恰好完全,则含有B元素的还原产物可能是_______ 、_________ (写出化学式)。
(1)B位于周期表第
(2)请写出B的氢化物可能的电子式
(3)元素M位于E与F元素之间,且M单质是优良的半导体材料,广泛用于太阳能电池。M、F、G的气态氢化物的稳定性由强到弱的顺序为
(4)A的单质与F的最高价氧化物的水化物浓溶液反应的化学方程式为:
(5)A、M、F、G的最高价氧化物对应水化物的酸性由强到弱的顺序为
(6)下列实验方法能证明D与E的金属性强弱关系的是
A.比较D和E的单质分别与等浓度的稀硫酸反应产生气泡的快慢
B.比较D和E的单质分别与同浓度的氢氧化钠溶液反应产生气泡的快慢
C.比较D和E的单质分别与氯气、氧气、硫等非金属单质反应的产物的价态
D.比较D和E最高价氧化物的水化物的碱性强弱
(7)4 mol D 单质与含有10 mol B的最价氧化物的水化物溶液恰好完全,则含有B元素的还原产物可能是
您最近一年使用:0次
名校
5 . 下表是元素周期表的一部分,表中所列的数字分别代表某一种元素。
请完成下列空白。
(1)属于卤族元素的有_______ (填元素符号)。
(2)②在⑥的单质中燃烧产物的电子式为_______ ,其中所含化学键类型为_______ 。
(3)能证明元素⑧比⑨的非金属性强的实验事实有(用离子方程式表示):_______ 。
(4)元素⑥的一种中子数为10的核素的符号为_______
(5)元素⑤的单质与NaOH溶液反应的化学方程式为_______
| ⅠA | 0 | |||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ⑥ | |||||||
| 3 | ② | ④ | ⑤ | ⑦ | ⑧ | |||
| 4 | ③ | ⑨ | ||||||
请完成下列空白。
(1)属于卤族元素的有
(2)②在⑥的单质中燃烧产物的电子式为
(3)能证明元素⑧比⑨的非金属性强的实验事实有(用离子方程式表示):
(4)元素⑥的一种中子数为10的核素的符号为
(5)元素⑤的单质与NaOH溶液反应的化学方程式为
您最近一年使用:0次
解题方法
6 . X、Y、Z、W、M、R、Q是短周期主族元素,部分元素的原子半径和化合价信息如下表所示:
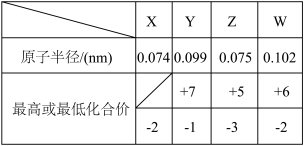
M的焰色反应为黄色:X、Y、R位于周期表中不同周期;Q的单质为半导体材料。
(1)Q元素在周期表中的位置是___ ;构成化合物M2X2的化学键类型是___ 。
(2)写出X、Y、R按原子个数之比为1:1:1形成的化合物的电子式___ 。
(3)Y与W相比,非金属性较强的是___ (用元素符号表示),下列事实能证明这一结论的是___ (选填字母序号)。
a.常温下W的单质呈固态,Y的单质呈气态
b.Y与W形成的化合物中W呈正价
c.Y和M反应时,lmolY原子所得电子数少于lmolW原子所得电子数
(4)R、W两种元素组成的离子在水溶液中与H+和OH-都不能大量共存,还能与氯水反应,写出其与新制氯水反应的离子方程式___ 。
(5)Z2R4为二元弱碱,在水中的电离与氨相似,写出其在水中的第一步电离方程式___ ,Z2R4与磷酸形成的磷酸二氢盐的化学式为___ 。

M的焰色反应为黄色:X、Y、R位于周期表中不同周期;Q的单质为半导体材料。
(1)Q元素在周期表中的位置是
(2)写出X、Y、R按原子个数之比为1:1:1形成的化合物的电子式
(3)Y与W相比,非金属性较强的是
a.常温下W的单质呈固态,Y的单质呈气态
b.Y与W形成的化合物中W呈正价
c.Y和M反应时,lmolY原子所得电子数少于lmolW原子所得电子数
(4)R、W两种元素组成的离子在水溶液中与H+和OH-都不能大量共存,还能与氯水反应,写出其与新制氯水反应的离子方程式
(5)Z2R4为二元弱碱,在水中的电离与氨相似,写出其在水中的第一步电离方程式
您最近一年使用:0次
7 . 下表为元素周期表的一部分:
请填写下列空白:
(1)表中元素,原子半径最大的是___ (填元素符号);①的核外电子排布式___ ,④的M层上有___ 种不同能级的电子。③和⑥两元素形成化合物的电子式为___ 。
(2)②③④三种元素最高价氧化物对应的水化物中,碱性最强的是___ (填化学式)。
(3)比较④、⑤两种元素的简单离子半径:___ (填离子符号);元素④最高价氧化物对应的水化物与硝酸反应的离子方程式为___ 。
(4)列举一个事实来证明元素①比元素⑤的非金属性强___ 。
(5)若8g甲烷气体完全燃烧生成液态水时放出445.15kJ的热量,请写出其热化学方程式___ 。
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | ||
| 二 | C | N | ① | |||||
| 三 | ② | ③ | ④ | P | ⑤ | ⑥ |
请填写下列空白:
(1)表中元素,原子半径最大的是
(2)②③④三种元素最高价氧化物对应的水化物中,碱性最强的是
(3)比较④、⑤两种元素的简单离子半径:
(4)列举一个事实来证明元素①比元素⑤的非金属性强
(5)若8g甲烷气体完全燃烧生成液态水时放出445.15kJ的热量,请写出其热化学方程式
您最近一年使用:0次
解题方法
8 . 下表中①~⑦表示元素周期表的部分元素。
(1)②元素最外层电子数比次外层电子数多______ 个,该元素的符号是_______ ;⑦元素的氢化物的电子式为____________________ 。
(2)由①③④三种元素组成的物质是______________ ,此物质的水溶液显_____ 性。
(3)⑥元素的原子半径大于③的理由是____________________________________ 。
(4)④元素的最高价氧化物对应的水化物的碱性强于⑤元素,用一个化学方程式来证明。________________________________________
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | |
| 1 | |||||||
| 2 | ① | ② | ③ | ||||
| 3 | ④ | ⑤ | ⑥ | ⑦ |
(1)②元素最外层电子数比次外层电子数多
(2)由①③④三种元素组成的物质是
(3)⑥元素的原子半径大于③的理由是
(4)④元素的最高价氧化物对应的水化物的碱性强于⑤元素,用一个化学方程式来证明。
您最近一年使用:0次
名校
9 . 短周期主族元素X、Y、Z、W、N的原子序数依次增大,X的原子在元素周期表中原子半径最小,Y的次外层电子数是其电子总数的1/4,离子化合物ZX2是一种储氢材料,W与Y属于同一主族,NY2是医学上常用的水消毒剂、漂白剂。下列叙述正确的是( )
| A.Y和W与X形成的简单化合物的热稳定性:X2Y>X2W |
| B.离子半径由大到小的顺序为Y2-< Z2+ < N-< W2- |
| C.ZX2和NY2中化学键一致,且微粒个数之比均为1∶2 |
| D.盐酸加入硫化钠中生成有臭鸡蛋气味的气体,可证明非金属性:N > W |
您最近一年使用:0次
2018-05-29更新
|
1158次组卷
|
9卷引用:【全国百强校】四川省绵阳中学2018届高三考前适应性考试(三)理科综合化学试题
【全国百强校】四川省绵阳中学2018届高三考前适应性考试(三)理科综合化学试题(已下线)2018年高考题及模拟题汇编 专题06 物质结构 元素周期律河北省邢台市第二中学2019届高三上学期第一次月考化学试题江西省上饶市第二中学2019届高三上学期12月月考理科综合化学试题贵州省毕节市梁才学校2020届高三上学期一诊模拟理综化学试题【全国百强校】江西省新余市第四中学2020届高三第七次训练理科综合化学试题山西省太原市山西大学附属中学2019-2020学年高一5月模块诊断化学试题湖北利川市第五中学2019-2020学年高一下学期期末考试化学试题福建省福州市八县(市、区)一中2021-2022学年高三上学期期中联考化学试题
名校
解题方法
10 . A、B、C、D、E、F、G为原子序数依次增大的短周期主族元素。B、C、D均能与A形成10电子分子,E单质可用于焊接钢轨,F与D同主族,F与G同周期。
(1)D、E、F 的离子半径由大到小的顺序为_________ (填离子符号)。
(2)写出能证明G比F非金属性强的一个离子方程式_____________ 。
(3)F和G的一种化合物甲中所有原子均为8电子稳定结构,该化合物与水反应生成F单质、F的最高价含氧酸和G的氢化物,三种产物的物质的量之比为2:1:6,甲的电子式为_______ ,该反应的化学方程式为___________________ 。
(4)C能分别与A和D按原子个数比1:2形成化合物乙和丙,乙的结构式为_______ 。常温下,液体乙与气体丙反应生成两种无污染的物质,若共生成1mol产物时放热QkJ,该反应的热化学方程式为_____________________ 。
(5)现取100mL 1mol/L的E的氯化物溶液,向其中加入1mol/L 氢氧化钠溶液产生了3.9g沉淀,则加入的氢氧化钠溶液体积可能为_________ mL。
(1)D、E、F 的离子半径由大到小的顺序为
(2)写出能证明G比F非金属性强的一个离子方程式
(3)F和G的一种化合物甲中所有原子均为8电子稳定结构,该化合物与水反应生成F单质、F的最高价含氧酸和G的氢化物,三种产物的物质的量之比为2:1:6,甲的电子式为
(4)C能分别与A和D按原子个数比1:2形成化合物乙和丙,乙的结构式为
(5)现取100mL 1mol/L的E的氯化物溶液,向其中加入1mol/L 氢氧化钠溶液产生了3.9g沉淀,则加入的氢氧化钠溶液体积可能为
您最近一年使用:0次



