1 .  是电解铝烟气的主要组分之一,属于强温室气体,其温室效应指数为
是电解铝烟气的主要组分之一,属于强温室气体,其温室效应指数为 的7390倍。我国科学家用
的7390倍。我国科学家用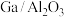 作为催化剂实现了
作为催化剂实现了 100%催化水解,其历程如下图所示。
100%催化水解,其历程如下图所示。
 是电解铝烟气的主要组分之一,属于强温室气体,其温室效应指数为
是电解铝烟气的主要组分之一,属于强温室气体,其温室效应指数为 的7390倍。我国科学家用
的7390倍。我国科学家用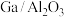 作为催化剂实现了
作为催化剂实现了 100%催化水解,其历程如下图所示。
100%催化水解,其历程如下图所示。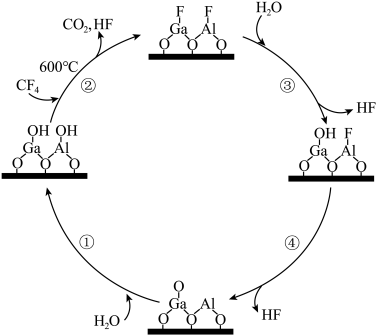
A.总反应为 |
B.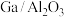 不能改变总反应的 不能改变总反应的 |
| C.反应过程中,Ga-F、C-F键既有断裂又有形成 |
| D.反应过程中涉及的小分子包含两种非极性分子 |
您最近一年使用:0次
2024-04-01更新
|
368次组卷
|
5卷引用:河南省周口市2024届高三二模理综-化学试题
河南省周口市2024届高三二模理综-化学试题河南省2024届高三下学期第二次质量检测(二模)理综-化学试卷(已下线)提升练03 反应历程探究与催化原理-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)2024届河南省许昌市禹州市高级中学高三下学期第三次专题考试理综试题-高中化学安徽省六安第一中学2024届高三下学期质量检测(二 )化学试题
2 . 二氧化碳转化甲醇技术是当前的研究热点,假设该过程仅发生如下3个反应:
反应I:CO2(g)+3H2(g) CH3OH(g)+H2O(g) K1△H1
CH3OH(g)+H2O(g) K1△H1
反应II:2CH3OH(g) CH3OCH3(g)+H2O(g) K2△H2
CH3OCH3(g)+H2O(g) K2△H2
反应III:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g) K3△H3
CH3OCH3(g)+3H2O(g) K3△H3
(1)上述反应的平衡常数K与温度T的关系都符合:lnK=A+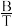 (A、B都为常数,且都大于零),则
(A、B都为常数,且都大于零),则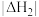
______ 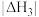 (填“>”、“<”或“=)。
(填“>”、“<”或“=)。
(2)在体积为1L的刚性容器中,仅发生反应I,投料比 =3,反应一段时间后,在无分子筛膜时甲醇的平衡产率和有分子筛膜(能选择性分离出H2O)时甲醇的产率随温度的变化如图所示。
=3,反应一段时间后,在无分子筛膜时甲醇的平衡产率和有分子筛膜(能选择性分离出H2O)时甲醇的产率随温度的变化如图所示。

①下列说法能作为反应I达到平衡状态的判据是______ (填字母)。
A.气体密度不再变化 B.CO2的体积分数不再变化
C.气体平均相对分子质量不再变化 D.CO2、H2的物质的量之比为1:3
②有分子筛时,P点之前甲醇的产率随温度升高而升高的原因是______ 。
③210℃下,反应达到平衡时,该容器中未通过膜的H2O分子占反应生成的H2O分子的百分比为_____ (用a表示)。
(3)CH3OH(g)在γ-Al2O3固体表面发生反应Ⅱ要经历:吸附→表面反应→脱附三个阶段,其机理如图所示。

①发生脱附的是历程______ (填数字)。
②已知历程5的化学方程式为:HO*+H*→H2O*(用*标注吸附的原子)。写出历程3的化学方程式:_____ 。
(4)甲醇可作为燃料电池的燃料。
①某甲醇燃料电池的部分结构如图所示,该电池的负极反应式为_____ 。

②已知氢气和甲醇的热值分别为143kJ/g和23kJ/g,与车载氢气供能模式相比,车载甲醇供能模式的优势是______ 。(已知燃料的能量密度单位为: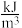 )
)
反应I:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) K1△H1
CH3OH(g)+H2O(g) K1△H1反应II:2CH3OH(g)
 CH3OCH3(g)+H2O(g) K2△H2
CH3OCH3(g)+H2O(g) K2△H2反应III:2CO2(g)+6H2(g)
 CH3OCH3(g)+3H2O(g) K3△H3
CH3OCH3(g)+3H2O(g) K3△H3(1)上述反应的平衡常数K与温度T的关系都符合:lnK=A+
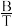 (A、B都为常数,且都大于零),则
(A、B都为常数,且都大于零),则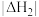
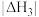 (填“>”、“<”或“=)。
(填“>”、“<”或“=)。(2)在体积为1L的刚性容器中,仅发生反应I,投料比
 =3,反应一段时间后,在无分子筛膜时甲醇的平衡产率和有分子筛膜(能选择性分离出H2O)时甲醇的产率随温度的变化如图所示。
=3,反应一段时间后,在无分子筛膜时甲醇的平衡产率和有分子筛膜(能选择性分离出H2O)时甲醇的产率随温度的变化如图所示。
①下列说法能作为反应I达到平衡状态的判据是
A.气体密度不再变化 B.CO2的体积分数不再变化
C.气体平均相对分子质量不再变化 D.CO2、H2的物质的量之比为1:3
②有分子筛时,P点之前甲醇的产率随温度升高而升高的原因是
③210℃下,反应达到平衡时,该容器中未通过膜的H2O分子占反应生成的H2O分子的百分比为
(3)CH3OH(g)在γ-Al2O3固体表面发生反应Ⅱ要经历:吸附→表面反应→脱附三个阶段,其机理如图所示。

①发生脱附的是历程
②已知历程5的化学方程式为:HO*+H*→H2O*(用*标注吸附的原子)。写出历程3的化学方程式:
(4)甲醇可作为燃料电池的燃料。
①某甲醇燃料电池的部分结构如图所示,该电池的负极反应式为

②已知氢气和甲醇的热值分别为143kJ/g和23kJ/g,与车载氢气供能模式相比,车载甲醇供能模式的优势是
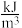 )
)
您最近一年使用:0次
3 . 由单键旋转而产生的异构体称为构象异构体,将正丁烷分子中的C2和C3旋转不同的角度可以得到正丁烷的构象势能关系图。下列说法正确的是


| A.正丁烷的构象异构体中所占比例最大的是iv |
| B.相同条件下,iii转化成i的速率比逆向转化的快 |
| C.构象异构体之间的转化存在化学键的断裂和生成 |
D.由i转化为iv的转化能垒为 |
您最近一年使用:0次
2023-05-12更新
|
825次组卷
|
4卷引用:山东省临沂市2023届高三二模考试化学试题
名校
解题方法
4 . 保罗·克拉兹等三位科学家因在氟利昂和臭氧层方面的工作获得诺贝尔化学奖,他们的研究揭示了大气中臭氧层被破坏的机理,如图所示。下列说法不正确的是
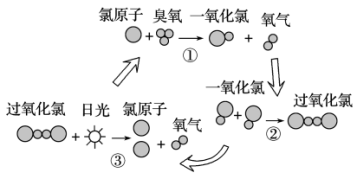

| A.氯原子在反应中作催化剂 |
| B.过程②中一氧化氯断键形成过氧化氯 |
| C.臭氧分子最终转变成氧气分子 |
| D.过氧化氯的结构式为O-Cl-Cl-O |
您最近一年使用:0次
2022-12-03更新
|
387次组卷
|
9卷引用:2016届北京市顺义区高三上学期期末统考化学试卷
名校
解题方法
5 . 环状碳酸酯广泛用于极性非质子溶剂、电池的电解质等,离子液体研究团队近期报道了一种环氧乙烷衍生物与二氧化碳催化合成环状碳酸酯的反应历程如图所示。已知:R表示烃基。
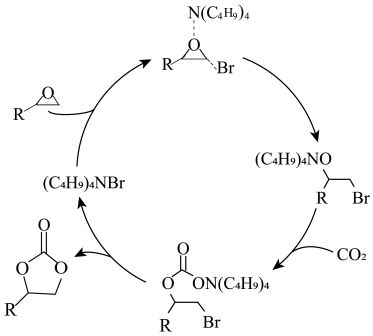
| A.(C4H9)4NBr是反应的催化剂 |
| B.反应过程存在非极性键的断裂和形成 |
| C.反应过程中有3种中间体 |
| D.总反应原子利用率可达100% |
您最近一年使用:0次
2022-08-19更新
|
836次组卷
|
5卷引用:重庆市育才中学校2022届高三二诊模拟考试(一)化学试题
名校
6 . 重氮化合物是一类活泼的化合物,在有机合成方面有着重要应用。重氮化合物A在光照及甲醇参与反应的条件下经过一系列活泼中间体转化为F的路线如下:

回答下列问题:
(1)为研究反应历程,A中的一碳原子用13C标记,这种研究方法称为_______ 。
(2)B1中的一个碳原子含有未共用电子对,易与B2相互转化或转化为C,B2的官能团名称为_______ ;上述路线中与B1、B2互为同分异构体的是_______ (填标号);核磁共振氢谱、核磁共振碳谱都常用于分析有机化合物的结构,B1或B2的核磁共振碳谱有_______ 种碳原子的吸收峰。
(3)从结果上看,C和CH3OH生成E的反应类型为_______ ;写出CH2=C=O与CH3CH2OH反应的化学方程式_______ (不要求写出中间体)。
(4)E不稳定,能自发转化为F,说明稳定性C=O_______ C=C(填“大于”“小于”或“等于”),理由是_______ (从化学键的角度说明)。
(5)X、Y是二十多年前才发现的两种生物碱,在室温下可相互转化:

含N+的中间体的结构简式为_______ ;平衡时X、Y的物质的量之比n(X):n(Y)=3:2,则X转化为Y的平衡转化率为_______ 。

回答下列问题:
(1)为研究反应历程,A中的一碳原子用13C标记,这种研究方法称为
(2)B1中的一个碳原子含有未共用电子对,易与B2相互转化或转化为C,B2的官能团名称为
(3)从结果上看,C和CH3OH生成E的反应类型为
(4)E不稳定,能自发转化为F,说明稳定性C=O
(5)X、Y是二十多年前才发现的两种生物碱,在室温下可相互转化:

含N+的中间体的结构简式为
您最近一年使用:0次
2021-03-04更新
|
404次组卷
|
2卷引用:云南省昆明市第一中学2021届高三第六次复习检测理科综合化学试题
名校
解题方法
7 . 下列过程中,共价键被破坏的是
①石英熔化②溴蒸气被木炭吸附③酒精溶于水④HCl气体溶于水⑤碘升华⑥NH4C1受热分解⑦氢氧化钠熔化⑧Na2SO4溶于水
①石英熔化②溴蒸气被木炭吸附③酒精溶于水④HCl气体溶于水⑤碘升华⑥NH4C1受热分解⑦氢氧化钠熔化⑧Na2SO4溶于水
| A.②④⑥ | B.④⑤⑥ | C.①④⑧ | D.①④⑥ |
您最近一年使用:0次
2020-07-24更新
|
1913次组卷
|
2卷引用:黑龙江省勃利县高级中学2019-2020学年高一下学期期末考试化学试题
名校
解题方法
8 . 中山大学化学科研团队首次将CsPbBr3纳米晶锚定在氨基化RGO包覆的α—Fe2O3(α—Fe2O3/Amine—RGO/CsPbBr3),构筑Z—Scheme异质结光催化剂,可有效降低电荷复合,促进电荷分离,从而提升光催化性能。光催化还原CO2和氧化H2O的反应路径如图。下列说法正确的是( )
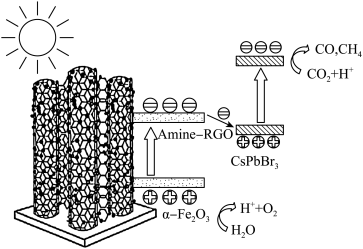

| A.该路径能量转化形式为电能→化学能 |
| B.该光催化转化反应可以阻止温室效应 |
| C.“CsPbBr3纳米晶”表面发生了还原反应 |
| D.该催化转化的总反应涉及到非极性共价键、极性共价键的断裂和形成 |
您最近一年使用:0次
2020-06-18更新
|
906次组卷
|
4卷引用:云南省昆明市2020届高三“三诊一模”高考模拟考试(三模)理综化学试题
云南省昆明市2020届高三“三诊一模”高考模拟考试(三模)理综化学试题(已下线)小题必刷21 原子结构与化学键——2021年高考化学一轮复习小题必刷(通用版)天津市天津一中2020-2021学年高三第二学期五月月考化学试题湖南省武冈市第一中学2021-2022学年高三下学期5月月考化学试题
9 . Zewail创立的飞秒( )化学研究了极短时间内的反应历程,巧妙地解决了如何确定反应起点问题。例如
)化学研究了极短时间内的反应历程,巧妙地解决了如何确定反应起点问题。例如 与
与 的反应过程片段为:
的反应过程片段为: 。下列有关说法正确的是
。下列有关说法正确的是
 )化学研究了极短时间内的反应历程,巧妙地解决了如何确定反应起点问题。例如
)化学研究了极短时间内的反应历程,巧妙地解决了如何确定反应起点问题。例如 与
与 的反应过程片段为:
的反应过程片段为: 。下列有关说法正确的是
。下列有关说法正确的是A.中间产物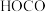 属于有机化合物 属于有机化合物 |
B.反应起点为 离解为H和I自由基,终点为 离解为H和I自由基,终点为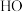 自由基与I自由基结合 自由基与I自由基结合 |
C.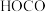 经1000fs离解为 经1000fs离解为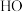 自由基和 自由基和 ,说明 ,说明 与 与 的反应速率极快 的反应速率极快 |
| D.飞秒化学展现的反应历程为“化学反应实质是旧键断裂和新键形成”提供有力证据 |
您最近一年使用:0次
2020-05-12更新
|
530次组卷
|
2卷引用:山东省青岛市2020届高三4月统一质量检测(一模)化学试题
10 . 下列说法正确的是 ( )
| A.HCl溶于水能电离出H+、Cl-,所以HCl是离子化合物 |
| B.NaHCO3受热分解生成Na2CO3、CO2和H2O,既破坏了离子键,也破坏了共价键 |
| C.He、CO2和CH4都是由分子构成,它们中都存在共价键 |
| D.碘晶体受热转变成碘蒸气,吸收的热量用于克服碘原子间的作用力 |
您最近一年使用:0次
2019-08-10更新
|
827次组卷
|
3卷引用:浙江省临海市白云高级中学2018-2019学年高一下学期期中考试化学试题
浙江省临海市白云高级中学2018-2019学年高一下学期期中考试化学试题(已下线)专题10 化学键(核心素养卷)——【新教材精创】2019-2020学年高中化学新教材知识讲学苏教版(2020)高一必修第一册专题5第二单元 综合训练



