名校
1 . 现有下列几种常见物质:① ②
② ③
③ ④
④ ⑤
⑤ ⑥
⑥ 。其中,由非极性键形成的分子是
。其中,由非极性键形成的分子是______ (填序号,下同),由极性键形成的分子是______ ,只含离子键的化合物是______ ,既含离子键又含共价键的化合物是______ 。
 ②
② ③
③ ④
④ ⑤
⑤ ⑥
⑥ 。其中,由非极性键形成的分子是
。其中,由非极性键形成的分子是
您最近一年使用:0次
2 . 1869年2月17日,门捷列夫根据当时已有的63种元素编制出第一张元素周期表,门捷列夫在适当的位置预留下空格,并预言了新元素的性质。其中镓Ga和锗Ge的发现是对元素周期律有力的证明。镓位于元素周期表中第IIIA族、锗位于元素周期表中第IVA族。回答下列问题:
(1)基态锗原子的核外电子排布式为___________ 。基态As原子中核外电子的运动状态有___________ 种。第四周期主族元素中,第一电离能介于Ga、As之间的元素有___________ 种。
(2)氯化铝熔点为194℃,会升华,熔融态不易导电。实验测得气态氯化铝分子组成为Al2Cl6,其结构式为___________ (已知Al2Cl6中原子均满足8e-稳定结构)。
(3)钴元素可形成配合物[Co(NH3)6]Cl3,1mol该配合物含有σ键的数目为___________ 。该配合物中存在的化学键有___________ (填字母)。
A.离子键 B.极性键 C.非极性键 D.氢键 E.配位键
(4)键能的大小可以衡量化学键的强弱,也可以用于计算化学反应的反应热,回答下列问题:已知H—H键能为436kJ·mol-1,N—H键能为391kJ·mol-1,N≡N键能为946kJ·mol-1,合成氨反应中,反应前充入N2和H2各6mol,达到平衡时,N2的转化率为15%,试计算这种情况下,反应___________ 能量(填“吸收”或“放出”,1分)___________ kJ。
(1)基态锗原子的核外电子排布式为
(2)氯化铝熔点为194℃,会升华,熔融态不易导电。实验测得气态氯化铝分子组成为Al2Cl6,其结构式为
(3)钴元素可形成配合物[Co(NH3)6]Cl3,1mol该配合物含有σ键的数目为
A.离子键 B.极性键 C.非极性键 D.氢键 E.配位键
(4)键能的大小可以衡量化学键的强弱,也可以用于计算化学反应的反应热,回答下列问题:已知H—H键能为436kJ·mol-1,N—H键能为391kJ·mol-1,N≡N键能为946kJ·mol-1,合成氨反应中,反应前充入N2和H2各6mol,达到平衡时,N2的转化率为15%,试计算这种情况下,反应
您最近一年使用:0次
2023-05-21更新
|
355次组卷
|
3卷引用:元素周期表
3 . 物质都是由微观粒子构成的,这些粒子的结合重组,是构成物质及其物质变化和能量变化的根本原因。
(1)6Li、14C、14N、7Li、23Na、16O这些微粒中,共有_______ 种核素,互为同位素的是_______ 。
(2)下列变化:①碘升华;②冰融化;③氯化钠溶于水;④氯化氢溶于水;⑤氢氧化钠溶于水。化学键未被破坏的是_______ (填序号),仅离子键被破坏的是_______ (填序号)。
(3)若将反应2Fe3++Cu=2Fe2++Cu2+设计成原电池装置,则负极材料为_______ ,离子导体为_______ ,正极电极反应式是_______ ;若反应过程中有0.2mol电子通过,则电解质溶液的质量变化为_______ 。
(4)从能量的变化角度研究反应:2H2(g)+O2(g)=2H2O(g)。已知一定条件下,1mol化学键断裂时吸收的能量相关数据如下表:
则生成1molH2O(g)可以放出热量_______ kJ。
(1)6Li、14C、14N、7Li、23Na、16O这些微粒中,共有
(2)下列变化:①碘升华;②冰融化;③氯化钠溶于水;④氯化氢溶于水;⑤氢氧化钠溶于水。化学键未被破坏的是
(3)若将反应2Fe3++Cu=2Fe2++Cu2+设计成原电池装置,则负极材料为
(4)从能量的变化角度研究反应:2H2(g)+O2(g)=2H2O(g)。已知一定条件下,1mol化学键断裂时吸收的能量相关数据如下表:
| 化学键 | H—H | O=O | H—O |
| 能量(kJ) | 436 | 496 | 463 |
您最近一年使用:0次
4 . 目前人类发现和合成的物质已超过1亿种,对于这么多的物质和丰富的化学变化,分类法的作用几乎是无可代替的。请利用分类法结合所学知识完成下列各小题:
(1)现有下列9种微粒: 、
、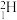 、
、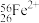 、
、 、
、 、
、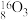 。形成上述6种微粒的核素有
。形成上述6种微粒的核素有_______ 种、元素有_______ 种。
(2)已知有下列物质:①Al ②HCl气体 ③ ④KCl ⑤熔融NaOH,其中能导电的是
④KCl ⑤熔融NaOH,其中能导电的是_______ (填标号,下同);属于电解质的是_______ ;属于共价化合物的是_______ ;只含有离子键的是_______ 。
(1)现有下列9种微粒:
 、
、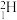 、
、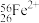 、
、 、
、 、
、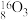 。形成上述6种微粒的核素有
。形成上述6种微粒的核素有(2)已知有下列物质:①Al ②HCl气体 ③
 ④KCl ⑤熔融NaOH,其中能导电的是
④KCl ⑤熔融NaOH,其中能导电的是
您最近一年使用:0次
解题方法
5 . I.写出下列化合物的电子式:
(1)①H2O_______ ;
②MgCl2_______
Ⅱ.有下列物质:①O2、②CO2、③NH3、④Na2O、⑤Na2O2、⑥NaOH。请回答下列问题:
(2)只含极性键的化合物是_______ (填序号,下同);
(3)含有共价键的离子化合物是_______ 。
(1)①H2O
②MgCl2
Ⅱ.有下列物质:①O2、②CO2、③NH3、④Na2O、⑤Na2O2、⑥NaOH。请回答下列问题:
(2)只含极性键的化合物是
(3)含有共价键的离子化合物是
您最近一年使用:0次
6 . 现有下列物质:①Cl2、②Na2O2、③NaOH、④HCl、⑤H2O2、⑥MgF2、⑦NH4Cl
(1)只由离子键构成的物质是___________ ;
(2)只由共价键构成的物质是___________ ;
(3)只由非金属元素组成的离子化合物是___________ ;
(4)由离子键和共价键构成的物质是___________ ;
(5)属于离子化合物的物质是___________ ;
(6)属于共价化合物的物质是___________ 。
(1)只由离子键构成的物质是
(2)只由共价键构成的物质是
(3)只由非金属元素组成的离子化合物是
(4)由离子键和共价键构成的物质是
(5)属于离子化合物的物质是
(6)属于共价化合物的物质是
您最近一年使用:0次
名校
解题方法
7 . 按要求回答问题
(1)1 mol HCHO分子中含有σ键的数目为_______ NA。
(2)CS2分子中,共价键的类型有_______ 。
(3)下列物质中:①MgCl2;②Na2O2; ③CS2 ;④NaOH; ⑤H2,只存在极性键的是_______ (填序号,下同),只存在非极性键的是_______ ,只存在离子键的是_______ ,既存在离子键又存在极性共价键的是_______ ,既存在离子键又存在非极性共价键的是_______ 。
(1)1 mol HCHO分子中含有σ键的数目为
(2)CS2分子中,共价键的类型有
(3)下列物质中:①MgCl2;②Na2O2; ③CS2 ;④NaOH; ⑤H2,只存在极性键的是
您最近一年使用:0次
2022-09-22更新
|
368次组卷
|
3卷引用:海南省儋州市鑫源中学2021-2022学年高二上学期期末考试化学试题
名校
解题方法
8 . 人们运用元素周期律和元素周期表,可以系统研究元素的性质。试回答:
(1)碱金属元素中,锂原子的结构示意图为__ 、其中6Li、7Li互为__ ,用电子式表示Li2O的形成过程___ 。
(2)金属钾19K位于元素周期表中的第__ 周期、第__ 族;钾的氧化物有多种,其中过氧化钾(K2O2)和超氧化钾(KO2)常作供氧剂,写出过氧化钾与CO2反应的化学方程式:___ ;超氧化钾与水反应如下,请配平该反应的化学方程式:
_ KO2+_ H2O=_ KOH+_ O2↑+_ H2O2
(3)第三周期元素中,酸性最强的HClO4中氯元素的化合价为__ 、可作半导体材料的元素是__ (填名称),当反应H2+Cl2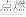 2HCl发生过程中,涉及到
2HCl发生过程中,涉及到___ 键断裂和__ 键的形成。(填:离子键或极性键或非极性键)
(1)碱金属元素中,锂原子的结构示意图为
(2)金属钾19K位于元素周期表中的第
(3)第三周期元素中,酸性最强的HClO4中氯元素的化合价为
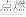 2HCl发生过程中,涉及到
2HCl发生过程中,涉及到
您最近一年使用:0次
解题方法
9 . 根据要求回答下列问题。
①CaBr2 ②H2O ③NH4Cl ④H2O2 ⑤Na2O2 ⑥Ca(OH)2 ⑦HClO ⑧CO2
(1)写出Na2O2的电子式________ ,存在的化学键类型有________________ 。
(2)写出HClO电子式________________ ,写出CO2的结构式_______ 。
(3)含有共价键的离子化合物是_______ (填序号)
(4)用电子式表示CaBr2的形成过程_________________________________ 。
①CaBr2 ②H2O ③NH4Cl ④H2O2 ⑤Na2O2 ⑥Ca(OH)2 ⑦HClO ⑧CO2
(1)写出Na2O2的电子式
(2)写出HClO电子式
(3)含有共价键的离子化合物是
(4)用电子式表示CaBr2的形成过程
您最近一年使用:0次
名校
10 . 有下列物质:①金属铜 ②NaOH ③I2 ④MgCl2 ⑤Na2O2 ⑥氩气 回答下列问题:
(1)不存在化学键的是_________________________
(2)只存在非极性键的是__________________________
(3)只存在离子键的是__________________________
(4)既存在离子键又存在极性键的是__________________________
(5)既存在离子键又存在非极性键的是____________________________
(1)不存在化学键的是
(2)只存在非极性键的是
(3)只存在离子键的是
(4)既存在离子键又存在极性键的是
(5)既存在离子键又存在非极性键的是
您最近一年使用:0次
2018-05-02更新
|
1128次组卷
|
7卷引用:海南省热科院两院中学2017-2018高一下学期期中考试化学试题



