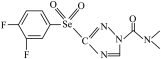
1 . 科技的发展为新能源开发和新材料研制开拓出更大的空间。中科院科学家最近合成了一种新型材料,其结构简式为:___________ 种空间伸展方向;基态硒原子的价层电子排布式是___________ ;氟、氧、氮三种元素的第一电离能由大到小的顺序___________ (用元素符号表示)。
(2)该分子中含有氮、氧、氟三种电负性很大的原子,也含有氢原子,它___________ (填“能”或“不能”)形成分子内或者分子间氢键,其原因是___________ 。
(3)硒能形成两种常见的氧化物,分子式为___________ 。
(4)常压下,氨气在300℃时约有10%分解,水蒸气在2000℃时约有5%分解,从物质结构的角度看,其原因是___________ 。
(2)该分子中含有氮、氧、氟三种电负性很大的原子,也含有氢原子,它
(3)硒能形成两种常见的氧化物,分子式为
(4)常压下,氨气在300℃时约有10%分解,水蒸气在2000℃时约有5%分解,从物质结构的角度看,其原因是
您最近一年使用:0次
名校
解题方法
2 . 白铜是以镍为主要添加元素的铜基合金,呈银白色,有金属光泽,故名白铜。云南镍白铜(铜镍合金)文明中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1) 的核外电子排布式为
的核外电子排布式为_______ ,3d能级上的未成对的电子数为_______ 。
(2)硫酸镍溶于氨水形成蓝色的 溶液。
溶液。
①在 中
中 与
与 之间形成的化学键称为
之间形成的化学键称为_______ ,提供孤电子对的成键原子是_______ (用元素符表示)。
②氨极易溶于 ,除因为它们都是极性分子外,还因为
,除因为它们都是极性分子外,还因为_______ 。
(3)单质铜的堆积方式为_______ ;元素铜与镍的第二电离能分别为: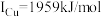 ,
,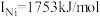 ,
,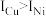 的原因是
的原因是_______ 。
(1)
 的核外电子排布式为
的核外电子排布式为(2)硫酸镍溶于氨水形成蓝色的
 溶液。
溶液。①在
 中
中 与
与 之间形成的化学键称为
之间形成的化学键称为②氨极易溶于
 ,除因为它们都是极性分子外,还因为
,除因为它们都是极性分子外,还因为(3)单质铜的堆积方式为
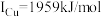 ,
,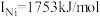 ,
,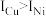 的原因是
的原因是
您最近一年使用:0次
3 . 近年来,我国航天事业发展迅猛,这与材料技术的进步密切相关。如新型储氢材料、陶瓷基复合材料氮化硼(BN)、太阳能电池材料砷化镓(GaAs)等,请按要求回答问题:
(1)基态砷原子的核外电子排布式为_______ ,其电子占据的最高能层符号是_______ ,占据最高能级的电子所在的原子轨道为_______ 形。
(2)硼氢化钠(NaBH4,其中氢元素显-1价)是研究最广泛的储氢材料之一,它可以与水反应缓慢产生氢气: NaBH4+ 2H2O=NaBO2+ 4H2↑。上述方程式中所涉及的非金属元素的电负性由大到小的顺序为_______ ;与硼处于同一周期的元素中,第一电离能大于硼的元素有_______ 种。硼原子在成键时,能将一个2s电子激发进入2p能级参与形成化学键,请写出该激发态原子的价电子的轨道表示式_______ ,该过程形成的原子光谱为_______ 光谱(填“吸收”或“发射”)。
(3)简单金属氢化物也是具有良好发展前景的储氢材料。在LiH中,离子半径: Li+_______ H-(填“>”“=”或“<”,原因是_______ 。
(4)铜、锌两种元素位于元素周期表的_______ 区,两元素的第一电离能(I1)、第二电离能(I2)数据如表所示:
铜的I1小于锌,I2却大于锌的主要原因是_______ 。
(1)基态砷原子的核外电子排布式为
(2)硼氢化钠(NaBH4,其中氢元素显-1价)是研究最广泛的储氢材料之一,它可以与水反应缓慢产生氢气: NaBH4+ 2H2O=NaBO2+ 4H2↑。上述方程式中所涉及的非金属元素的电负性由大到小的顺序为
(3)简单金属氢化物也是具有良好发展前景的储氢材料。在LiH中,离子半径: Li+
(4)铜、锌两种元素位于元素周期表的
| 电离能/(kJ·mol-1) | I1 | I2 |
| 铜 | 746 | 1958 |
| 锌 | 906 | 1733 |
您最近一年使用:0次
2022-04-13更新
|
850次组卷
|
3卷引用:重庆市巴蜀中学2021-2022学年高二上学期期末考试化学试题
重庆市巴蜀中学2021-2022学年高二上学期期末考试化学试题重庆市渝中区巴蜀中学2022-2023学年高二上学期期末测试化学试题(已下线)寒假作业10 原子结构与性质-【寒假分层作业】2024年高二化学寒假培优练(人教版2019)



