1 . 下表为元素周期表的一部分,请参照元素①—⑩在表中的位置,回答下列问题:___________ (用元素符号表示)。
(2)④、⑤、⑥的原子半径由大到小的顺序为___________ (用元素符号表示);
(3)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是___________ (用化学式表示)。
(4)①、④、⑤、⑧中的某些 元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:___________ 。
(5)第一电离能 :
: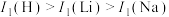 ,原因是
,原因是___________ 。
(6)基态⑧原子占据的最高能级的电子云轮廓图的形状是___________ 形;基态⑨原子的价层电子排布的轨道表示式为___________ ;元素⑩属于___________ 区(填“s”、“d”、“ds”或“p”)。
(7)由④元素形成的常见物质有很多,例如: 、
、 、
、 等,基态④原子的核外电子排布式是
等,基态④原子的核外电子排布式是___________ ,对 分子结构的研究,曾有以下推测:
分子结构的研究,曾有以下推测: 分子中
分子中___________ (填字母序号),确定其结构一定不是甲。
a. 键长 b.
键长 b. 键能 c.
键能 c. 键角
键角
(2)④、⑤、⑥的原子半径由大到小的顺序为
(3)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是
(4)①、④、⑤、⑧中的
(5)第一电离能
 :
: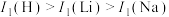 ,原因是
,原因是(6)基态⑧原子占据的最高能级的电子云轮廓图的形状是
(7)由④元素形成的常见物质有很多,例如:
 、
、 、
、 等,基态④原子的核外电子排布式是
等,基态④原子的核外电子排布式是 分子结构的研究,曾有以下推测:
分子结构的研究,曾有以下推测: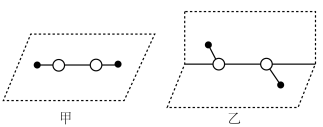
 分子中
分子中a.
 键长 b.
键长 b. 键能 c.
键能 c. 键角
键角
您最近一年使用:0次
解题方法
2 . 回答下列问题。
(1)写出铬原子价电子排布式:___________ ;与铬同一周期的元素原子中最外层电子数与铬原子的相同的元素有___________ (填元素符号)。
(2)第三周期第一电离能处于Al和P之间的元素有___________ 种。
(3)NO 互为等电子体的分子或离子为
互为等电子体的分子或离子为___________ 。
(4)1 mol CH2=CH-CH2OH含___________ molσ键,该分子中碳原子的杂化类型为___________ 。
(1)写出铬原子价电子排布式:
(2)第三周期第一电离能处于Al和P之间的元素有
(3)NO
 互为等电子体的分子或离子为
互为等电子体的分子或离子为(4)1 mol CH2=CH-CH2OH含
您最近一年使用:0次
3 . 按要求回答问题。
(1)1 mol HCHO分子中含有σ键的数目为___________ NA。
(2)CS2分子中,共价键的类型有___________ 。
(3)下列物质中:
①MgCl2;②Na2O2; ③CS2 ;④NaOH;⑤H2。
只存在极性键的是___________ (填序号,下同),只存在非极性键的是___________ ,只存在离子键的是___________ ,既存在离子键又存在极性共价键的是___________ ,既存在离子键又存在非极性共价键的是___________ 。
(4)第一电离能比较Mg___________ Al,解释原因___________ 。
(1)1 mol HCHO分子中含有σ键的数目为
(2)CS2分子中,共价键的类型有
(3)下列物质中:
①MgCl2;②Na2O2; ③CS2 ;④NaOH;⑤H2。
只存在极性键的是
(4)第一电离能比较Mg
您最近一年使用:0次
4 . 按要求回答下列问题:
(1)消毒液的组成元素中,基态O原子的电子排布式是______ ,基态Cl原子未成对电子数为_____ 个。
(2)与氧元素相邻的氮元素的第一电离能的大小顺序为_______ (填元素符号),氧元素和氮元素的非金属性的大小顺序为________ (填元素符号)
(3)某元素原子的最外层电子构型为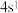 ,元素周期表的位置第
,元素周期表的位置第____ 周期,第_____ 族,它属于____ 区元素。
(1)消毒液的组成元素中,基态O原子的电子排布式是
(2)与氧元素相邻的氮元素的第一电离能的大小顺序为
(3)某元素原子的最外层电子构型为
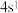 ,元素周期表的位置第
,元素周期表的位置第
您最近一年使用:0次
解题方法
5 . 硅材料在生活中占有重要地位。请回答:
(1) 分子的空间结构(以
分子的空间结构(以 为中心)名称为
为中心)名称为___________ ,分子中氮原子的杂化轨道类型是___________ 。 受热分解生成
受热分解生成 和
和 ,其受热不稳定的原因是
,其受热不稳定的原因是___________ 。
(2)由硅原子核形成的三种微粒,电子排布式分别为:①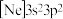 、②
、② 、③
、③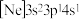 ,有关这些微粒的叙述,正确的是___________。
,有关这些微粒的叙述,正确的是___________。
(1)
 分子的空间结构(以
分子的空间结构(以 为中心)名称为
为中心)名称为 受热分解生成
受热分解生成 和
和 ,其受热不稳定的原因是
,其受热不稳定的原因是(2)由硅原子核形成的三种微粒,电子排布式分别为:①
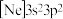 、②
、② 、③
、③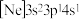 ,有关这些微粒的叙述,正确的是___________。
,有关这些微粒的叙述,正确的是___________。| A.微粒半径:③>②>① | B.电子排布属于基态原子(或离子)的是:①② |
| C.电离一个电子所需最低能量:①>②>③ | D.得电子能力:①>② |
您最近一年使用:0次
解题方法
6 . 硫代硫酸盐是一类具有应用前景的浸金试剂。硫代硫酸根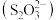 可看作是
可看作是 中的一个
中的一个 原子被
原子被 原子取代的产物。
原子取代的产物。
(1)基态 原子价层电子排布式是
原子价层电子排布式是___________ 。
(2)比较 原子和O原子的第一电离能大小,从原子结构的角度说明理由:
原子和O原子的第一电离能大小,从原子结构的角度说明理由:___________ 。
(3) 的空间结构是
的空间结构是___________ 。
(4)同位素示踪实验可证实 中两个
中两个 原子的化学环境不同,实验过程为
原子的化学环境不同,实验过程为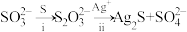 。过程ⅱ中,
。过程ⅱ中, 断裂的只有硫硫键,若过程ⅰ所用试剂是
断裂的只有硫硫键,若过程ⅰ所用试剂是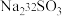 和
和 ,过程ⅱ含硫产物是
,过程ⅱ含硫产物是___________ 。
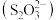 可看作是
可看作是 中的一个
中的一个 原子被
原子被 原子取代的产物。
原子取代的产物。(1)基态
 原子价层电子排布式是
原子价层电子排布式是(2)比较
 原子和O原子的第一电离能大小,从原子结构的角度说明理由:
原子和O原子的第一电离能大小,从原子结构的角度说明理由:(3)
 的空间结构是
的空间结构是(4)同位素示踪实验可证实
 中两个
中两个 原子的化学环境不同,实验过程为
原子的化学环境不同,实验过程为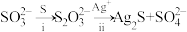 。过程ⅱ中,
。过程ⅱ中, 断裂的只有硫硫键,若过程ⅰ所用试剂是
断裂的只有硫硫键,若过程ⅰ所用试剂是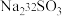 和
和 ,过程ⅱ含硫产物是
,过程ⅱ含硫产物是
您最近一年使用:0次
名校
7 . 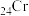 的第二电离能和
的第二电离能和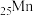 的第二电离能分别为
的第二电离能分别为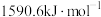 、
、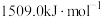 ,
,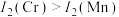 的原因是
的原因是___________ 。
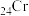 的第二电离能和
的第二电离能和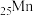 的第二电离能分别为
的第二电离能分别为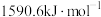 、
、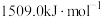 ,
,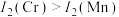 的原因是
的原因是
您最近一年使用:0次
名校
解题方法
8 . 元素周期表中第四周期的某些过渡元素(如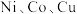 等)在生产、生活中有着广泛的应用.
等)在生产、生活中有着广泛的应用.
(1) 能与水杨醛缩对氯苯胺形成具有发光性的配合物,水杨醛缩对氯苯胺制备反应方程式如下:
能与水杨醛缩对氯苯胺形成具有发光性的配合物,水杨醛缩对氯苯胺制备反应方程式如下: 核外电子排布式
核外电子排布式_________ ;
② 元素的第一电离能由大到小的顺序为
元素的第一电离能由大到小的顺序为__________ . 的晶胞如图1所示,距离每个
的晶胞如图1所示,距离每个 最近的
最近的 的个数为
的个数为_________ .
(3)已知: 结构如图2所示,该反应
结构如图2所示,该反应________ (选填“是”或“不是”)氧化还原反应,理由是__________ .
(4)有机净化剂的基本组分为大分子立体网格结构的聚合物,可用于工业废水“除钴镍”.其净化原理可表示为: ”表示出
”表示出 参与的配位键
参与的配位键_________ .
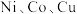 等)在生产、生活中有着广泛的应用.
等)在生产、生活中有着广泛的应用.(1)
 能与水杨醛缩对氯苯胺形成具有发光性的配合物,水杨醛缩对氯苯胺制备反应方程式如下:
能与水杨醛缩对氯苯胺形成具有发光性的配合物,水杨醛缩对氯苯胺制备反应方程式如下:
 核外电子排布式
核外电子排布式②
 元素的第一电离能由大到小的顺序为
元素的第一电离能由大到小的顺序为③对羟基苯甲醛( )的沸点为
)的沸点为 ,而水杨醛(
,而水杨醛(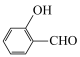 )的沸点为
)的沸点为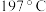 ,请从结构角度解释二者沸点差异原因
,请从结构角度解释二者沸点差异原因
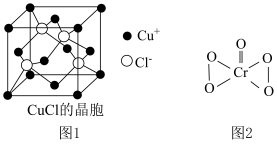
 的晶胞如图1所示,距离每个
的晶胞如图1所示,距离每个 最近的
最近的 的个数为
的个数为(3)已知:
 结构如图2所示,该反应
结构如图2所示,该反应(4)有机净化剂的基本组分为大分子立体网格结构的聚合物,可用于工业废水“除钴镍”.其净化原理可表示为:
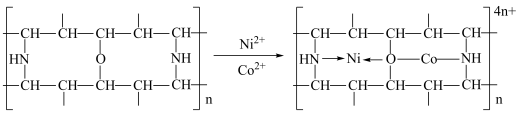
 ”表示出
”表示出 参与的配位键
参与的配位键
您最近一年使用:0次
2024-05-04更新
|
169次组卷
|
2卷引用:江苏省扬州市新华中学2023-2024学年高二下学期4月期中考试化学试题
9 . 依据原子结构知识回答下列问题。
(1)下列有关说法错误的是___________。
(2)基态V原子中具有___________ 种不同能量的电子,具有___________ 种不同空间运动状态的电子,具有___________ 种不同运动状态的电子。
(3)基态Cu原子的简化电子排布式为___________ ,基态Se原子的价电子轨道表示式为___________ ,基态Mn2+的价电子排布式为___________ 。
(1)下列有关说法错误的是___________。
| A.简单离子的还原性:P3->O2->F- |
| B.在元素周期表第二周期中元素原子的第一电离能介于硼和氮之间的元素有两种 |
| C.焰色试验与电子跃迁有关 |
| D.基态铝原子占据的最高能级的电子云轮廓图的形状为球形 |
(3)基态Cu原子的简化电子排布式为
您最近一年使用:0次
名校
10 . 硒(Se)是一种有抗癌、抗氧化作用的元素,可以形成多种化合物。
(1)基态硒原子的价层电子排布式为___________ ;As的第一电离能比Se的第一电离能大的原因为___________ 。
(2) 中心原子的杂化类型是:
中心原子的杂化类型是:___________ , 的立体构型是
的立体构型是___________ 。
(3) 属于
属于___________ (填“极性”或“非极性”)分子;比较 与
与 沸点高低,并说明原因:
沸点高低,并说明原因:___________ 。
(4)硒化锌(ZnSe)是一种重要的半导体材料,其晶胞结构如图所示,该晶胞中硒原子的配位数为___________ ;若该晶胞密度为ρg⋅cm ,硒化锌的摩尔质量为Mg⋅mol
,硒化锌的摩尔质量为Mg⋅mol ,
, 代表阿伏加德罗常数的值,则晶胞参数(边长)a为
代表阿伏加德罗常数的值,则晶胞参数(边长)a为___________ 。
(1)基态硒原子的价层电子排布式为
(2)
 中心原子的杂化类型是:
中心原子的杂化类型是: 的立体构型是
的立体构型是(3)
 属于
属于 与
与 沸点高低,并说明原因:
沸点高低,并说明原因:(4)硒化锌(ZnSe)是一种重要的半导体材料,其晶胞结构如图所示,该晶胞中硒原子的配位数为
 ,硒化锌的摩尔质量为Mg⋅mol
,硒化锌的摩尔质量为Mg⋅mol ,
, 代表阿伏加德罗常数的值,则晶胞参数(边长)a为
代表阿伏加德罗常数的值,则晶胞参数(边长)a为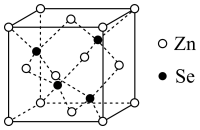
您最近一年使用:0次
2024-05-03更新
|
356次组卷
|
2卷引用:北京市大兴区第一中学2023-2024学年高二下学期3月月考化学试题



