1 . 磷酸亚铁锂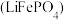 和锰酸锂
和锰酸锂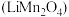 均可用作锂离子电池正极材料。回答下列问题:
均可用作锂离子电池正极材料。回答下列问题:
(1)基态O原子的价电子轨道表示式为___________ ;Mn的原子结构示意图为___________ 。
(2) 的熔、沸点
的熔、沸点___________ (填“高于”或“低于”) 。
。
(3) 分子中,与N原子相连的H呈正电性
分子中,与N原子相连的H呈正电性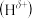 ,与B原子相连的H呈负电性
,与B原子相连的H呈负电性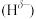 ,H、B、N电负性由小到大的顺序是
,H、B、N电负性由小到大的顺序是___________ 。
(4)已知: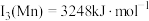 ,
,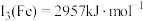 。Mn的第三电离能大于Fe的第三电离能,其主要原因是
。Mn的第三电离能大于Fe的第三电离能,其主要原因是___________ 。
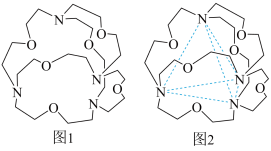
(5)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种 配合物的结构如图所示,2mol该配合物中通过
配合物的结构如图所示,2mol该配合物中通过螯合作用 形成的配位键有___________ mol。
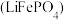 和锰酸锂
和锰酸锂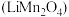 均可用作锂离子电池正极材料。回答下列问题:
均可用作锂离子电池正极材料。回答下列问题:(1)基态O原子的价电子轨道表示式为
(2)
 的熔、沸点
的熔、沸点 。
。(3)
 分子中,与N原子相连的H呈正电性
分子中,与N原子相连的H呈正电性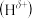 ,与B原子相连的H呈负电性
,与B原子相连的H呈负电性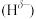 ,H、B、N电负性由小到大的顺序是
,H、B、N电负性由小到大的顺序是(4)已知:
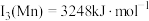 ,
,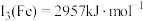 。Mn的第三电离能大于Fe的第三电离能,其主要原因是
。Mn的第三电离能大于Fe的第三电离能,其主要原因是(5)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种
 配合物的结构如图所示,2mol该配合物中通过
配合物的结构如图所示,2mol该配合物中通过
您最近一年使用:0次
名校
解题方法
2 . 氮元素可以形成多种化合物。回答以下问题:
(1)基态氮原子的核外电子排布式是___________ 。
(2)N原子的第一电离能比O原子的第一电离能要大,可能原因是___________ 。
(3)NH3分子的VSEPR模型名称是___________ 。
(4)图1表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体的4个顶点(见图2),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别。
下列分子或离子中,能被该有机化合物识别的是___________(填标号)。
(5)下列说法正确的是___________。
(1)基态氮原子的核外电子排布式是
(2)N原子的第一电离能比O原子的第一电离能要大,可能原因是
(3)NH3分子的VSEPR模型名称是
(4)图1表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体的4个顶点(见图2),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别。

下列分子或离子中,能被该有机化合物识别的是___________(填标号)。
A. | B. | C. | D. |
| A.NO2、BF3、NCl3分子中没有一个分子中原子的最外层电子都满足了8电子稳定结构 |
| B.HCN的分子结构为直线形 |
C. 离子的VSEPR模型与空间结构是一致的 离子的VSEPR模型与空间结构是一致的 |
| D.NH3分子中有一对未成键的孤电子对,它对成键电子的排斥作用较强 |
您最近一年使用:0次
名校
解题方法
3 . 根据物质结构的有关性质和特点,回答下列问题:
(1)基态氧原子的价电子排布图为___________ ,基态镁原子核外有种能量不同的电子,Cr3+基态核外电子排布式为___________ 。
(2)丙烯腈(CH2=CH-CN)分子中3个碳原子杂化轨道类型从左到右依次是___________ ,H、C、N元素电负性由大到小的顺序为___________ 。
(3)碳、氮、氧、氟元素的第一电离能从小到大的顺序为___________ ,碳、氮、氧、氟元素的第三电离能从小到大的顺序为___________ 。
(4)Sm的价层电子排布式为4f66s2,则Sm位于元素周期表的___________ 区,Sm3+价层电子排布式为___________ 。
(5)雌黄的分子式为As2S3,其分子结构为 ,As原子的杂化类型为
,As原子的杂化类型为___________ 。
(6)LiBH4由Li+和BH 构成,BH
构成,BH 的立体构型是
的立体构型是___________ ,根据化合物LiBH4判断,Li、B、H的电负性由大到小的顺序为___________ 。
(1)基态氧原子的价电子排布图为
(2)丙烯腈(CH2=CH-CN)分子中3个碳原子杂化轨道类型从左到右依次是
(3)碳、氮、氧、氟元素的第一电离能从小到大的顺序为
(4)Sm的价层电子排布式为4f66s2,则Sm位于元素周期表的
(5)雌黄的分子式为As2S3,其分子结构为
 ,As原子的杂化类型为
,As原子的杂化类型为(6)LiBH4由Li+和BH
 构成,BH
构成,BH 的立体构型是
的立体构型是
您最近一年使用:0次
4 . 已知元素 是组成物质
是组成物质 的其中一种元素。元素
的其中一种元素。元素 的气态原子逐个失去第1个至第4个电子所需能量(即电离能,用符号
的气态原子逐个失去第1个至第4个电子所需能量(即电离能,用符号 至
至 表示)如表所示:
表示)如表所示:
(1)元素 是
是___________ (填元素符号)。
(2)基态氮原子核外有___________ 种不同运动状态的电子,有___________ 种能量不同的电子。
(3) 中,电负性最大的元素是
中,电负性最大的元素是___________ (填元素符号), 的
的___________ 杂化轨道与 的
的 轨道形成
轨道形成___________ 键。
 是组成物质
是组成物质 的其中一种元素。元素
的其中一种元素。元素 的气态原子逐个失去第1个至第4个电子所需能量(即电离能,用符号
的气态原子逐个失去第1个至第4个电子所需能量(即电离能,用符号 至
至 表示)如表所示:
表示)如表所示: |  |  |  | |
电离能 | 578 | 1817 | 2745 | 11578 |
 是
是(2)基态氮原子核外有
(3)
 中,电负性最大的元素是
中,电负性最大的元素是 的
的 的
的 轨道形成
轨道形成
您最近一年使用:0次
名校
解题方法
5 . 请回答下列问题:
(1)铱(Ir)与钴为同族元素,其核外电子占据最高能层的符号为 p,则基态 Ir 原子的价电子排布式为_______ 。
(2)下列状态的钙中,电离最外层一个电子所需能量最大的是_______(填标号);
(3)N、P、O、S 的简单氢化物性质的比较:
①热稳定性:NH3>PH3,其原因是_______ ,
②在乙醇中的溶解度:H2O>H2S,其原因是_______ ;
(4)H3O+离子和 SeO3分子的空间构型分别是_______ 、_______ ,O、F、S 电负性由大到小的顺序为_______ ;
(1)铱(Ir)与钴为同族元素,其核外电子占据最高能层的符号为 p,则基态 Ir 原子的价电子排布式为
(2)下列状态的钙中,电离最外层一个电子所需能量最大的是_______(填标号);
A.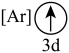 | B.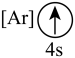 | C.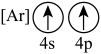 | D.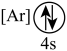 |
①热稳定性:NH3>PH3,其原因是
②在乙醇中的溶解度:H2O>H2S,其原因是
(4)H3O+离子和 SeO3分子的空间构型分别是
您最近一年使用:0次
6 . 合成氨是人类科学技术发展史上的一项重大成就,是化学和技术对社会发展与进步的巨大贡献。
(1)基态氮原子中,能量最高的电子的电子云在空间有_______ 个伸展方向。
(2)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用“ ”表示,与之相反的用“
”表示,与之相反的用“ ”表示,称为电子的自旋磁量子数。对于基态的氮原子,其价电子自旋磁量子数的代数和为
”表示,称为电子的自旋磁量子数。对于基态的氮原子,其价电子自旋磁量子数的代数和为_______ 。
(3)铁触媒是普遍使用的以铁为主体的多成分催化剂,通常还含有 、
、 、CaO、MgO、
、CaO、MgO、 等氧化物中的几种。
等氧化物中的几种。
①Cr原子的价电子排布图为_______ ;第四周期ds区元素中,与基态Cr原子最外层电子数目相同的元素的元素符号为_______ 。
②上述氧化物所涉及的元素中,处于元素周期表中p区的元素有_______ (填元素符号)
(4)我国科研人员研制出了M-LiH(M为Fe、Mn等金属)等催化剂,使得合成氨工业的温度,压强分别降到了350℃、1MPa,这是近年来合成氨反应研究中的重要突破。
①Mn在元素周期表中的位置_______ ,基态Mn原子未成对的电子数为_______ 。
②第三电离能
_______ 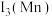 (填“>”或“<”),原因是
(填“>”或“<”),原因是_______ 。
(1)基态氮原子中,能量最高的电子的电子云在空间有
(2)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用“
 ”表示,与之相反的用“
”表示,与之相反的用“ ”表示,称为电子的自旋磁量子数。对于基态的氮原子,其价电子自旋磁量子数的代数和为
”表示,称为电子的自旋磁量子数。对于基态的氮原子,其价电子自旋磁量子数的代数和为(3)铁触媒是普遍使用的以铁为主体的多成分催化剂,通常还含有
 、
、 、CaO、MgO、
、CaO、MgO、 等氧化物中的几种。
等氧化物中的几种。①Cr原子的价电子排布图为
②上述氧化物所涉及的元素中,处于元素周期表中p区的元素有
(4)我国科研人员研制出了M-LiH(M为Fe、Mn等金属)等催化剂,使得合成氨工业的温度,压强分别降到了350℃、1MPa,这是近年来合成氨反应研究中的重要突破。
①Mn在元素周期表中的位置
②第三电离能

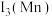 (填“>”或“<”),原因是
(填“>”或“<”),原因是
您最近一年使用:0次
2023-02-14更新
|
668次组卷
|
3卷引用:山东省泰安市2022-2023学年高二上学期期末考试化学试题
名校
7 . 我国科学家构建了新型催化剂“纳米片”(Co−N−C),该“纳米片”可用于氧化 和吸附
和吸附 。回答下列问题:
。回答下列问题:
(1)基态Co原子的价层电子排布式为______ ,N、C、Co中第一电离能最大的是______ (填元素符号)。
(2)在空气中 会被氧化成
会被氧化成 。
。 的空间结构是
的空间结构是______ , 中S原子采用
中S原子采用______ 杂化。已知氧族元素氢化物的熔沸点高低顺序为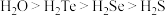 ,其原因是
,其原因是______ 。
(3)氰气 称为拟卤素,它的分子中每个原子最外层都达到8电子结构,则
称为拟卤素,它的分子中每个原子最外层都达到8电子结构,则 分子中σ键、π键个数之比为
分子中σ键、π键个数之比为______ 。
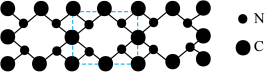
(4)氮和碳组成的一种新型材料,硬度超过金刚石,其部分结构如下图所示。它的化学式为______ 。
 和吸附
和吸附 。回答下列问题:
。回答下列问题:(1)基态Co原子的价层电子排布式为
(2)在空气中
 会被氧化成
会被氧化成 。
。 的空间结构是
的空间结构是 中S原子采用
中S原子采用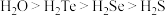 ,其原因是
,其原因是(3)氰气
 称为拟卤素,它的分子中每个原子最外层都达到8电子结构,则
称为拟卤素,它的分子中每个原子最外层都达到8电子结构,则 分子中σ键、π键个数之比为
分子中σ键、π键个数之比为(4)氮和碳组成的一种新型材料,硬度超过金刚石,其部分结构如下图所示。它的化学式为

您最近一年使用:0次
2023-02-10更新
|
619次组卷
|
3卷引用: 湖南师范大学附属中学2022-2023学年高二上学期期末考试化学试题
22-23高二上·浙江杭州·期中
8 . 回答下列问题
(1)F元素的基态原子最外层电子排布式为nsnnpn+3,则n=___________ ;基态原子中能量最高的是___________ 电子,核外电子的轨道表示式为___________ 。
(2)硝酸和尿素( )的相对分子质量接近,但常温下硝酸为挥发性液体,尿素为固体,请解释原因:
)的相对分子质量接近,但常温下硝酸为挥发性液体,尿素为固体,请解释原因:___________ 。
(3)N、O、S的第一电离能(I1)由大到小的顺序为___________ ,原因是______________________ 。
(1)F元素的基态原子最外层电子排布式为nsnnpn+3,则n=
(2)硝酸和尿素(
 )的相对分子质量接近,但常温下硝酸为挥发性液体,尿素为固体,请解释原因:
)的相对分子质量接近,但常温下硝酸为挥发性液体,尿素为固体,请解释原因:(3)N、O、S的第一电离能(I1)由大到小的顺序为
您最近一年使用:0次
9 . 依据原子结构知识回答下列问题。
(1)下列有关说法错误的是_______。
(2)基态氟原子的第一电离能_______ 基态氮原子的第一电离能(填大于、小于或等于)的原因是_______ 。
(3)基态Mn2+的价电子排布式为_______ 。
(4)Li2O是离子晶体,其形成过程中的能量变化如图(a)所示。
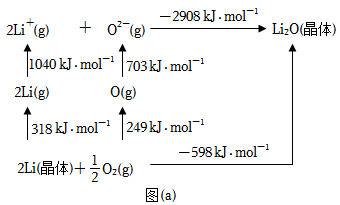
可知,Li原子的第一电离能为_______ kJ·mol-1,O=O键键能为_______ kJ·mol-1。
(1)下列有关说法错误的是_______。
| A.简单离子的还原性: P3->O2->F- |
| B.在元素周期表第二周期中元素原子的第一电离能介于硼和氮之间的元素有两种 |
| C.焰色试验与电子跃迁有关 |
| D.基态铝原子占据的最高能级的电子云轮廓图的形状为球形 |
(3)基态Mn2+的价电子排布式为
(4)Li2O是离子晶体,其形成过程中的能量变化如图(a)所示。
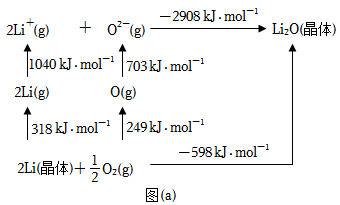
可知,Li原子的第一电离能为
您最近一年使用:0次
10 . 雄黄(As4S4)、雌黄(As2S3)均可入药,具有解毒、杀菌、去燥湿的功效,也是中国画主要的黄色矿物质颜料。回答下列问题:
(1)基态硫原子核外电子的空间运动状态有_______ 种;其核外电子运动最高能级的电子云轮廓图的形状为_______ 。
(2)基态砷原子的价层电子的轨道表示式为_______ 。
(3)第一电离能As_______ Se(填“>”或“<”),其判断理由是_______ 。
(4)基态原子的N能层有1个未成对电子,M能层未成对电子数最多的元素是_______ (填元素符号,下同),其价层电子排布式为_______ 。该元素处于周期表的_______ 区
(1)基态硫原子核外电子的空间运动状态有
(2)基态砷原子的价层电子的轨道表示式为
(3)第一电离能As
(4)基态原子的N能层有1个未成对电子,M能层未成对电子数最多的元素是
您最近一年使用:0次
2023-01-13更新
|
289次组卷
|
2卷引用:浙江省宁波效实中学2022-2023学年高二上学期期中考试化学试题



