名校
解题方法
1 . 硼、砷、铁等元素可形成结构、性质各异的物质,在生产、科研中发挥着重要用途。回答下列问题:
(1)下列不同状态的硼中,失去一个电子需要吸收能量最多的是___________ (填标号,下同),用光谱仪可捕捉到发射光谱的是___________ 。___________ 种。CH3As(OH)2与(CH3)2AsOH两种含砷有机酸中沸点较高的是___________ (填化学式),原因为___________ 。
(3)LiZnAs晶体的立方晶胞结构如图1所示,N点原子分数坐标为( ,
, ,
, );LiZnAs晶体部分Zn原子被Mn原子代替后可以形成一种新型稀磁半导体LiZnmMnnAs,其立方晶胞结构如图2所示。
);LiZnAs晶体部分Zn原子被Mn原子代替后可以形成一种新型稀磁半导体LiZnmMnnAs,其立方晶胞结构如图2所示。___________ 。
②m=_________
③已知NA为阿伏加德罗常数的值,LiZnmMnnAs的摩尔质量为Mg/mol,晶体密度为dg/cm3。晶胞中As原子与Mn原子之间的最短距离为___________ nm(列出计算式)。
(4)FeSO4·7H2O的结构如图所示。___________ (填序号)。
(1)下列不同状态的硼中,失去一个电子需要吸收能量最多的是
A.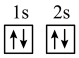 B.
B.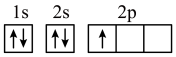
C. D.
D.
(3)LiZnAs晶体的立方晶胞结构如图1所示,N点原子分数坐标为(
 ,
, ,
, );LiZnAs晶体部分Zn原子被Mn原子代替后可以形成一种新型稀磁半导体LiZnmMnnAs,其立方晶胞结构如图2所示。
);LiZnAs晶体部分Zn原子被Mn原子代替后可以形成一种新型稀磁半导体LiZnmMnnAs,其立方晶胞结构如图2所示。
②m=
③已知NA为阿伏加德罗常数的值,LiZnmMnnAs的摩尔质量为Mg/mol,晶体密度为dg/cm3。晶胞中As原子与Mn原子之间的最短距离为
(4)FeSO4·7H2O的结构如图所示。

您最近一年使用:0次
2023-12-27更新
|
556次组卷
|
3卷引用:山东省聊城颐中外国语学校2023-2024学年高二下学期第一次质量检测化学试题
2 . 磷及其化合物在生产、生活中具有广泛的用途,回答下列问题:
(1)白磷(结构如图所示)在潮湿的空气中发生缓慢氧化,在40℃左右即可自燃。

①白磷( )的相对分子质量为
)的相对分子质量为___________ 。
②基态P原子中成对电子数与未成对电子数之比为___________ 。
③基态P原子中能量最高的电子所占据原子轨道的电子云轮廓图为___________ 形。
(2)磷及其部分重要化合物的相互转化如图所示。

①基态钙原子的简化电子排布式为___________ 。
②第一电离能:Si___________ (填“>”“<”或“=”)C。
③ 和
和 的组成元素相同,但二者的性质不完全相同,其原因为
的组成元素相同,但二者的性质不完全相同,其原因为___________ 。
④常温下, 与少量
与少量 溶液反应的化学方程式为
溶液反应的化学方程式为___________ 。
(3)反应Ⅲ的离子方程式为___________ (已知: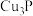 不溶于水)。
不溶于水)。
(1)白磷(结构如图所示)在潮湿的空气中发生缓慢氧化,在40℃左右即可自燃。

①白磷(
 )的相对分子质量为
)的相对分子质量为②基态P原子中成对电子数与未成对电子数之比为
③基态P原子中能量最高的电子所占据原子轨道的电子云轮廓图为
(2)磷及其部分重要化合物的相互转化如图所示。

①基态钙原子的简化电子排布式为
②第一电离能:Si
③
 和
和 的组成元素相同,但二者的性质不完全相同,其原因为
的组成元素相同,但二者的性质不完全相同,其原因为④常温下,
 与少量
与少量 溶液反应的化学方程式为
溶液反应的化学方程式为(3)反应Ⅲ的离子方程式为
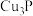 不溶于水)。
不溶于水)。
您最近一年使用:0次
解题方法
3 . 氮、氟及其化合物在生产及生活中有着广泛的用途。请回答下列问题:
(1)氟磷灰石可用于制取磷肥,基态P原子有_______________ 个未成对电子, 的中心P原子的杂化方式为
的中心P原子的杂化方式为____________________ 。
(2)氟气可以用于制取惰性强于 的保护气
的保护气 ,也可以用于制取聚合反应的催化剂
,也可以用于制取聚合反应的催化剂 ,
, 可以作为工业制取硅单质的中间物质
可以作为工业制取硅单质的中间物质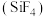 的原料。S、P、
的原料。S、P、 的第一电离能由大到小的顺序为
的第一电离能由大到小的顺序为_________________ 。
(3)键角比较:
___________  (填“>”或“<”)。
(填“>”或“<”)。
(1)氟磷灰石可用于制取磷肥,基态P原子有
 的中心P原子的杂化方式为
的中心P原子的杂化方式为(2)氟气可以用于制取惰性强于
 的保护气
的保护气 ,也可以用于制取聚合反应的催化剂
,也可以用于制取聚合反应的催化剂 ,
, 可以作为工业制取硅单质的中间物质
可以作为工业制取硅单质的中间物质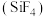 的原料。S、P、
的原料。S、P、 的第一电离能由大到小的顺序为
的第一电离能由大到小的顺序为(3)键角比较:

 (填“>”或“<”)。
(填“>”或“<”)。
您最近一年使用:0次
名校
解题方法
4 . 氮元素及其化合物在研究和生产中有许多重要用途。请回答下列问题:
(1)基态氮原子的核外共有_________ 种不同运动状态的电子,氮元素的第一电离能在同周期中从大到小排第_________ 位。
(2)已知NH3分子的键角约为107°,而PH3分子的键角约为94°,试用价层电子对互斥理论解释NH3的键角比PH3的键角大的原因:______________
(3)乙二胺(H2N—CH2—CH2—NH2)分子中氮原子轨道的杂化类型为_________ ,乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高很多,原因是___________ 。
(1)基态氮原子的核外共有
(2)已知NH3分子的键角约为107°,而PH3分子的键角约为94°,试用价层电子对互斥理论解释NH3的键角比PH3的键角大的原因:
(3)乙二胺(H2N—CH2—CH2—NH2)分子中氮原子轨道的杂化类型为
您最近一年使用:0次
5 . 铁、铬、锰统称为黑色金属,它们的单质、合金及其化合物在科研和生产中有着重要用途。请回答下列问题:
(1)铁位于周期表中___________ 族,铬的基态电子排布式为___________ 。
(2)基态铁、铬、锰原子中第一电离能较大的是___________ (填元素符号),原因为:___________ 。
(3)MnF2和MnCl2均为离子化合物,MnF2的熔点高于MnCl2熔点的原因为___________ 。
(4)化学式为CrC13·6H2O的化合物有三种结构,一种呈紫罗兰色,一种呈暗绿色,一种呈亮绿色,已知Cr3+的配位数均为6,将它们配制成等体积等浓度的溶液,分别加入足量AgNO3溶液,所得AgCl沉淀的物质的量之比为3:2:1。呈暗绿色的配合物的化学式为___________ 。
(1)铁位于周期表中
(2)基态铁、铬、锰原子中第一电离能较大的是
(3)MnF2和MnCl2均为离子化合物,MnF2的熔点高于MnCl2熔点的原因为
(4)化学式为CrC13·6H2O的化合物有三种结构,一种呈紫罗兰色,一种呈暗绿色,一种呈亮绿色,已知Cr3+的配位数均为6,将它们配制成等体积等浓度的溶液,分别加入足量AgNO3溶液,所得AgCl沉淀的物质的量之比为3:2:1。呈暗绿色的配合物的化学式为
您最近一年使用:0次
名校
6 . 铁及其化合物在国民生产、生活中用途广泛。
(1)向 溶液中加入少量的KSCN溶液,生成红色的
溶液中加入少量的KSCN溶液,生成红色的 。N、C、O元素的第一电离能由大到小的顺序为
。N、C、O元素的第一电离能由大到小的顺序为_______ ,O、N、C、H四种元素电负性最大的是_______ (填元素符号)。
(2) 与
与 溶液混合生成
溶液混合生成 沉淀。配体
沉淀。配体 中C原子的杂化方式为
中C原子的杂化方式为_______ , 分子中
分子中 键与
键与 键的数目之比为
键的数目之比为_______ 。
(3)用邻二氮菲(phen,结构为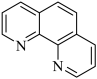 )与琥珀酸亚铁生成稳定的橙色配合物,可测定
)与琥珀酸亚铁生成稳定的橙色配合物,可测定 的浓度,发生反应:
的浓度,发生反应: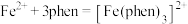 。
。
① 中,存在的化学键有
中,存在的化学键有_______ (填字母)。
a.配位键 b.离子键 c. 键 d.氢键
键 d.氢键
②用邻二氮菲测定 浓度时应控制pH为2~9的适宜范围,请解释原因:
浓度时应控制pH为2~9的适宜范围,请解释原因:_______ 。
(1)向
 溶液中加入少量的KSCN溶液,生成红色的
溶液中加入少量的KSCN溶液,生成红色的 。N、C、O元素的第一电离能由大到小的顺序为
。N、C、O元素的第一电离能由大到小的顺序为(2)
 与
与 溶液混合生成
溶液混合生成 沉淀。配体
沉淀。配体 中C原子的杂化方式为
中C原子的杂化方式为 分子中
分子中 键与
键与 键的数目之比为
键的数目之比为(3)用邻二氮菲(phen,结构为
 )与琥珀酸亚铁生成稳定的橙色配合物,可测定
)与琥珀酸亚铁生成稳定的橙色配合物,可测定 的浓度,发生反应:
的浓度,发生反应: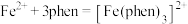 。
。①
 中,存在的化学键有
中,存在的化学键有a.配位键 b.离子键 c.
 键 d.氢键
键 d.氢键②用邻二氮菲测定
 浓度时应控制pH为2~9的适宜范围,请解释原因:
浓度时应控制pH为2~9的适宜范围,请解释原因:
您最近一年使用:0次
7 . 氟及其化合物的用途十分广泛。回答下列问题:
(1)CuF的熔点为1008℃,熔化呈液态时能导电。CuCl的熔点为326℃,能升华,熔化呈液态时不导电。
①CuF的熔点比CuCl的高,原因是_______ 。
②已知Cu、Zn的第二电离能分别为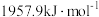 、
、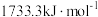 ,前者高于后者的原因是
,前者高于后者的原因是_______ 。
(2)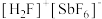 (氟锑酸,是一种超强酸),其中阳离子
(氟锑酸,是一种超强酸),其中阳离子 的空间构型为
的空间构型为_______ 。
(1)CuF的熔点为1008℃,熔化呈液态时能导电。CuCl的熔点为326℃,能升华,熔化呈液态时不导电。
①CuF的熔点比CuCl的高,原因是
②已知Cu、Zn的第二电离能分别为
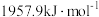 、
、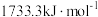 ,前者高于后者的原因是
,前者高于后者的原因是(2)
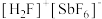 (氟锑酸,是一种超强酸),其中阳离子
(氟锑酸,是一种超强酸),其中阳离子 的空间构型为
的空间构型为
您最近一年使用:0次
名校
8 . 2020年11月7日是被誉为“中国稀土之父”的徐光宪院士诞辰100周年纪念日,社会各界举行了各式各样的纪念活动。已知钪(Sc)是17种稀土元素之一,钪单质及其化合物用途广泛。请回答下列问题:
(1)与Sc同周期且其基态原子的未成对电子数与Sc原子相同的元素有___________ 种。
(2)元素呈气态时,从它的阳离子中将一个电子移至无穷远处时所需做的功,称为该元素的电离势,单位为电子伏特(ev)。Sc的三种气态离子Sc+、Sc2+、Sc3+的电离势分别为6.54ev、12.80ev、24.76ev,上述三种气态离子的电离势依次增大的原因为___________ 。
(3)我国科学家首次合成并晶体结构表征了稀土金属末端氮宾配合物-钪末端氮宾配合物,该配合物的分子结构如图所示。

①该配合物分子中碳原子的杂化方式为___________ ;与Sc原子形成配位键的N原子个数为___________ 。
②该配合物中各元素第一电离能从大到小的顺序为___________ 。
(1)与Sc同周期且其基态原子的未成对电子数与Sc原子相同的元素有
(2)元素呈气态时,从它的阳离子中将一个电子移至无穷远处时所需做的功,称为该元素的电离势,单位为电子伏特(ev)。Sc的三种气态离子Sc+、Sc2+、Sc3+的电离势分别为6.54ev、12.80ev、24.76ev,上述三种气态离子的电离势依次增大的原因为
(3)我国科学家首次合成并晶体结构表征了稀土金属末端氮宾配合物-钪末端氮宾配合物,该配合物的分子结构如图所示。

①该配合物分子中碳原子的杂化方式为
②该配合物中各元素第一电离能从大到小的顺序为
您最近一年使用:0次
2021-05-30更新
|
265次组卷
|
2卷引用:河北省正中实验中学2020-2021学年高二第二学期第一次月考化学试题
2021高三·全国·专题练习
9 . 回答下列问题
(1)Ni是元素周期表中第28号元素,第二周期基态原子未成对电子数与Ni相同且电负性小的元素是___________ ;26号元素价层电子排布式为___________ ;L原子核外电子占有9个轨道,而且有一个未成对电子,L是___________ 元素。
(2)硒(Se)是一种有抗癌、抗氧化作用的元素,可以形成多种化合物。
①基态硒原子的价层电子排布式为___________ 。
②锗、砷、硒三种元素的第一电离能大小排序为___________ 。
(3)①Cu元素基态原子的价层电子排布式为___________ 。
②下列说法正确的是___________ (填字母)。
A.第一电离能:As>Ga
B.电负性:As>Ga
C.原子半径:As>Ga
③锗(Ge)是用途很广的半导体材料,基态锗原子的价层电子排布式为___________ 。在第二周期中,第一电离能位于硼元素与氮元素之间的元素有___________ 种。
④硼(B)及其化合物在化学中有重要的地位。Ga与B同主族,Ga的基态原子的核外电子排布式为___________ ,B、C、O三种元素的第一电离能由大到小的顺序是___________ 。
(4)已知X、Y和Z三种元素的原子序数之和等于42.X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X与Y可形成化合物X2Y3,Z元素可以形成负一价离子。
①X元素基态原子的电子排布式为___________ ,该元素的化学符号是___________ 。
②Y元素原子的价层电子排布图为___________ ,该元素的名称是___________ 。
③已知化合物X2Y3在稀硫酸中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是___________ 。
(1)Ni是元素周期表中第28号元素,第二周期基态原子未成对电子数与Ni相同且电负性小的元素是
(2)硒(Se)是一种有抗癌、抗氧化作用的元素,可以形成多种化合物。
①基态硒原子的价层电子排布式为
②锗、砷、硒三种元素的第一电离能大小排序为
(3)①Cu元素基态原子的价层电子排布式为
②下列说法正确的是
A.第一电离能:As>Ga
B.电负性:As>Ga
C.原子半径:As>Ga
③锗(Ge)是用途很广的半导体材料,基态锗原子的价层电子排布式为
④硼(B)及其化合物在化学中有重要的地位。Ga与B同主族,Ga的基态原子的核外电子排布式为
(4)已知X、Y和Z三种元素的原子序数之和等于42.X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X与Y可形成化合物X2Y3,Z元素可以形成负一价离子。
①X元素基态原子的电子排布式为
②Y元素原子的价层电子排布图为
③已知化合物X2Y3在稀硫酸中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是
您最近一年使用:0次
名校
解题方法
10 . 第四周期中的18 种元素具有重要的用途,在现代工业中备受青睐。
(1)其中,未成对电子数最多的元素名称为_______ ,该元素的基态原子中,电子占据的最高能层具有的原子轨道数为_______ 。
(2)第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的,30Zn与31Ga的第一电离能不符合这一规律原因是_______ 。
(3)AsH3 中心原子杂化的类型为_______ ,分子构型为_______
(4)过渡元素铁可形成多种配合物,如:[Fe(CN)6]4-、Fe(SCN)3等。基态铁原子核外的价电子排布图为_______ 。
(5)与CN-互为等电子体的一种分子为_______ (填化学式);1.5mol [Fe(CN)6]3-中含有键的数目为_______
(1)其中,未成对电子数最多的元素名称为
(2)第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的,30Zn与31Ga的第一电离能不符合这一规律原因是
(3)AsH3 中心原子杂化的类型为
(4)过渡元素铁可形成多种配合物,如:[Fe(CN)6]4-、Fe(SCN)3等。基态铁原子核外的价电子排布图为
(5)与CN-互为等电子体的一种分子为
您最近一年使用:0次
2021-05-29更新
|
112次组卷
|
2卷引用:黑龙江省齐齐哈尔市第八中学校2020-2021学年高二下学期期中考试化学试题



