河北省正中实验中学2020-2021学年高二第二学期第一次月考化学试题
河北
高二
阶段练习
2021-05-30
195次
整体难度:
容易
考查范围:
物质结构与性质、有机化学基础、常见无机物及其应用
河北省正中实验中学2020-2021学年高二第二学期第一次月考化学试题
河北
高二
阶段练习
2021-05-30
195次
整体难度:
容易
考查范围:
物质结构与性质、有机化学基础、常见无机物及其应用
一、单选题 添加题型下试题
单选题
|
容易(0.94)
您最近一年使用:0次
单选题
|
适中(0.65)
3. 下列基态原子或离子的相关电子排布图正确的是
A.Fe3+的价电子: |
B.Cr原子的价电子: |
C.N原子的核外电子: |
D.S2-的L层电子: |
【知识点】 核外电子排布的表示形式
您最近一年使用:0次
单选题
|
适中(0.65)
解题方法
4. 短周期主族元素W、X、Y、Z的原子序数依次增大,W、Z同周期且基态原子均含有2个未成对电子。Z的单质常温下为气体且价电子数和:W+X=Y+Z,下列有关说法正确的是
| A.简单离子半径:X<Y |
| B.最高正价:X>W |
| C.Y与Z形成的化合物为非电解质 |
| D.W、Z形成的二元化合物中可能同时含有σ键和π键 |
您最近一年使用:0次
单选题
|
适中(0.65)
5. 下列关于卤族元素单质及其化合物的结构与性质说法错误的是
| A.相对分子质量:CH2Cl2>CH3Cl,因此熔沸点:CH2Cl2>CH3Cl |
| B.键长H-Br>H-Cl,因此稳定性:HCl>HBr |
| C.单质氧化性F2>Cl2,因此F2可氧化水溶液中的Cl- |
| D.非金属性:Cl>Br,因此含氧酸酸性:HClO4>HBrO4 |
您最近一年使用:0次
单选题
|
适中(0.65)
6. 下列关于物质结构和性质的说法正确的是
A.BF3中的键角大于BF 的键角 的键角 |
| B.CH3CN中σ键和π键的数目之比为4:3 |
| C.含氧酸酸性:HClO>HClO2 |
| D.CH3OH易溶于水的原因仅仅是因为CH3OH和水分子都是极性分子 |
【知识点】 分子的性质 氢键对物质性质的影响解读
您最近一年使用:0次
2021-05-28更新
|
105次组卷
|
2卷引用:河北省正中实验中学2020-2021学年高二第二学期第一次月考化学试题
单选题
|
适中(0.65)
解题方法
7. 反应SiHCl3(g)+H2(g)=Si(s)+3HCl(g)可用于纯硅的制备,下列说法正确的是
| A.SiHCl3中Si原子的杂化方式为sp2杂化 |
| B.SiHCl3中Si元素的化合价为+2 |
| C.键长:Si-Si>C-C,故键能:Si-Si<C-C |
| D.HCl易溶于水是因为HCl和水分子之间能形成氢键 |
您最近一年使用:0次
单选题
|
适中(0.65)
8. 已知X、Y元素同周期,且电负性X大于Y,下列说法一定错误的是
| A.第一电离能:Y大于X |
| B.气态氢化物的稳定性:Y大于X |
| C.最高价含氧酸的酸性:X强于Y |
| D.X和Y形成化合物时,X显负价,Y显正价 |
您最近一年使用:0次
单选题
|
较易(0.85)
9. 已知HF沸点为19.5℃,BF3沸点为-100℃,HF+BF3=HBF4,下列有关说法错误的是
| A.HBF4中B原子为sp3杂化 |
| B.BF3和HBF4分子中B最外层均为8e-稳定结构 |
| C.HBF4中存在配位键 |
| D.HF沸点高于BF3沸点的原因可能为HF分子之间存在氢键 |
您最近一年使用:0次
单选题
|
较易(0.85)
您最近一年使用:0次
单选题
|
适中(0.65)
11. 元素的基态气态原子得到一个电子形成气态-1价离子时所放出的能量称作第一电子亲和能(E),-1价阴离子再获得一个电子的能量变化叫做第二电子亲和能,部分元素或离子的电子亲和能数据如表所示。
下列说法错误的是
| 元素 | Cl | Br | I | O | O- |
| 电子亲和能(kJ/mol) | 349 | 343 | 295 | 141 | -780 |
| A.电子亲和能越大,说明越易得到电子 |
| B.一个基态的气态氧原子得到一个电子成为O2-时吸收-141kJ的能量 |
| C.氧元素的第二电子亲和能是-780kJ/mol |
| D.基态的气态氧原子得到两个电子成为O2-需要吸收能量 |
【知识点】 元素周期律、元素周期表的推断
您最近一年使用:0次
单选题
|
较易(0.85)
名校
解题方法
12. 下列各项叙述中,正确的是
| A.配合物Fe(CO)n内中心原子价电子数与配体提供电子总数之和为18,则n=6 |
| B.价电子排布为ns1的元素,不一定是s区元素 |
| C.水中的氢键可以表示为O-H…O,每摩尔冰中有4NA个氢键 |
| D.与基态钾原子同周期且未成对电子数相同的元素还有4种 |
您最近一年使用:0次
2021-05-28更新
|
196次组卷
|
9卷引用:山东省泰安市2021届高考第一次模拟化学试题
山东省泰安市2021届高考第一次模拟化学试题黑龙江省哈尔滨市第六中学2020-2021学年高二4月月考化学试题(已下线)押山东卷第04题 物质结构与性质选择题-备战2021年高考化学临考题号押题(山东卷)河北省正中实验中学2020-2021学年高二第二学期第一次月考化学试题山东省泰安市宁阳一中2020-2021学年高二下学期期中考试化学试题山东省临沂市第一中学2020-2021学年高二下学期6月月考化学试题(已下线)作业09 配合物与超分子-2021年高二化学暑假作业(人教版2019)(已下线)专题13 物质结构与性质基础-备战2022年高考化学真题及地市好题专项集训【山东专用】辽宁省沈阳市第二中学2022-2023学年高三10月月考化学试题
单选题
|
适中(0.65)
13. 正氰酸(H-O-C≡N)与异氰酸(H-N=C=O)、雷酸(H-O-N≡C)互为同分异构体,均可以与氨水形成相应铵盐。下列说法错误的是
| A.三种酸的分子均能形成分子间氢键 |
| B.三种酸的分子中,氧原子的杂化方式相同 |
| C.三种酸的组成元素中,氧的电负性最大 |
| D.三种酸的铵盐中,只有雷酸铵的阴、阳离子均含有配位键 |
您最近一年使用:0次
单选题
|
适中(0.65)
名校
14. 下列关于物质结构与性质的说法,正确的是
| A.玻尔原子结构模型能够成功地解释各种原子光谱 |
| B.As、S、F三种元素的电负性大小顺序为S>As>F |
| C.Na的第一电离能小于Mg,但其第二电离能却远大于Mg的第二电离能 |
| D.水分子间存在氢键,故H2O的熔沸点及稳定性均大于H2S |
【知识点】 电离能变化规律解读 分子的性质 氢键对物质性质的影响解读
您最近一年使用:0次
2021-05-28更新
|
181次组卷
|
3卷引用:河北省正中实验中学2020-2021学年高二第二学期第一次月考化学试题
单选题
|
适中(0.65)
15. 呋喃是最简单的含氧五元杂环化合物(其分子为平面型分子且含有大π键),有麻醉和弱刺激作用,极度易燃。下列关于呋喃的有关说法正确的是


| A.易溶于水和丙酮等有机溶剂 |
B.含有的大π键可表示为π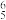 |
| C.一氯代物有2种,二氯代物有3种(不考虑立体异构) |
| D.生成1molC4H10O需标准状况下氢气44.8L |
【知识点】 有机化合物中碳的成键特征 同分异构体的数目的确定解读
您最近一年使用:0次
二、解答题 添加题型下试题
解答题-结构与性质
|
适中(0.65)
解题方法
16. 钴常见的化合价为+2、+3,钴及其化合物在工业上具有重要的用途。请回答下列问题:
(1)钴在元素周期表中属于___________ 区元素,与钴同周期且基态原子与基态钴原子具有相同未成对电子数的元素是___________ (填元素符号)。
(2)基态Co3+和基态Fe2+分别失去一个电子所需能量较高的是___________ (填离子符号),原因为___________ 。
(3)三氯化六氨合钴(III)是橙黄色单斜晶体,其可以通过如下反应制备:2CoCl2+10NH3+2NH4Cl+H2O2=2[Co(NH3)6]Cl3+2H2O
①H2O2中O原子的杂化方式为___________ 。
②NH3中的H-N-H的键角___________ (填“大于”或“小于”)NH 中H-N-H的键角
中H-N-H的键角
③[Co(NH3)6]Cl3中存在的作用力类型有___________ (填字母)。
A.配位键 B.极性键 C.离子键 D.非极性键 E.金属键
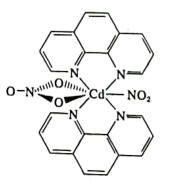
(4)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种Cd2+配合物的结构如图所示,1mol该配合物中通过螯合作用形成的配位键有___________ mol,该螯合物中N的杂化方式有___________ 种。
(1)钴在元素周期表中属于
(2)基态Co3+和基态Fe2+分别失去一个电子所需能量较高的是
(3)三氯化六氨合钴(III)是橙黄色单斜晶体,其可以通过如下反应制备:2CoCl2+10NH3+2NH4Cl+H2O2=2[Co(NH3)6]Cl3+2H2O
①H2O2中O原子的杂化方式为
②NH3中的H-N-H的键角
 中H-N-H的键角
中H-N-H的键角③[Co(NH3)6]Cl3中存在的作用力类型有
A.配位键 B.极性键 C.离子键 D.非极性键 E.金属键
(4)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种Cd2+配合物的结构如图所示,1mol该配合物中通过螯合作用形成的配位键有

您最近一年使用:0次
三、填空题 添加题型下试题
填空题
|
适中(0.65)
解题方法
17. 中医认为:“肺主秋,肺收敛,急食酸以收之,用酸补之,辛泄之”。就是说秋天是“收”的季节,吃酸味的食物可以起到收敛肺气的作用。醋酸、酒石酸、维生素C均是食物中常见的酸性物质。请回答下列问题:
(1)醋酸可以与食物中以不溶性状态存在的钙元素生成可溶性的(CH3COO)2Ca,Ca2+的核外电子排布式为___________ ,钙元素焰色反应的焰色为___________ (填标号)。
A.黄色 B.红色 C.紫色 D.绿色。
(2)酒石酸是二元弱酸,结构简式为 ,请从结构与性质的关系解释其第一步电离程度大于第二步电离程度的原因:
,请从结构与性质的关系解释其第一步电离程度大于第二步电离程度的原因:___________ 。
(3)维生素的结构简式为 ,其中氧原子的杂化方式为
,其中氧原子的杂化方式为___________ 。维生素C易溶于水的主要原因为___________ 。
(4)醋酸铵可用作分析试剂、肉类防腐剂、医药工业,常用来测定醋酸铵官能团类别的仪器名称为___________ ,与NH 互为等电子体的分子的化学式为
互为等电子体的分子的化学式为___________ (写一种)。
(1)醋酸可以与食物中以不溶性状态存在的钙元素生成可溶性的(CH3COO)2Ca,Ca2+的核外电子排布式为
A.黄色 B.红色 C.紫色 D.绿色。
(2)酒石酸是二元弱酸,结构简式为
 ,请从结构与性质的关系解释其第一步电离程度大于第二步电离程度的原因:
,请从结构与性质的关系解释其第一步电离程度大于第二步电离程度的原因:(3)维生素的结构简式为
 ,其中氧原子的杂化方式为
,其中氧原子的杂化方式为(4)醋酸铵可用作分析试剂、肉类防腐剂、医药工业,常用来测定醋酸铵官能团类别的仪器名称为
 互为等电子体的分子的化学式为
互为等电子体的分子的化学式为
您最近一年使用:0次
填空题
|
适中(0.65)
名校
18. 2020年11月7日是被誉为“中国稀土之父”的徐光宪院士诞辰100周年纪念日,社会各界举行了各式各样的纪念活动。已知钪(Sc)是17种稀土元素之一,钪单质及其化合物用途广泛。请回答下列问题:
(1)与Sc同周期且其基态原子的未成对电子数与Sc原子相同的元素有___________ 种。
(2)元素呈气态时,从它的阳离子中将一个电子移至无穷远处时所需做的功,称为该元素的电离势,单位为电子伏特(ev)。Sc的三种气态离子Sc+、Sc2+、Sc3+的电离势分别为6.54ev、12.80ev、24.76ev,上述三种气态离子的电离势依次增大的原因为___________ 。
(3)我国科学家首次合成并晶体结构表征了稀土金属末端氮宾配合物-钪末端氮宾配合物,该配合物的分子结构如图所示。

①该配合物分子中碳原子的杂化方式为___________ ;与Sc原子形成配位键的N原子个数为___________ 。
②该配合物中各元素第一电离能从大到小的顺序为___________ 。
(1)与Sc同周期且其基态原子的未成对电子数与Sc原子相同的元素有
(2)元素呈气态时,从它的阳离子中将一个电子移至无穷远处时所需做的功,称为该元素的电离势,单位为电子伏特(ev)。Sc的三种气态离子Sc+、Sc2+、Sc3+的电离势分别为6.54ev、12.80ev、24.76ev,上述三种气态离子的电离势依次增大的原因为
(3)我国科学家首次合成并晶体结构表征了稀土金属末端氮宾配合物-钪末端氮宾配合物,该配合物的分子结构如图所示。

①该配合物分子中碳原子的杂化方式为
②该配合物中各元素第一电离能从大到小的顺序为
您最近一年使用:0次
2021-05-30更新
|
264次组卷
|
2卷引用:河北省正中实验中学2020-2021学年高二第二学期第一次月考化学试题
填空题
|
较易(0.85)
19. 铁及其化合物用途广泛,比如铁元素是人体必需的微量元素,成人体内约有4-5克铁,其中72%以血红蛋白形式存在。请回答下列问题:
(1)基态Fe原子占据最高能层的电子的电子云轮廓图为___________ ,基态Fe3+原子的价电子排布图为___________ 。
(2)FeCl3中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的FeCl3的结构式为___________ ,其中Fe的配位数为___________ 。
(3)由铁粉与环戊二烯( )在300℃的氮气氛中加热可以制得二茂铁(
)在300℃的氮气氛中加热可以制得二茂铁( ),已知环戊二烯负离子(C5H
),已知环戊二烯负离子(C5H )中所有C原子均共平面,分子中的大π键可用符号π
)中所有C原子均共平面,分子中的大π键可用符号π 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为π
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为π ),则环戊二烯负离子中的大π键可表示为
),则环戊二烯负离子中的大π键可表示为___________ 。
(1)基态Fe原子占据最高能层的电子的电子云轮廓图为
(2)FeCl3中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的FeCl3的结构式为
(3)由铁粉与环戊二烯(
 )在300℃的氮气氛中加热可以制得二茂铁(
)在300℃的氮气氛中加热可以制得二茂铁( ),已知环戊二烯负离子(C5H
),已知环戊二烯负离子(C5H )中所有C原子均共平面,分子中的大π键可用符号π
)中所有C原子均共平面,分子中的大π键可用符号π 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为π
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为π ),则环戊二烯负离子中的大π键可表示为
),则环戊二烯负离子中的大π键可表示为
您最近一年使用:0次
填空题
|
较易(0.85)
20. 镓、硅、锗、硒的单质及某些化合物如砷化镓、磷化镓等都是常用的半导体材料。
(1)基态锗原子的电子排布式为___________ 。其属于元素周期表中的___________ 区元素。
(2)锗、砷、硒三种元素的第一电离能由大到小的顺序为___________ ,As与Cl能形成AsCl3和AsCl5两种化合物,但N与Cl只能形成NCl3一种化合物的原因为___________ 。
(3)硅能与氢元素形成丁硅烯(Si4H8),该分子中σ键与π键个数之比___________ 。
(4)GaCl3分子中Ga原子的杂化轨道类型为___________ ,GeCl4分子的空间构型为___________ 。与GeCl4互为等电子体的离子为___________ (写2种,写化学式)。
(1)基态锗原子的电子排布式为
(2)锗、砷、硒三种元素的第一电离能由大到小的顺序为
(3)硅能与氢元素形成丁硅烯(Si4H8),该分子中σ键与π键个数之比
(4)GaCl3分子中Ga原子的杂化轨道类型为
您最近一年使用:0次
试卷分析
整体难度:适中
考查范围:物质结构与性质、有机化学基础、常见无机物及其应用
试卷题型(共 20题)
题型
数量
单选题
15
解答题
1
填空题
4
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.94 | 杂化轨道理论 | |
| 2 | 0.94 | 对角线规律 | |
| 3 | 0.65 | 核外电子排布的表示形式 | |
| 4 | 0.65 | 元素周期律、元素周期表的推断 根据原子结构进行元素种类推断 根据物质性质进行元素种类推断 | |
| 5 | 0.65 | 同主族元素性质递变规律 同主族元素性质递变规律理解及应用 元素非金属性强弱的比较方法 | |
| 6 | 0.65 | 分子的性质 氢键对物质性质的影响 | |
| 7 | 0.65 | 元素性质与电负性的关系 键能、键长、键角及应用 利用杂化轨道理论判断化学键杂化类型 相似相溶原理及应用 | |
| 8 | 0.65 | 元素周期律、元素周期表的推断 元素金属性与非金属性递变规律的理解及应用 由元素性质的递变规律进行相关推断 | |
| 9 | 0.85 | 利用杂化轨道理论判断化学键杂化类型 氢键对物质性质的影响 | |
| 10 | 0.85 | 价层电子对数的确定 | |
| 11 | 0.65 | 元素周期律、元素周期表的推断 | |
| 12 | 0.85 | 电子排布式 简单配合物的成键 含有氢键的物质 | |
| 13 | 0.65 | 元素性质与电负性的关系 利用杂化轨道理论判断化学键杂化类型 简单配合物的成键 氢键对物质性质的影响 | |
| 14 | 0.65 | 电离能变化规律 分子的性质 氢键对物质性质的影响 | |
| 15 | 0.65 | 有机化合物中碳的成键特征 同分异构体的数目的确定 | |
| 二、解答题 | |||
| 16 | 0.65 | 电离能变化规律 键能、键长、键角及应用 利用杂化轨道理论判断化学键杂化类型 简单配合物的成键 | 结构与性质 |
| 三、填空题 | |||
| 17 | 0.65 | 焰色试验 含有酚羟基的物质性质的推断 等电子原理的应用 利用杂化轨道理论判断化学键杂化类型 | |
| 18 | 0.65 | 物质结构与性质综合考查 电离能变化规律 利用杂化轨道理论判断化学键杂化类型 | |
| 19 | 0.85 | 电子排布式 配合物的结构与性质 | |
| 20 | 0.85 | 电离能变化规律 元素性质与电负性的关系 利用杂化轨道理论判断化学键杂化类型 | |



