名校
1 . 合成氨是人类科学技术发展史上的一项重大成就:催化剂,高温高压条件下: +
+ ⇌
⇌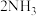
目前合成氨工业中使用的催化剂铁触媒中主要成分为Fe3O4(Fe2O3和FeO),还含有少量的K2O、Al2O3、CuO、TiO2、Cr2O3等。回答问题:
(1)基态N原子中,有___________ 种空间运动状态不同的电子。
(2)与 同族且相邻周期的元素
同族且相邻周期的元素 的基态原子价电子排布式为
的基态原子价电子排布式为___________ 。与钛同周期元素的基态原子中,未成对电子数与钛相同的元素有___________ 种。
(3)24Cr基态原子中未成对电子的自旋状态相同,则两种自旋状态的电子数之比为___________
(4)分析Cu、Zn的核外电子排布,推测Cu的第二电离能I2___________ Zn的第二电离能I2.(填写“大于”“小于”或“等于”)
(5)H+可与NH3形成NH 。NH
。NH 中H—N—H键角比NH3中H—N—H键角大,原因是
中H—N—H键角比NH3中H—N—H键角大,原因是___________ 。预测NH3中H—N—H键角___________ NF3中F—N—F键角(填写“大于”“小于”或“等于”)
(6)邻二氮菲( )分子中N杂化方式为
)分子中N杂化方式为___________ 。
 +
+ ⇌
⇌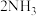
目前合成氨工业中使用的催化剂铁触媒中主要成分为Fe3O4(Fe2O3和FeO),还含有少量的K2O、Al2O3、CuO、TiO2、Cr2O3等。回答问题:
(1)基态N原子中,有
(2)与
 同族且相邻周期的元素
同族且相邻周期的元素 的基态原子价电子排布式为
的基态原子价电子排布式为(3)24Cr基态原子中未成对电子的自旋状态相同,则两种自旋状态的电子数之比为
(4)分析Cu、Zn的核外电子排布,推测Cu的第二电离能I2
(5)H+可与NH3形成NH
 。NH
。NH 中H—N—H键角比NH3中H—N—H键角大,原因是
中H—N—H键角比NH3中H—N—H键角大,原因是(6)邻二氮菲(
 )分子中N杂化方式为
)分子中N杂化方式为
您最近一年使用:0次
2 . 北宋卷轴画《千里江山图》,颜色绚丽,由石绿、雌黄、赭石、阵磲、朱砂等颜料绘制而成,颜料中含有硫、砷、铜、锌、钛、铁等元素。
(1)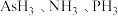 热稳定性由大到小的顺序为
热稳定性由大到小的顺序为_____ 。
(2) 属于元素周期表中的
属于元素周期表中的_____ 区;基态 原子的电子排布式为
原子的电子排布式为_____ ;基态硫原子核外电子的空间运动状态有_____ 种;基态 的价层电子的轨道表示式为
的价层电子的轨道表示式为_____ 。
(3) 的第二电离能
的第二电离能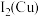
_____  的第二电离能
的第二电离能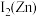 (填“>”或“<”),理由为
(填“>”或“<”),理由为_____ 。
(1)
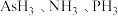 热稳定性由大到小的顺序为
热稳定性由大到小的顺序为(2)
 属于元素周期表中的
属于元素周期表中的 原子的电子排布式为
原子的电子排布式为 的价层电子的轨道表示式为
的价层电子的轨道表示式为(3)
 的第二电离能
的第二电离能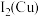
 的第二电离能
的第二电离能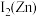 (填“>”或“<”),理由为
(填“>”或“<”),理由为
您最近一年使用:0次
3 . 按要求解答下列各题。
(1)黄铜是人类最早使用的合金之一,主要由 和
和 组成。基态
组成。基态 原子的核外价层电子排布图为
原子的核外价层电子排布图为_______ ;第二电离能
_______ (填“<”“>”或“=”)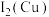 。
。
(2) 和
和 中
中 之间以双键结合,
之间以双键结合, 之间以单键结合。请你预测
之间以单键结合。请你预测 和
和 分子的空间结构为
分子的空间结构为_______ 。 分子中
分子中
_______  分子中
分子中 (选填“<”“>”或“=”)。
(选填“<”“>”或“=”)。
(3)甲醇的沸点(64.7℃)介于水和甲硫醇 ,其原因是
,其原因是_______ 。
(1)黄铜是人类最早使用的合金之一,主要由
 和
和 组成。基态
组成。基态 原子的核外价层电子排布图为
原子的核外价层电子排布图为
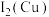 。
。(2)
 和
和 中
中 之间以双键结合,
之间以双键结合, 之间以单键结合。请你预测
之间以单键结合。请你预测 和
和 分子的空间结构为
分子的空间结构为 分子中
分子中
 分子中
分子中 (选填“<”“>”或“=”)。
(选填“<”“>”或“=”)。(3)甲醇的沸点(64.7℃)介于水和甲硫醇
 ,其原因是
,其原因是
您最近一年使用:0次
4 . Ti、Na、Mg、C、N、O、Fe等元素的研究一直在进行中,其单质及化合物在诸多领域都有广泛的应用。回答下列问题
(1)钠在火焰上灼烧的黄光是一种___________ (填字母)。
A.吸收光谱 B.发射光谱
钠元素原子核外最外层电子的排布图是___________ ;能量最高的电子有___________ 个,其电子云形状为___________ 。
(2)下列Mg原子的核外电子排布式中,能量最高的是___________ ,能量最低的是___________ (填序号)。
a. b.
b.
c.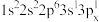 d.
d.
(3) 所含的化学键类型:
所含的化学键类型:___________ ;属于___________ 分子(填极性或非极性)
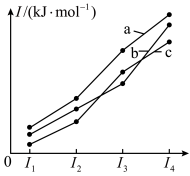
(4)磷及其化合物与人类生产、生活密切相关。如图表示碳、硅、磷元素的四级电离能(失去第四个电子)变化趋势,其中表示磷的曲线是___________ (填标号)。
(1)钠在火焰上灼烧的黄光是一种
A.吸收光谱 B.发射光谱
钠元素原子核外最外层电子的排布图是
(2)下列Mg原子的核外电子排布式中,能量最高的是
a.
 b.
b.
c.
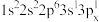 d.
d.
(3)
 所含的化学键类型:
所含的化学键类型:(4)磷及其化合物与人类生产、生活密切相关。如图表示碳、硅、磷元素的四级电离能(失去第四个电子)变化趋势,其中表示磷的曲线是

您最近一年使用:0次
5 . 填空
(1)基态铜原子价层电子排布图为______ ﹔已知Cu第一电离能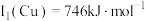 ,Fe第一电离能
,Fe第一电离能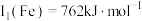 ,则
,则
______  (填“>”、“=”或“<”),其主要原因是
(填“>”、“=”或“<”),其主要原因是______ ;
(2) 和
和 的中心原子的杂化轨道类型分别为
的中心原子的杂化轨道类型分别为______ ,试判断 和
和 的键角大小关系:
的键角大小关系:
______  ,说明原因:
,说明原因:______
(3)比较 和
和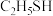 的酸性:
的酸性:
______ 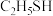 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(1)基态铜原子价层电子排布图为
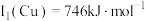 ,Fe第一电离能
,Fe第一电离能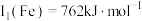 ,则
,则
 (填“>”、“=”或“<”),其主要原因是
(填“>”、“=”或“<”),其主要原因是(2)
 和
和 的中心原子的杂化轨道类型分别为
的中心原子的杂化轨道类型分别为 和
和 的键角大小关系:
的键角大小关系:
 ,说明原因:
,说明原因:(3)比较
 和
和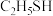 的酸性:
的酸性:
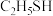 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
您最近一年使用:0次
2024-04-03更新
|
346次组卷
|
2卷引用:浙江省杭州市源清中学2023-2024学年高二上学期期末考试化学试题
6 . 回答下列问题
(1)①写出小苏打的化学式___________ ;
②写出Fe2+的价电子排布式___________ 。
(2)实验室用软锰矿和浓盐酸制氯气,写出该反应的化学方程式___________ 。
(3)在常温下,0.1mol/LCH3COONa溶液的pH=9,则溶液中由水电离出来的c(OH-)=___________
(4)火箭发射可以用肼(N2H4,液态)作燃料,NO2作氧化剂,两者反应生成N2和水蒸气。
已知:N2(g)+2O2(g)=2NO2(g) ΔH1=+66.4kJ/mol
N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH2=-534kJ/mol
请写出N2H4(l)与NO2反应的热化学方程式___________
(5)下表列出了某短周期元素R的各级电离能数据(用I1、I2……表示)。
关于元素R的下列推断中,正确的是___________ (用相应的编号填写)
①R元素基态原子的电子排布式为1s22s2
②R元素位于元素周期表中第ⅡA族
③R元素的最高正化合价为+2价
④R元素的第一电离能高于同周期相邻元素的第一电离能
(1)①写出小苏打的化学式
②写出Fe2+的价电子排布式
(2)实验室用软锰矿和浓盐酸制氯气,写出该反应的化学方程式
(3)在常温下,0.1mol/LCH3COONa溶液的pH=9,则溶液中由水电离出来的c(OH-)=
(4)火箭发射可以用肼(N2H4,液态)作燃料,NO2作氧化剂,两者反应生成N2和水蒸气。
已知:N2(g)+2O2(g)=2NO2(g) ΔH1=+66.4kJ/mol
N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH2=-534kJ/mol
请写出N2H4(l)与NO2反应的热化学方程式
(5)下表列出了某短周期元素R的各级电离能数据(用I1、I2……表示)。
| 元素 | 电离能/(kJ·mol-1) | |||||
| I1 | I2 | I3 | I4 | I5 | …… | |
| R | 740 | 1500 | 7700 | 10500 | 13630 | …… |
①R元素基态原子的电子排布式为1s22s2
②R元素位于元素周期表中第ⅡA族
③R元素的最高正化合价为+2价
④R元素的第一电离能高于同周期相邻元素的第一电离能
您最近一年使用:0次
名校
7 . 按要求完成下列小题。
(1)Cu2+基态核外电子排布式为_______ 。
(2)我国科研人员研制出了M-LiH(M为Fe、Mn等金属)等催化剂,使得合成氨工业的温度,压强分别降到了350℃、1MPa,这是近年来合成氨反应研究中的重要突破。
①基态Mn原子未成对的电子数为_______ 。
②第三电离能I3(Fe)<I3(Mn),原因是_______ 。
(3)膨大剂能在动物体内代谢,其产物较为复杂,其中有H2O、NH3、CO2等。
①请用共价键知识解释H2O分子比NH3分子稳定的原因为_______
②H2O分子的空间结构分别是_______ ,键角H2O_______ NH3。(填>、<或=)
(1)Cu2+基态核外电子排布式为
(2)我国科研人员研制出了M-LiH(M为Fe、Mn等金属)等催化剂,使得合成氨工业的温度,压强分别降到了350℃、1MPa,这是近年来合成氨反应研究中的重要突破。
①基态Mn原子未成对的电子数为
②第三电离能I3(Fe)<I3(Mn),原因是
(3)膨大剂能在动物体内代谢,其产物较为复杂,其中有H2O、NH3、CO2等。
①请用共价键知识解释H2O分子比NH3分子稳定的原因为
②H2O分子的空间结构分别是
您最近一年使用:0次
8 . 回答下列问题:
(1)下列原子或离子的电子排布式或轨道表示式正确的是___________ (填序号)
①K+: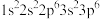
②Fe2+: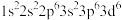
③P:
④O: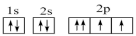
⑤Cu: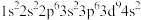
(2)基态原子的核外电子填充在6个轨道中的元素有___________ 种;
(3)C、N、O第一电离能从大到小的顺序为:___________ ;
(4)已知电负性H2.1、Si1.8,则SiH4中Si元素的化合价为___________ 。
(5)第四周期元素中,未成对电子数最多的元素是:___________ (写元素符号)。
(1)下列原子或离子的电子排布式或轨道表示式正确的是
①K+:
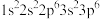
②Fe2+:
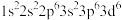
③P:

④O:
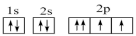
⑤Cu:
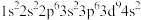
(2)基态原子的核外电子填充在6个轨道中的元素有
(3)C、N、O第一电离能从大到小的顺序为:
(4)已知电负性H2.1、Si1.8,则SiH4中Si元素的化合价为
(5)第四周期元素中,未成对电子数最多的元素是:
您最近一年使用:0次
名校
9 . 雾霾天气多次肆虐我国中东部地区,汽车尾气(含NO、NO2)和燃堞尾气(含SO2)是造成空气污染的原因之一。汽车尾气净化的主要原理为2NO(g)+2CO(g) 2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示,回答以下问题。
2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示,回答以下问题。_______ 。
(2)若反应中转移lmol电子,标况下消耗NO气体的体积_______ 。
(3)该反应的△H_______ 0(填“>”或“<”),△S____ 0(填“>”或“<”),是______ (填“高温自发”、“低温自发”或“不自发”)反应。
(4)在T1温度下,0~2s内的平均反应速率v(N2)=________ 。
(5)M点、N点的化学平衡常数:KM_______ KN(填“>”或“<”或“=”)
(6)能说明该反应达化学平衡状态的是_______ (不定项)。
(7)当催化剂质量一定时,若增大催化剂的表面积,则CO转化率_____ (填“增大”,“减少”或“不变”),并说明v正和v逆如何变化_____ ?
 2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示,回答以下问题。
2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示,回答以下问题。
(2)若反应中转移lmol电子,标况下消耗NO气体的体积
(3)该反应的△H
(4)在T1温度下,0~2s内的平均反应速率v(N2)=
(5)M点、N点的化学平衡常数:KM
(6)能说明该反应达化学平衡状态的是
| A.容器内气体的密度不再变化 | B.v正(CO2)=v逆(CO) |
| C.密闭容器内的压强不再变化 | D.K保持不变 |
(7)当催化剂质量一定时,若增大催化剂的表面积,则CO转化率
您最近一年使用:0次
2024-03-25更新
|
48次组卷
|
2卷引用:上海市奉贤中学2023-2024学年高二下学期第一次月考练习 化学试卷
名校
解题方法
10 . Ⅰ.硒化锌是一种透明半导体,也可作为红外光学材料,熔点是1520℃。
(1)基态锌原子的价电子排布式是_____ 。
(2)根据元素周期律,电负性Se_____ S,Se位于周期表_____ 区。
(3)H2Se的分子构型是_____ ,其中硒原子的杂化轨道类型是_____ 。
(4)H2O的沸点高于H2Se的沸点(-42℃),其原因是_____ 。
Ⅱ.氮及其化合物与人类生产、生活息息相关。回答下列问题:
(5)C、N、O三种元素第一电离能从大到小的顺序是_____ 。
(6)1molN2F2含有_____ molσ键。
(1)基态锌原子的价电子排布式是
(2)根据元素周期律,电负性Se
(3)H2Se的分子构型是
(4)H2O的沸点高于H2Se的沸点(-42℃),其原因是
Ⅱ.氮及其化合物与人类生产、生活息息相关。回答下列问题:
(5)C、N、O三种元素第一电离能从大到小的顺序是
(6)1molN2F2含有
您最近一年使用:0次



