名校
1 . 现有下列几种常见物质:①CH3Cl、②O3、③P4、④C60、⑤CO2、⑥HCN、⑦H2O、⑧NH3、⑨BF3、⑩CH4。
(1)这几种物质中,含非极性共价键形成的是______________ (填序号,下同);属于非极性分子的是_______________ 。
(2)属于极性键形成的非极性分子是_______________ ;
(3)将 溶于水,破坏
溶于水,破坏 中的
中的_______________ 键,写出其电离方程式_______________ 。
(4)已知铁的电离能数据如下:
则,铁的第四电离能( )大于第三电离能(
)大于第三电离能( )的可能原因是:
)的可能原因是:_______________ 。
(1)这几种物质中,含非极性共价键形成的是
(2)属于极性键形成的非极性分子是
(3)将
 溶于水,破坏
溶于水,破坏 中的
中的(4)已知铁的电离能数据如下:
电离能/( |
|
|
|
| …… |
Fe | 759 | 1561 | 2597 | 5290 | …… |
 )大于第三电离能(
)大于第三电离能( )的可能原因是:
)的可能原因是:
您最近一年使用:0次
名校
2 . 原子结构与元素周期表存在着内在联系。根据已学知识,请回答下列问题:
(1)基态N原子电子占据___________ 个能层,电子占据的最高能级的符号是___________ ;基态N原子共有___________ 种不同空间运动状态的电子。
(2)被誉为“21世纪的金属”的钛(Ti)元素原子的价电子排布式为:___________ ,位于元素周期表的___________ 区。
(3)比较Cu和Zn的第二电离能大小[用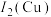 和
和 表示]:
表示]:___________ 。
(4)下列状态的镁中,电离最外层一个电子所需能量最大的是___________(填选项)。
(5)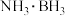 分子中,与N原子相连的H呈正电性(
分子中,与N原子相连的H呈正电性(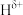 ),与B原子相连的H负电性(
),与B原子相连的H负电性(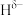 )。在H、B、N三种元素中,电负性由大到小的顺序是
)。在H、B、N三种元素中,电负性由大到小的顺序是___________ 。
(1)基态N原子电子占据
(2)被誉为“21世纪的金属”的钛(Ti)元素原子的价电子排布式为:
(3)比较Cu和Zn的第二电离能大小[用
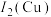 和
和 表示]:
表示]:(4)下列状态的镁中,电离最外层一个电子所需能量最大的是___________(填选项)。
A.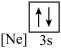 | B.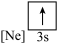 | C. | D.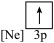 |
(5)
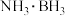 分子中,与N原子相连的H呈正电性(
分子中,与N原子相连的H呈正电性(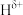 ),与B原子相连的H负电性(
),与B原子相连的H负电性(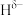 )。在H、B、N三种元素中,电负性由大到小的顺序是
)。在H、B、N三种元素中,电负性由大到小的顺序是
您最近一年使用:0次
名校
解题方法
3 . 阿散酸(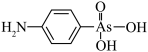 )是一种饲料添加剂,能溶于NaOH溶液中,常含有
)是一种饲料添加剂,能溶于NaOH溶液中,常含有 、NaCl等杂质。回答下列问题(用元表符号或化学式表示):
、NaCl等杂质。回答下列问题(用元表符号或化学式表示):
 原子核外电子占据的最高能级为
原子核外电子占据的最高能级为(2)As元素的第一电离能
(3)
 的中心原子的杂化方式为
的中心原子的杂化方式为 的空间构型为
的空间构型为(4)太阳电池材料中的很多金属或金属化合物在灼烧时会产生特殊的火焰颜色,请用原子结构的知识阐述产生此现象的原因是
(5)阿散酸分子中C和N的杂化类型分别是
您最近一年使用:0次
名校
4 . 综合填空题:
(1)基态砷原子的电子排布式为_______ ,价电子排布图为_______ ,砷元素在周期表的位置为_______ 。
(2)元素锰位于周期表的_______ 区(填“s”、“p”、“d”或“ds”),Mn成为阳离子时首先失去_______ 轨道电子,Sm的价层电子排布式为4f66s2,Sm3+价层电子排布式为_______ ;基态锰原子的第三电离能远大于其第二电离能的原因为:_______ 。
(3)利用CO可以合成化工原料COCl2,COCl2分子的结构式为 ,每个COCl2分子内含有的σ键、π键数目比为
,每个COCl2分子内含有的σ键、π键数目比为_______ ,碳氯键是_______ (填“极性键”或“非极性键”)。
(1)基态砷原子的电子排布式为
(2)元素锰位于周期表的
(3)利用CO可以合成化工原料COCl2,COCl2分子的结构式为
 ,每个COCl2分子内含有的σ键、π键数目比为
,每个COCl2分子内含有的σ键、π键数目比为
您最近一年使用:0次
2023-10-28更新
|
655次组卷
|
3卷引用:宁夏石嘴山市平罗中学2023-2024学年高二上学期期中考试化学试题
5 . 某杂志报道了一种用磁场远程开启化学反应的方法,一种含铁化合物纳米粒子在其中发挥了重要作用。
(1)基态C原子的价层电子轨道表达式为_____ ;其核外电子占据的最高能级的电子云轮廓图形为_____ 。
(2)写出与NO 互为等电子体的一种分子和一种离子:
互为等电子体的一种分子和一种离子:_____ 。
(3)[Fe(CN)6]4-与硝酸反应的离子方程式为:[Fe(CN)6]4-+4H++NO =CO2↑+[Fe(CN)5(NO)]2-(红色)+NH
=CO2↑+[Fe(CN)5(NO)]2-(红色)+NH 。
。
①红色离子中所含非金属元素的第一电离能由大到小的顺序为_____ 。
②CN-与亚铁离子之间的作用力为_____ ;NO 、NH
、NH 中氮原子的杂化方式分别为
中氮原子的杂化方式分别为_____ 、_____ ,键角∠ONO_____ (填“>”或“<”)∠HNH。
(1)基态C原子的价层电子轨道表达式为
(2)写出与NO
 互为等电子体的一种分子和一种离子:
互为等电子体的一种分子和一种离子:(3)[Fe(CN)6]4-与硝酸反应的离子方程式为:[Fe(CN)6]4-+4H++NO
 =CO2↑+[Fe(CN)5(NO)]2-(红色)+NH
=CO2↑+[Fe(CN)5(NO)]2-(红色)+NH 。
。①红色离子中所含非金属元素的第一电离能由大到小的顺序为
②CN-与亚铁离子之间的作用力为
 、NH
、NH 中氮原子的杂化方式分别为
中氮原子的杂化方式分别为
您最近一年使用:0次
名校
解题方法
6 . 氮、氧、磷、砷及其化合物在工农业生产等方面有着重要应用。请按要求回答下列问题。
(1)基态砷原子价电子排布图不能写为 ,是因为该排布方式违背了
,是因为该排布方式违背了__________ 这一原理。
(2)元素第一电离能N______ O(填“>”或“<”或“=”,下同),电负性P______  。
。
(3)肼 可用作火箭燃料等,它的沸点远高于乙烯的原因是:
可用作火箭燃料等,它的沸点远高于乙烯的原因是:__________ 。
(4)尿素( )中碳原子杂化类型
)中碳原子杂化类型__________ ; 离子的立体构型(即空间构型)为
离子的立体构型(即空间构型)为__________ 。
(5) 的熔点为1238℃可作半导体材料;而
的熔点为1238℃可作半导体材料;而 的熔点为77.9℃。
的熔点为77.9℃。
①预测 的晶体类型为
的晶体类型为__________ 。
② 晶胞结构如图所示,晶胞边长为
晶胞结构如图所示,晶胞边长为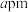 。则晶胞中每个
。则晶胞中每个 原子周围有
原子周围有__________ 个紧邻等距的 原子;该晶体的密度为
原子;该晶体的密度为__________  (列出计算式)。
(列出计算式)。

(1)基态砷原子价电子排布图不能写为
 ,是因为该排布方式违背了
,是因为该排布方式违背了(2)元素第一电离能N
 。
。(3)肼
 可用作火箭燃料等,它的沸点远高于乙烯的原因是:
可用作火箭燃料等,它的沸点远高于乙烯的原因是:(4)尿素(
 )中碳原子杂化类型
)中碳原子杂化类型 离子的立体构型(即空间构型)为
离子的立体构型(即空间构型)为(5)
 的熔点为1238℃可作半导体材料;而
的熔点为1238℃可作半导体材料;而 的熔点为77.9℃。
的熔点为77.9℃。①预测
 的晶体类型为
的晶体类型为②
 晶胞结构如图所示,晶胞边长为
晶胞结构如图所示,晶胞边长为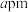 。则晶胞中每个
。则晶胞中每个 原子周围有
原子周围有 原子;该晶体的密度为
原子;该晶体的密度为 (列出计算式)。
(列出计算式)。
您最近一年使用:0次
2022-11-20更新
|
1002次组卷
|
6卷引用:宁夏青铜峡市宁朔中学2022-2023学年高二下学期期中考试化学试题
宁夏青铜峡市宁朔中学2022-2023学年高二下学期期中考试化学试题吉林省吉林松花江中学2022-2023学年高二上学期1月期末考试化学试题(已下线)期中模拟预测卷03(测试范围:选择性必修2+选择性必修3第1-2章)-2022-2023学年高二化学下学期期中期末考点大串讲(人教版2019)天津市河北区2022-2023学年高三上学期期中质量检测化学试题(已下线)北京市海淀区2022届高三一模(结构与性质)(已下线)2022年天津市普通高中学业水平等级性考试化学试题变式题(结构与性质)
7 . 已知M2+的3d轨道上有5个电子,试回答:
(1)M元素原子的核外电子排布式为____ 。
(2)M元素在元素周期表中的位置为____ 。
(3)M元素原子的最外层电子数为____ ,价层电子数为_____ 。
(4)锌在工业中有重要作用,也是人体必需的微量元素。回答下列问题:
①Zn原子核外电子排布式为____ 。
②黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能I1(Zn)____ I1(Cu)(填“大于”或“小于”)。原因是____ 。
(1)M元素原子的核外电子排布式为
(2)M元素在元素周期表中的位置为
(3)M元素原子的最外层电子数为
(4)锌在工业中有重要作用,也是人体必需的微量元素。回答下列问题:
①Zn原子核外电子排布式为
②黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能I1(Zn)
您最近一年使用:0次
2022-04-01更新
|
188次组卷
|
2卷引用:宁夏青铜峡市宁朔中学2021-2022学年高二3月月考化学试题
名校
8 . 性质比较:
(1)半径比较Al___________ S、Al3+___________ S2-(填“大于”、“等于”或“小于”,下同)
(2)第一电离能比较Mg___________ Al,解释原因___________
(3)稳定性比较NH3、H2O、HF,___________ ,解释原因___________
(4)酸性强弱比较HClO4、HClO3___________ ,解释原因___________
(1)半径比较Al
(2)第一电离能比较Mg
(3)稳定性比较NH3、H2O、HF,
(4)酸性强弱比较HClO4、HClO3
您最近一年使用:0次
9 . 太阳能的开发利用在新能源研究中占据重要地位,单晶硅太阳能电池片在加工时,一般掺杂微量的铜、铁、钴、硼、镓、硒等。其中某种重要的含铜的化合物结构如图。请回答下列问题:
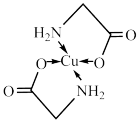
(1)铜位于周期表中___________ 区。
(2)基态二价铜离子的电子排布式为___________ ,已知高温下Cu2O比CuO更稳定,试从核外电子排布角度解释___________ 。
(3)硼核外电子的运动状态的概率密度分布可用___________ 形象化描述。
(4)Fe3+的价电子排布图为___________ 。
(5)N、O、Se三种元素中的第一电离能最大的为:___________ 。

(1)铜位于周期表中
(2)基态二价铜离子的电子排布式为
(3)硼核外电子的运动状态的概率密度分布可用
(4)Fe3+的价电子排布图为
(5)N、O、Se三种元素中的第一电离能最大的为:
您最近一年使用:0次
2021-05-11更新
|
458次组卷
|
4卷引用:宁夏吴忠中学2020-2021学年高二下学期期中考试化学试题
宁夏吴忠中学2020-2021学年高二下学期期中考试化学试题(已下线)作业02 原子结构与元素的性质-2021年高二化学暑假作业(人教版2019)专题1~2 综合检测(提升卷)(已下线)专题突破卷06 物质结构与性质?-2024年高考化学一轮复习考点通关卷(新教材新高考)
10 . 不锈钢是由铁、铬、镍、碳及众多不同元素所组成的合金,铁是主要成分元素,铬是第一主要的合金元素。其中铬的含量不能低于11%,不然就不能生成致密氧化膜CrO3以防止腐蚀。
(1)基态碳(C)原子的核外电子排布图为___________ 。
(2)[Cr(H2O)4Cl2]Cl·2H2O中Cr的配位数为___________ 。
(3)与铜属于同一周期,且未成对价电子数最多的元素基态原子外围电子排布式为_____ 。
(4)Fe的一种晶胞结构如甲、乙所示,若按甲中虚线方向切乙得到的A~D图中正确的是_____ 。

(5)据报道,只含镁、镍和碳三种元素的晶体具有超导性。鉴于这三种元素都是常见元素,从而引起广泛关注。该晶体的晶胞结构如图所示,试写出该晶体的化学式:___________ 。晶体中每个镁原子周围距离最近的镍原子有___________ 个。

(6)根据下列五种元素的第一至第四电离能数据(单位:kJ·mol-1),回答下列问题。
①在周期表中,最可能处于同一族的是___________ 和___________ 。
②T元素最可能是___________ 区元素。若T为第二周期元素,F是第三周期元素中原子半径最小的元素,则T、F形成的化合物的空间构型为___________ ,其中心原子的杂化方式为___________ 。
(1)基态碳(C)原子的核外电子排布图为
(2)[Cr(H2O)4Cl2]Cl·2H2O中Cr的配位数为
(3)与铜属于同一周期,且未成对价电子数最多的元素基态原子外围电子排布式为
(4)Fe的一种晶胞结构如甲、乙所示,若按甲中虚线方向切乙得到的A~D图中正确的是

(5)据报道,只含镁、镍和碳三种元素的晶体具有超导性。鉴于这三种元素都是常见元素,从而引起广泛关注。该晶体的晶胞结构如图所示,试写出该晶体的化学式:

(6)根据下列五种元素的第一至第四电离能数据(单位:kJ·mol-1),回答下列问题。
元素代号 | I1 | I2 | I3 | I4 |
Q | 2 080 | 4 000 | 6 100 | 9 400 |
R | 500 | 4 600 | 6 900 | 9 500 |
S | 740 | 1 500 | 7 700 | 10 500 |
T | 580 | 1 800 | 2 700 | 11 600 |
U | 420 | 3 100 | 4 400 | 5 900 |
①在周期表中,最可能处于同一族的是
②T元素最可能是
您最近一年使用:0次
2020-12-11更新
|
943次组卷
|
5卷引用:宁夏石嘴山市平罗中学2022-2023学年高二上学期期中考试(重点班)化学试题
宁夏石嘴山市平罗中学2022-2023学年高二上学期期中考试(重点班)化学试题(已下线)模块同步卷09 金属晶体与离子晶体-《灯塔金卷系列》2020-2021学年高二化学模块同步卷(人教版选修3)山东省青岛市第二中学2022-2023学年高二上学期期末考试化学试题湖南省攸县第一中学2022-2023学年高二上学期期末考试化学试题(已下线)第37讲 晶体结构与性质(精练)-2021年高考化学一轮复习讲练测

 )
)



