名校
1 . 磷酸亚铁锂( )可用作锂离子电池正极材料,具有热稳定性好、循环性能优良、安全性高等特点,文献报道可采用
)可用作锂离子电池正极材料,具有热稳定性好、循环性能优良、安全性高等特点,文献报道可采用 、
、 等作为原料制备。请回答下列问题:
等作为原料制备。请回答下列问题:
(1)P在元素周期表中的位置为___________ 。
(2)基态 原子的价层电子排布式为
原子的价层电子排布式为___________ ,基态 与
与 中未成对的电子数之比为
中未成对的电子数之比为___________ 。
(3)基态 原子的核外电子有
原子的核外电子有___________ 种空间运动状态,其能量最高的电子的电子云轮廓图为___________ 。
(4)组成 ,的非金属元素中,N、P、O的电负性由大到小的顺序为
,的非金属元素中,N、P、O的电负性由大到小的顺序为___________ (填元素符号);第一电离能:N___________ (填“>”或“<”)O,原因是___________ 。
 )可用作锂离子电池正极材料,具有热稳定性好、循环性能优良、安全性高等特点,文献报道可采用
)可用作锂离子电池正极材料,具有热稳定性好、循环性能优良、安全性高等特点,文献报道可采用 、
、 等作为原料制备。请回答下列问题:
等作为原料制备。请回答下列问题:(1)P在元素周期表中的位置为
(2)基态
 原子的价层电子排布式为
原子的价层电子排布式为 与
与 中未成对的电子数之比为
中未成对的电子数之比为(3)基态
 原子的核外电子有
原子的核外电子有(4)组成
 ,的非金属元素中,N、P、O的电负性由大到小的顺序为
,的非金属元素中,N、P、O的电负性由大到小的顺序为
您最近一年使用:0次
2 . 已知信息:
根据题中包含的元素回答下列问题:
(1)上述实验涉及的元素中,位于元素周期表中ds区的元素是___________ (填元素符号),基态K原子中电子占据的最高能级的原子轨道形状是___________ 。
(2)Fe在元素周期表中的位置是___________ ,基态 与
与 中未成对的电子数之比为
中未成对的电子数之比为___________ 。
(3)基态S原子的价层电子轨道表示为___________ 。
(4)O、F、S三种元素形成的最简氢化物的热稳定性由大到小的顺序为___________ (写化学式);C、N、O三种元素中,第一电离能最大的是___________ ,原因为___________ 。
| 溶液 |  溶液 溶液 |  溶液 溶液 | NaF溶液 |  溶液 溶液 |
| 滴加试剂 |  溶液 溶液 |  溶液 溶液 |  溶液 溶液 | 氨水 |
| 现象 | 产生普鲁士蓝沉淀 | 产生滕氏蓝沉淀 | 溶液变浑浊 | 随着滴入氨水的量的增大,先生成蓝色沉淀,后蓝色沉淀溶解,形成蓝色溶液 |
(1)上述实验涉及的元素中,位于元素周期表中ds区的元素是
(2)Fe在元素周期表中的位置是
 与
与 中未成对的电子数之比为
中未成对的电子数之比为(3)基态S原子的价层电子轨道表示为
(4)O、F、S三种元素形成的最简氢化物的热稳定性由大到小的顺序为
您最近一年使用:0次
名校
3 . 2020年8月19日发布的《新型冠状病毒肺炎诊疗方案(试行第八版)》中指出,氯喹类药物可用于治疗新冠肺炎,其中羟基氯喹结构如图所示。
(1)羟基氯喹分子中含氧官能团的名称为_____ 。
(2)羟基氯喹分子中基态Cl原子核外电子有_____ 种空间运动状态。
(3)羟基氯喹分子中C、N、O三种元素的电负性由小到大的顺序为_____ (用元素符号表示),第一电离能由小到大的顺序为_____ (用元素符号表示)。
(4)N原子的VSEPR模型为_____ 。
(5)请在答题卡中,用*标出羟基氯喹分子中的手性碳原子_____ 。
(6)下列现代分析手段中,可用于检测羟基氯的晶体结构是_____ 。

(1)羟基氯喹分子中含氧官能团的名称为
(2)羟基氯喹分子中基态Cl原子核外电子有
(3)羟基氯喹分子中C、N、O三种元素的电负性由小到大的顺序为
(4)N原子的VSEPR模型为
(5)请在答题卡中,用*标出羟基氯喹分子中的手性碳原子
(6)下列现代分析手段中,可用于检测羟基氯的晶体结构是
| A.X射线衍射 | B.原子光谱 | C.元素分析 | D.红外光谱 |
您最近一年使用:0次
2023-04-24更新
|
667次组卷
|
3卷引用:广西大学附属中学2023-2024学年高二下学期4月月考化学试题
4 . 完成下列问题:
(1)N、O、Mg、Al、S、Fe是常见的六种元素,按要求回答下列问题:
①Fe位于元素周期表第_____ 周期第_____ 族。
②基态N原子核外电子排布式为_____ ;基态O原子核外有_____ 种运动状态的电子。
③基态S原子核外电子占据的最高能级的电子云轮廓图为_____ 形。
④Mg、Al两种元素中第一电离能较大的是_____ 填元素符号)。
(2)几种元素的电负性数据如表:
①AlBr3的熔点_____ AlF3的熔点(填“大于”、“小于”或“等于”),原因是_____ 。
②根据同一主族元素电负性递变规律,预测碘元素的电负性数值范围为_____ 。
(1)N、O、Mg、Al、S、Fe是常见的六种元素,按要求回答下列问题:
①Fe位于元素周期表第
②基态N原子核外电子排布式为
③基态S原子核外电子占据的最高能级的电子云轮廓图为
④Mg、Al两种元素中第一电离能较大的是
(2)几种元素的电负性数据如表:
| O | F | Al | Br | …… |
| 3.5 | 4.0 | 1.5 | 2.8 | …… |
②根据同一主族元素电负性递变规律,预测碘元素的电负性数值范围为
您最近一年使用:0次
名校
解题方法
5 . 合成氨有助于解决地球上粮食不足问题,是化学和技术对社会发展与进步的巨大贡献。
(1)基态N原子中,能量最高的电子的电子云在空间有_______ 个伸展方向,原子轨道呈_______ 形。
(2)我国科研人员研制出了“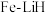 ”催化剂,使得合成氨温度和压强分别降到了350℃,
”催化剂,使得合成氨温度和压强分别降到了350℃,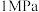 ,这是近年来合成氨反应研究中心的重要突破。
,这是近年来合成氨反应研究中心的重要突破。
①第三电离能
_______ 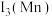 (填“>”或“<”),原因是
(填“>”或“<”),原因是_______ 。
②比较 与
与 的半径大小关系:
的半径大小关系: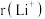
_______  (填“>”或“<”)。
(填“>”或“<”)。
(3)科学家近期合成了一种固氮酶模型配合物,该物质可以在温和条件下直接活化H2,将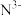 转化为NH2,反应过程如图所示:
转化为NH2,反应过程如图所示:
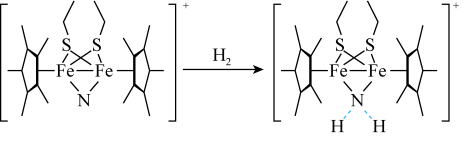
产物中 原于的杂化轨道类型为
原于的杂化轨道类型为_______ 。
(1)基态N原子中,能量最高的电子的电子云在空间有
(2)我国科研人员研制出了“
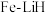 ”催化剂,使得合成氨温度和压强分别降到了350℃,
”催化剂,使得合成氨温度和压强分别降到了350℃,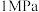 ,这是近年来合成氨反应研究中心的重要突破。
,这是近年来合成氨反应研究中心的重要突破。①第三电离能

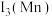 (填“>”或“<”),原因是
(填“>”或“<”),原因是②比较
 与
与 的半径大小关系:
的半径大小关系: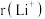
 (填“>”或“<”)。
(填“>”或“<”)。(3)科学家近期合成了一种固氮酶模型配合物,该物质可以在温和条件下直接活化H2,将
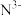 转化为NH2,反应过程如图所示:
转化为NH2,反应过程如图所示:
产物中
 原于的杂化轨道类型为
原于的杂化轨道类型为
您最近一年使用:0次
6 . 元素周期表中锑元素的数据如图。

(1)根据锑的价层电子排布式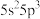 可知,锑在元素周期表中位于第
可知,锑在元素周期表中位于第_______ 周期第_______ 族。
(2)基态锑原子中有_______ 个未成对电子,这些未成对电子具有_______ (填“相同”或“不同”)的自旋状态。
(3)基态锑原子的5s轨道形状为_______ 形;该原子最外层电子占有_______ 个轨道。
(4)Bi在元素周期表中与Sb相邻,位于Sb的正下方。
①下列推断正确的是_______ 。
a.电负性:Sb>Bi b.原子半径:Sb>Bi c.金属性:Sb>Bi d.氧化性: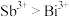
②第一电离能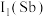
_______ (填“大于”或“小于”) 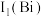 ,原因是
,原因是_______ 。

(1)根据锑的价层电子排布式
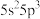 可知,锑在元素周期表中位于第
可知,锑在元素周期表中位于第(2)基态锑原子中有
(3)基态锑原子的5s轨道形状为
(4)Bi在元素周期表中与Sb相邻,位于Sb的正下方。
①下列推断正确的是
a.电负性:Sb>Bi b.原子半径:Sb>Bi c.金属性:Sb>Bi d.氧化性:
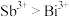
②第一电离能
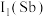
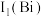 ,原因是
,原因是
您最近一年使用:0次
名校
7 . 合成氨是人类科学技术发展史上的一项重大成就,在很大程度上解决了地球上因粮食不足而导致的饥饿问题,是化学和技术对社会发展与进步的巨大贡献。
(1)基态N原子中,能量最高的电子的电子云在空间有___________ 个伸展方向,原子轨道呈___________ 形。
(2) 分子中,N、H电负性大小顺序为
分子中,N、H电负性大小顺序为___________ 。从原子结构的角度分析B、N和O的第一电离能由大到小的顺序为___________ 。
(3)铁触媒是普遍使用的以铁为主体的多成分催化剂,通常还含有 、
、 、CaO、MgO、
、CaO、MgO、 等氧化物中的几种。
等氧化物中的几种。
①Cr原子的价电子排布图为___________ 。
②上述氧化物所涉及的元素中,处于元素周期表中p区的元素是___________ 。
(4)目前合成氨通常采用的压强为10MPa-30MPa、温度为400-500℃,十分耗能。我国科研人员研制出了“Fe-LiH”等催化剂,温度,压强分别降到了350℃、1MPa,这是近年来合成氨反应研究中的重要突破。
①第三电离能
___________ 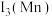 (填“>”或“<”),原因是
(填“>”或“<”),原因是___________ 。
②比较 与
与 的半径大小关系:
的半径大小关系: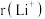
___________  。(填“>”或“<”)
。(填“>”或“<”)
(1)基态N原子中,能量最高的电子的电子云在空间有
(2)
 分子中,N、H电负性大小顺序为
分子中,N、H电负性大小顺序为(3)铁触媒是普遍使用的以铁为主体的多成分催化剂,通常还含有
 、
、 、CaO、MgO、
、CaO、MgO、 等氧化物中的几种。
等氧化物中的几种。①Cr原子的价电子排布图为
②上述氧化物所涉及的元素中,处于元素周期表中p区的元素是
(4)目前合成氨通常采用的压强为10MPa-30MPa、温度为400-500℃,十分耗能。我国科研人员研制出了“Fe-LiH”等催化剂,温度,压强分别降到了350℃、1MPa,这是近年来合成氨反应研究中的重要突破。
①第三电离能

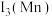 (填“>”或“<”),原因是
(填“>”或“<”),原因是②比较
 与
与 的半径大小关系:
的半径大小关系: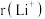
 。(填“>”或“<”)
。(填“>”或“<”)
您最近一年使用:0次
2022-11-12更新
|
826次组卷
|
4卷引用:广西钦州市第四中学2022-2023学年高二下学期2月考试化学试题
解题方法
8 . 按要求回答下列问题。
(1)A是在地壳中含量最多的元素,该元素原子的电子排布图是_______ ,其原子核外有_______ 个未成对电子,能量最高的电子所在的轨道呈_______ 形。B为周期表中第29号元素,B的电子排布式为_______ 。
(2)汽车尾气含有CO和NO等有毒气体,净化有毒气体的反应方程式为: ,此反应中涉及元素的第一电离能大小关系为
,此反应中涉及元素的第一电离能大小关系为_______ ;此反应中涉及物质中互为等电子体的是_______ ; 的结构式为
的结构式为_______ 。
(3)元素周期表中除放射性元素外,电负性最小的元素与电负性最大的元素形成的化合物的电子式为:_______ 。
(1)A是在地壳中含量最多的元素,该元素原子的电子排布图是
(2)汽车尾气含有CO和NO等有毒气体,净化有毒气体的反应方程式为:
 ,此反应中涉及元素的第一电离能大小关系为
,此反应中涉及元素的第一电离能大小关系为 的结构式为
的结构式为(3)元素周期表中除放射性元素外,电负性最小的元素与电负性最大的元素形成的化合物的电子式为:
您最近一年使用:0次
9 . 下图是元素周期表的一部分,图中所列字母分别代表一种化学元素。
(1)元素b位于周期表中_______ 区,其基态原子核外有_______ 种运动状态不同的电子。
(2)基态c原子中有_______ 个未成对电子,其中能量最高的电子所在原子轨道的电子云轮廓图为_______ 形。
(3)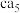 理论上为离子化合物,猜测其电子式为
理论上为离子化合物,猜测其电子式为_______ 。
(4)基态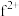 外围电子的电子排布图为
外围电子的电子排布图为_______ ,已知高温下化合物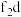 比化合物fd更稳定,试从核外电子排布的角度解释原因
比化合物fd更稳定,试从核外电子排布的角度解释原因_______ 。
(5)b、c、d三种元素的第一电离能由大到小的顺序为_______ (填元素符号)。

(1)元素b位于周期表中
(2)基态c原子中有
(3)
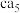 理论上为离子化合物,猜测其电子式为
理论上为离子化合物,猜测其电子式为(4)基态
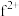 外围电子的电子排布图为
外围电子的电子排布图为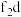 比化合物fd更稳定,试从核外电子排布的角度解释原因
比化合物fd更稳定,试从核外电子排布的角度解释原因(5)b、c、d三种元素的第一电离能由大到小的顺序为
您最近一年使用:0次
2021-07-09更新
|
899次组卷
|
6卷引用:广西南宁市2022-2023学年高二下学期开学考试化学试题
广西南宁市2022-2023学年高二下学期开学考试化学试题广东省肇庆市2020-2021学年高二下学期末教学质量检测化学(物质结构与性质)试题(已下线)1.2.2 原子结构与元素周期律(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修2)(已下线)第一章 原子结构与性质 章节过关检测-2021-2022学年高二化学链接教材精准变式练(人教版2019选择性必修2)江苏省无锡市市北高级中学2023-2024学年高二上学期期末检测化学试卷(已下线)猜想01 原子结构与性质 【考题猜想】(8大题型)-2023-2024学年高二化学下学期期末考点大串讲(人教版2019)
名校
解题方法
10 . 在下列空格中,填上适当的元素符号或微粒符号。
(1)在第3周期中,第一电离能最大的元素是_______ ,电负性最大的元素是_______ 。
(2)在第4周期元素中,3d轨道半充满的_________ 。
(3)在F2、H2O2、 NH3、 、H2O、 HBr中,含有配位键的微粒有
、H2O、 HBr中,含有配位键的微粒有_____ ,含有非极性键的微粒有________ ; 空间构型是三角锥形的分子_______ 。
(1)在第3周期中,第一电离能最大的元素是
(2)在第4周期元素中,3d轨道半充满的
(3)在F2、H2O2、 NH3、
 、H2O、 HBr中,含有配位键的微粒有
、H2O、 HBr中,含有配位键的微粒有
您最近一年使用:0次
2020-08-05更新
|
278次组卷
|
2卷引用:广西钦州市2019-2020学年高二下学期期末教学质量监测化学试题



