1 . 砷化镍可用于制作发光器件、半导体激光器、太阳能电池和高速集成电路。
(1)第一电离能:As___________ (填“>”或“<”)Se.
(2)As2O3是两性氧化物,As2O3溶于盐酸生成AsCl3,AsCl3用LiAlH4还原生成AsH3。___________ (填“>”“=”或“<”)109°28′。
(3)有机砷 是治疗昏睡病的药物,它存在的化学键种类有
是治疗昏睡病的药物,它存在的化学键种类有___________ (填字母)。
a.离子键 b.σ键
c.π键 d.碳碳双键
(4)氮与砷同族,氮元素是植物生长所需的元素,常见氮肥有铵盐(NH )、尿素(
)、尿素(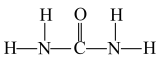 )等,NH
)等,NH 中H—N—H的键角
中H—N—H的键角___________ (填“>”“<”“=”)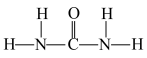 中N—C—N的键角;1 mol尿素分子含有σ键的数目为
中N—C—N的键角;1 mol尿素分子含有σ键的数目为___________ 。
(1)第一电离能:As
(2)As2O3是两性氧化物,As2O3溶于盐酸生成AsCl3,AsCl3用LiAlH4还原生成AsH3。
①AlH 的中心原子的杂化方式为
的中心原子的杂化方式为
(3)有机砷
 是治疗昏睡病的药物,它存在的化学键种类有
是治疗昏睡病的药物,它存在的化学键种类有a.离子键 b.σ键
c.π键 d.碳碳双键
(4)氮与砷同族,氮元素是植物生长所需的元素,常见氮肥有铵盐(NH
 )、尿素(
)、尿素(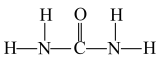 )等,NH
)等,NH 中H—N—H的键角
中H—N—H的键角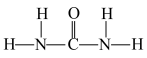 中N—C—N的键角;1 mol尿素分子含有σ键的数目为
中N—C—N的键角;1 mol尿素分子含有σ键的数目为
您最近一年使用:0次
2 . 根据已学知识,请回答下列问题:
(1)基态 N 原子中,核外电子占据的最高能层的符号是___________ ,占据该能层电子的原子轨道形状为___________ 。
(2)写出3p轨道上有2个未成对电子的元素的符号:___________ 。
(3)某元素被科学家称之为人体微量元素中的"防癌之王",其原子的价层电子排布式为4s24p4,该元素的名称是___________ 。
(4)已知铁是26号元素,写出基态 Fe 的价层电子排布式:___________ ;在元素周期表中,该元素在___________ (填“s”“p”“d”“f”或“ds”)区。
(5)从原子结的角度分析 B 、N和O的第一电能由大到小的顺序为___________ ,电负性由大到小的顺序是___________ 。
(1)基态 N 原子中,核外电子占据的最高能层的符号是
(2)写出3p轨道上有2个未成对电子的元素的符号:
(3)某元素被科学家称之为人体微量元素中的"防癌之王",其原子的价层电子排布式为4s24p4,该元素的名称是
(4)已知铁是26号元素,写出基态 Fe 的价层电子排布式:
(5)从原子结的角度分析 B 、N和O的第一电能由大到小的顺序为
您最近一年使用:0次
名校
3 . 近年来我国科学家发现了一系列意义重大的铁系、铜系超导材料,其中一类为Fe-Sm-As-F-O组成的化合物。回答下列问题:
(1)元素As与N同族。预测As的氢化物分子的立体结构为______ ,杂化类型为______ ,其沸点比 的
的______ (填“高”或“低”),其判断理由是____________ 。
(2)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成,第一电离能:
______ (填“大于”或“小于”) ,原因是
,原因是____________ 。
(3)研究发现,阳离子的颜色与未成对电子数有关。例如: 、
、 、
、 等。
等。 呈无色,其原因是
呈无色,其原因是____ 。
(1)元素As与N同族。预测As的氢化物分子的立体结构为
 的
的(2)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成,第一电离能:

 ,原因是
,原因是(3)研究发现,阳离子的颜色与未成对电子数有关。例如:
 、
、 、
、 等。
等。 呈无色,其原因是
呈无色,其原因是
您最近一年使用:0次
2023-04-03更新
|
125次组卷
|
2卷引用:山西省晋中市平遥县第二中学校2022-2023学年高二下学期3月月考化学试题
名校
解题方法
4 . 完成下列问题
(1)基态硫原子核外电子的空间运动状态有___________ 种;其核外电子运动最高能级的电子云轮廓图的形状为___________ 。
(2)基态砷原子的价层电子的轨道表示式为___________ 。
(3)元素Mg的第一电离能大于Al的第一电离能的原因是___________ 。
(4)硫化氢和水分子结构相似,硫化氢晶体中,一个硫化氢分子周围有12个紧邻分子,而冰中一个水分子周围只有4个紧邻分子,原因为:___________ 。
(5) 是离子晶体,其晶格能可通过图(a)的Born−Haber循环计算得到。
是离子晶体,其晶格能可通过图(a)的Born−Haber循环计算得到。

可知,Li原子的第一电离能为___________  ,
, 键键能为
键键能为___________ 
(6) 、
、 、
、 的还原性由强到弱的顺序为
的还原性由强到弱的顺序为___________ ,键角由大到小的顺序为___________ ,已知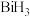 的沸点高于
的沸点高于 ,其原因是
,其原因是___________ 。
(1)基态硫原子核外电子的空间运动状态有
(2)基态砷原子的价层电子的轨道表示式为
(3)元素Mg的第一电离能大于Al的第一电离能的原因是
(4)硫化氢和水分子结构相似,硫化氢晶体中,一个硫化氢分子周围有12个紧邻分子,而冰中一个水分子周围只有4个紧邻分子,原因为:
(5)
 是离子晶体,其晶格能可通过图(a)的Born−Haber循环计算得到。
是离子晶体,其晶格能可通过图(a)的Born−Haber循环计算得到。
可知,Li原子的第一电离能为
 ,
, 键键能为
键键能为
(6)
 、
、 、
、 的还原性由强到弱的顺序为
的还原性由强到弱的顺序为 的沸点高于
的沸点高于 ,其原因是
,其原因是
您最近一年使用:0次
2023-03-30更新
|
254次组卷
|
3卷引用:山西省太原师范附属中学、太原市师苑中学校2022-2023学年高二下学期第一次月考化学(理)试题
5 . H、C、N、O、F、S等是重要的非金属元素,回答下列问题:
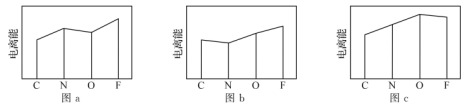
(1)图a、b、c分别表示C、N、O和F的逐级电离能I变化趋势(纵坐标的标度不同)。第二电离能的变化图是_______ (填标号),判断的根据是_______ 。
(2)已知C—H、C—F的键能分别为413.4 、485
、485 。在2022年冬奥会上“水立方”华丽转身为“冰立方”,实现了奥运场馆的再利用,其美丽的透光气囊材料由乙烯(
。在2022年冬奥会上“水立方”华丽转身为“冰立方”,实现了奥运场馆的再利用,其美丽的透光气囊材料由乙烯( )与四氟乙烯(
)与四氟乙烯( )的共聚物(ETFE)制成。
)的共聚物(ETFE)制成。 、
、 分子的稳定性关系:前者
分子的稳定性关系:前者_______ 后者(填“大于”或“小于”),原因是_______ 。
(3)相同条件下, 与
与 在水中的溶解度较大的是
在水中的溶解度较大的是_______ (写分子式),理由是_______ 。
(4)已知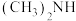 比
比 接收质子的能力强,可能的原因是
接收质子的能力强,可能的原因是_______ 。
(1)图a、b、c分别表示C、N、O和F的逐级电离能I变化趋势(纵坐标的标度不同)。第二电离能的变化图是

(2)已知C—H、C—F的键能分别为413.4
 、485
、485 。在2022年冬奥会上“水立方”华丽转身为“冰立方”,实现了奥运场馆的再利用,其美丽的透光气囊材料由乙烯(
。在2022年冬奥会上“水立方”华丽转身为“冰立方”,实现了奥运场馆的再利用,其美丽的透光气囊材料由乙烯( )与四氟乙烯(
)与四氟乙烯( )的共聚物(ETFE)制成。
)的共聚物(ETFE)制成。 、
、 分子的稳定性关系:前者
分子的稳定性关系:前者(3)相同条件下,
 与
与 在水中的溶解度较大的是
在水中的溶解度较大的是(4)已知
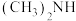 比
比 接收质子的能力强,可能的原因是
接收质子的能力强,可能的原因是
您最近一年使用:0次
名校
6 . DF-31洲际弹道导弹是我国大国地位和国防实力的象征,其制作材料包含了Fe、Cr、Ni、C等多种元素。回答下列问题:
(1)基态铁原子的电子排布式为_______ , 具有较强的还原性,原因是
具有较强的还原性,原因是_______ 。
(2)基态Ni原子的核外能量不同的电子有_______ 种。
(3)Cr的第二电离能 和Mn的第二电离能
和Mn的第二电离能 分别为1590.6 kJ·mol
分别为1590.6 kJ·mol 、1509.0 kJ·mol
、1509.0 kJ·mol ,
, 的原因是
的原因是_______ ;过氧化铬 中Cr的化合价为+6,则分子中σ键、π键的数目之比为
中Cr的化合价为+6,则分子中σ键、π键的数目之比为_______ 。
(4)指出下列过程需要破坏的作用力:干冰熔化_______ ;氢氧化钠溶于水_______ ;氯化氢溶于水_______ ;冰的熔化_______ 。
①离子键②极性共价键③非极性共价键④氢键⑤范德华力
(1)基态铁原子的电子排布式为
 具有较强的还原性,原因是
具有较强的还原性,原因是(2)基态Ni原子的核外能量不同的电子有
(3)Cr的第二电离能
 和Mn的第二电离能
和Mn的第二电离能 分别为1590.6 kJ·mol
分别为1590.6 kJ·mol 、1509.0 kJ·mol
、1509.0 kJ·mol ,
, 的原因是
的原因是 中Cr的化合价为+6,则分子中σ键、π键的数目之比为
中Cr的化合价为+6,则分子中σ键、π键的数目之比为(4)指出下列过程需要破坏的作用力:干冰熔化
①离子键②极性共价键③非极性共价键④氢键⑤范德华力
您最近一年使用:0次
2023-03-16更新
|
266次组卷
|
2卷引用:山西省介休市第一中学校2022-2023学年高二下学期3月月考化学试题
7 . 三草酸合铁酸钾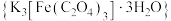 是制备铁触媒上的主要原料。在光照下分解:
是制备铁触媒上的主要原料。在光照下分解:
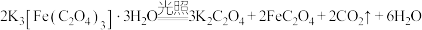 。回答下列问题:
。回答下列问题:
(1)基态 原子的电子排布式为
原子的电子排布式为___________ ,基态 与
与 中未成对电子的数目之比为
中未成对电子的数目之比为___________ 。
(2)三草酸合铁酸钾所含元素中,第一电离能最大的是___________ (填元素符号,下同),电负性最大的是___________ 。
(3)1个 与1个
与1个 分子中
分子中 键数目之比为
键数目之比为___________ , 分子的立体构型为
分子的立体构型为___________ 。
(4)金刚石的晶胞结构如图所示,碳原子分别位于顶点、面心和体内。

若图中原子1的坐标为 ,则原子2的坐标为
,则原子2的坐标为___________ 。
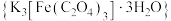 是制备铁触媒上的主要原料。在光照下分解:
是制备铁触媒上的主要原料。在光照下分解: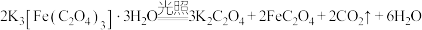 。回答下列问题:
。回答下列问题:(1)基态
 原子的电子排布式为
原子的电子排布式为 与
与 中未成对电子的数目之比为
中未成对电子的数目之比为(2)三草酸合铁酸钾所含元素中,第一电离能最大的是
(3)1个
 与1个
与1个 分子中
分子中 键数目之比为
键数目之比为 分子的立体构型为
分子的立体构型为(4)金刚石的晶胞结构如图所示,碳原子分别位于顶点、面心和体内。

若图中原子1的坐标为
 ,则原子2的坐标为
,则原子2的坐标为
您最近一年使用:0次
2022-05-09更新
|
517次组卷
|
3卷引用:山西省怀仁市大地中学高中部2021-2022学年高二下学期第三次月考化学试题
山西省怀仁市大地中学高中部2021-2022学年高二下学期第三次月考化学试题福建省莆田市2022届高三下学期第三次质量检测化学试题(已下线)第十二章 物质结构与性质(测)-2023年高考化学一轮复习讲练测(全国通用)
解题方法
8 . 下表为元素周期表的一部分,其中字母代表相应的元素。

试回答下列问题:
(1)元素h的基态原子的核外电子排布式为_______ 。
(2)c、d、e、f元素原子的第一电离能( )由小到大的顺序为
)由小到大的顺序为_______ (用相应元素符号表示)。
(3)表中所列的元素之间可以形成多种化合物,其中邻甲基苯甲醛( )分子中碳原子轨道的杂化类型为
)分子中碳原子轨道的杂化类型为_____ 。1mol苯甲醛( )分子中含有σ键的物质的量为
)分子中含有σ键的物质的量为______ mol。
(4)一种由表中元素形成的离子与单质 互为等电子体,其离子符号为
互为等电子体,其离子符号为_______ 。

试回答下列问题:
(1)元素h的基态原子的核外电子排布式为
(2)c、d、e、f元素原子的第一电离能(
 )由小到大的顺序为
)由小到大的顺序为(3)表中所列的元素之间可以形成多种化合物,其中邻甲基苯甲醛(
 )分子中碳原子轨道的杂化类型为
)分子中碳原子轨道的杂化类型为 )分子中含有σ键的物质的量为
)分子中含有σ键的物质的量为(4)一种由表中元素形成的离子与单质
 互为等电子体,其离子符号为
互为等电子体,其离子符号为
您最近一年使用:0次
9 . 铁氮化合物(FexNy)在磁记录材料领域有着广泛的应用前景。某FexNy的制备需铁、氮气、丙酮和乙醇参与。
(1)Fe原子价电子排布图为___________ 。
(2)丙酮( )分子中碳原子轨道的杂化类型是
)分子中碳原子轨道的杂化类型是___________ ,C、N、O第一电离能由大到小的顺序为___________ 。
(3)C、H、O三种元素的电负性由小到大的顺序为___________ 。
(4)乙醇的沸点高于丙酮,这是因为___________ 。
(1)Fe原子价电子排布图为
(2)丙酮(
 )分子中碳原子轨道的杂化类型是
)分子中碳原子轨道的杂化类型是(3)C、H、O三种元素的电负性由小到大的顺序为
(4)乙醇的沸点高于丙酮,这是因为
您最近一年使用:0次
10 . (1)可正确表示原子轨道的是___________ 。
A.2s B.2d C.3px D.3f
(2)写出基态镓(Ga)原子的价电子排布式:___________ 。
(3)下列物质中,只含有极性键的分子是_____ ,既含离子键又含共价键的化合物是_______ ;只存在σ键的分子是_______ ,同时存在σ键和π键的分子是_____ 。
A.N2 B.CO2 C.CH2Cl2 D.C2H4 E.C2H6 F.CaCl2 G.NH4Cl
(4)用“>”“<”或“=”填空:第一电离能的大小:Mg____ Al;
A.2s B.2d C.3px D.3f
(2)写出基态镓(Ga)原子的价电子排布式:
(3)下列物质中,只含有极性键的分子是
A.N2 B.CO2 C.CH2Cl2 D.C2H4 E.C2H6 F.CaCl2 G.NH4Cl
(4)用“>”“<”或“=”填空:第一电离能的大小:Mg
您最近一年使用:0次



