解题方法
1 . 回答下列问题。
(1)写出铬原子价电子排布式:___________ ;与铬同一周期的元素原子中最外层电子数与铬原子的相同的元素有___________ (填元素符号)。
(2)第三周期第一电离能处于Al和P之间的元素有___________ 种。
(3)NO 互为等电子体的分子或离子为
互为等电子体的分子或离子为___________ 。
(4)1 mol CH2=CH-CH2OH含___________ molσ键,该分子中碳原子的杂化类型为___________ 。
(1)写出铬原子价电子排布式:
(2)第三周期第一电离能处于Al和P之间的元素有
(3)NO
 互为等电子体的分子或离子为
互为等电子体的分子或离子为(4)1 mol CH2=CH-CH2OH含
您最近一年使用:0次
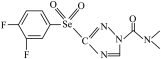
2 . 科技的发展为新能源开发和新材料研制开拓出更大的空间。中科院科学家最近合成了一种新型材料,其结构简式为:___________ 种空间伸展方向;基态硒原子的价层电子排布式是___________ ;氟、氧、氮三种元素的第一电离能由大到小的顺序___________ (用元素符号表示)。
(2)该分子中含有氮、氧、氟三种电负性很大的原子,也含有氢原子,它___________ (填“能”或“不能”)形成分子内或者分子间氢键,其原因是___________ 。
(3)硒能形成两种常见的氧化物,分子式为___________ 。
(4)常压下,氨气在300℃时约有10%分解,水蒸气在2000℃时约有5%分解,从物质结构的角度看,其原因是___________ 。
(2)该分子中含有氮、氧、氟三种电负性很大的原子,也含有氢原子,它
(3)硒能形成两种常见的氧化物,分子式为
(4)常压下,氨气在300℃时约有10%分解,水蒸气在2000℃时约有5%分解,从物质结构的角度看,其原因是
您最近一年使用:0次
名校
解题方法
3 . 铁能形成多种化合物,如 (羰基铁),它们在生活生产中有广泛应用。
(羰基铁),它们在生活生产中有广泛应用。
(1)实验室常用KSCN溶液、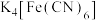 溶液、苯酚溶液检验
溶液、苯酚溶液检验 。N、O、S的第一电离能由大到小的顺序为
。N、O、S的第一电离能由大到小的顺序为___________ : 中的碳原子的杂化轨道类型为
中的碳原子的杂化轨道类型为___________ ;与 互为等电子体的分子是
互为等电子体的分子是___________ 。 中含
中含 键的数目为
键的数目为___________ 。
(2)汽车安全气囊气体发生剂一种组合主要有叠氮化钠( )、三氧化二铁(
)、三氧化二铁( )、硝酸铵(
)、硝酸铵( )。叠氢化钠收到撞击后产生气体并放出热量,硝酸铵吸收热量分解,金属钠与铁的氧化物反应。
)。叠氢化钠收到撞击后产生气体并放出热量,硝酸铵吸收热量分解,金属钠与铁的氧化物反应。 为
为___________ (共价化合物、离子化合物、), 中心原子杂化轨道类型为
中心原子杂化轨道类型为___________ 。
(3)羰基铁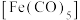 为分子构成的物质,可用作催化剂。据文献报道:
为分子构成的物质,可用作催化剂。据文献报道: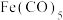 催化某反应的一种反应机理如下图所示。下列叙述错误的是___________。
催化某反应的一种反应机理如下图所示。下列叙述错误的是___________。
 (羰基铁),它们在生活生产中有广泛应用。
(羰基铁),它们在生活生产中有广泛应用。(1)实验室常用KSCN溶液、
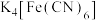 溶液、苯酚溶液检验
溶液、苯酚溶液检验 。N、O、S的第一电离能由大到小的顺序为
。N、O、S的第一电离能由大到小的顺序为 中的碳原子的杂化轨道类型为
中的碳原子的杂化轨道类型为 互为等电子体的分子是
互为等电子体的分子是 中含
中含 键的数目为
键的数目为(2)汽车安全气囊气体发生剂一种组合主要有叠氮化钠(
 )、三氧化二铁(
)、三氧化二铁( )、硝酸铵(
)、硝酸铵( )。叠氢化钠收到撞击后产生气体并放出热量,硝酸铵吸收热量分解,金属钠与铁的氧化物反应。
)。叠氢化钠收到撞击后产生气体并放出热量,硝酸铵吸收热量分解,金属钠与铁的氧化物反应。 为
为 中心原子杂化轨道类型为
中心原子杂化轨道类型为(3)羰基铁
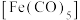 为分子构成的物质,可用作催化剂。据文献报道:
为分子构成的物质,可用作催化剂。据文献报道: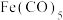 催化某反应的一种反应机理如下图所示。下列叙述错误的是___________。
催化某反应的一种反应机理如下图所示。下列叙述错误的是___________。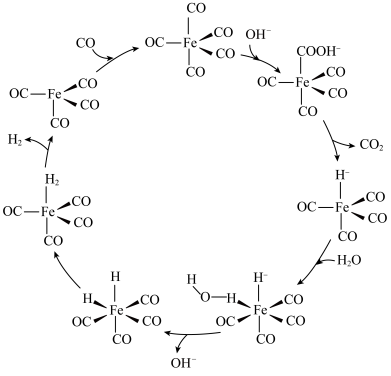
A. 参与了该催化循环 参与了该催化循环 | B.该反应可产生清洁燃料 |
C.该反应可消耗温室气体 | D.该催化循环中Fe的成键数目发生变化 |
您最近一年使用:0次
名校
4 . 表格为门捷列夫元素周期表的一部分,其中的编号代表对应的元素。用元素符号回答下列问题:
(1)基态F原子有___________ 种运动状态的电子。
(2)元素③⑪电负性较大的是___________ ﹔Se的原子结构示意图为___________ 。
(3)元素铬的基态原子的价电子排布式为:___________ 。
(4)Cu基态原子中,能量最高的电子占据的原子轨道的形状为___________ 。
(5)该表格中电负性最大的元素与第一电离能最小的元素形成的化合物的电子式为___________ 。
(6)②③的简单气态氢化物中较稳定的是___________ (填化学式),元素⑥⑦的最高价氧化物的水化物相互反应的离子方程式为___________ 。

(1)基态F原子有
(2)元素③⑪电负性较大的是
(3)元素铬的基态原子的价电子排布式为:
(4)Cu基态原子中,能量最高的电子占据的原子轨道的形状为
(5)该表格中电负性最大的元素与第一电离能最小的元素形成的化合物的电子式为
(6)②③的简单气态氢化物中较稳定的是
您最近一年使用:0次
名校
解题方法
5 . 由《物质结构与性质》第一、二章的知识回答下列问题:
(1)互为同分异构的两种物质分别为,a: 对羟基苯甲醛( ); b:邻羟基苯甲醛(
); b:邻羟基苯甲醛( ),则一般易形成分子间氢键的是
),则一般易形成分子间氢键的是___________ (填“a”或“b”),其沸点明显___________ (填“高于”或“低于”)另一同分异构体。
(2)已知Ti的第二电离能:I2(Ti)=1310 kJ·mol-1,K的第二电离能I2(K)=3051 kJ·mol-1,I2(Ti)≪I2(K),其原因为___________ 。
(3)Ni与Ca处于同一周期,且原子核外最外层电子数相同,但金属Ni的熔点和沸点均比金属Ca的高,其原因为___________ 。
(4)有下列物质:①HCHO ②O2 ③(NH4)2S ④P4 ⑤H2O2 ⑥MgSO4 ⑦CO2 ⑧C2H4,按要求填写相对应序号。
i.既含有极性键又含有非极性键的分子是___________ 。
ii.含极性键的离子化合物的是___________ 。
iii.①HCHO、⑤H2O2、⑦CO2 三种分子中,键角由大到小的顺序___________ 。
(1)互为同分异构的两种物质分别为,a: 对羟基苯甲醛(
 ); b:邻羟基苯甲醛(
); b:邻羟基苯甲醛( ),则一般易形成分子间氢键的是
),则一般易形成分子间氢键的是(2)已知Ti的第二电离能:I2(Ti)=1310 kJ·mol-1,K的第二电离能I2(K)=3051 kJ·mol-1,I2(Ti)≪I2(K),其原因为
(3)Ni与Ca处于同一周期,且原子核外最外层电子数相同,但金属Ni的熔点和沸点均比金属Ca的高,其原因为
(4)有下列物质:①HCHO ②O2 ③(NH4)2S ④P4 ⑤H2O2 ⑥MgSO4 ⑦CO2 ⑧C2H4,按要求填写相对应序号。
i.既含有极性键又含有非极性键的分子是
ii.含极性键的离子化合物的是
iii.①HCHO、⑤H2O2、⑦CO2 三种分子中,键角由大到小的顺序
您最近一年使用:0次
6 . 深入研究物质的微观结构,有利于理解物质变化的本质。请回答下列问题:
(1)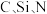 的电负性由大到小的顺序是
的电负性由大到小的顺序是___________ 。
(2)C、N、O、F的第一电离能由大到小的顺序是___________ 。
(3)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般而言,为 或
或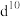 排布时,无颜色;为
排布时,无颜色;为 排布时,有颜色,如
排布时,有颜色,如 显粉红色。据此判断,
显粉红色。据此判断,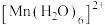
_________ 颜色(填“无”或“有”)。
(4)L的原子核外电子占有9个轨道,而且有一个未成对电子,L是___________ (填元素符号)。
(5) 能与
能与 形成正四面体形的配合物
形成正四面体形的配合物 ,
,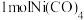 中含有
中含有__________  键。
键。
(1)
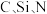 的电负性由大到小的顺序是
的电负性由大到小的顺序是(2)C、N、O、F的第一电离能由大到小的顺序是
(3)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般而言,为
 或
或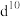 排布时,无颜色;为
排布时,无颜色;为 排布时,有颜色,如
排布时,有颜色,如 显粉红色。据此判断,
显粉红色。据此判断,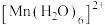
(4)L的原子核外电子占有9个轨道,而且有一个未成对电子,L是
(5)
 能与
能与 形成正四面体形的配合物
形成正四面体形的配合物 ,
,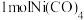 中含有
中含有 键。
键。
您最近一年使用:0次
名校
7 . 白铜是以镍为主要添加元素的铜基合金,呈银白色,有金属光泽,故名白铜。公元4世纪时东晋常璩的《华阳国志南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)文明中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)Ni2+的核外电子排布式为___________ ,3d能级上的未成对的电子数为___________ 。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是___________ 。
②在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为___________ ,提供孤电子对的成键原子是___________ 。(用元素符号表示)
③与氨互为等电子体的一种阳离子为___________ (填化学式);氨极易溶于H2O,除因为它们都是极性分子外,还因为___________ 。
(3)单质铜及镍都是由___________ 键形成的晶体,元素铜与镍的第二电离能分别为:Icu=1959kJ/mol,INi=1753kJ/mol,Icu> INi的原因是___________ 。
(1)Ni2+的核外电子排布式为
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是
②在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为
③与氨互为等电子体的一种阳离子为
(3)单质铜及镍都是由
您最近一年使用:0次
名校
8 . Zn2+、三乙撑二胺和对苯二甲酸根离子可形成晶体M,其晶胞示意图如图。
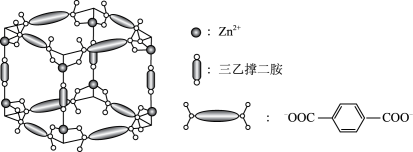
(1)Zn2+的价层电子排布式是_____ 。
(2)C、N、O的电负性从大到小 的顺序是_____ ;C、N、O的第一电离能从大到小 的顺序是_____ 。
(3)三乙撑二胺(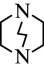 )与
)与 能形成配位键的原因是
能形成配位键的原因是_____ 。
(4)下列事实可用“水分子间存在氢键”解释的是_____ (填字母序号 )。
a.常压下,4℃时水的密度最大
b.水的沸点比硫化氢的沸点高160℃
c.水的热稳定性比硫化氢强
(5)对苯二甲酸(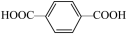 )中苯环上的碳原子的杂化方式为
)中苯环上的碳原子的杂化方式为_____ ,羧基上碳原子的杂化方式为____ ,对苯二甲酸中最多有_____ 个原子共平面。

(1)Zn2+的价层电子排布式是
(2)C、N、O的电负性
(3)三乙撑二胺(
 )与
)与 能形成配位键的原因是
能形成配位键的原因是(4)下列事实可用“水分子间存在氢键”解释的是
a.常压下,4℃时水的密度最大
b.水的沸点比硫化氢的沸点高160℃
c.水的热稳定性比硫化氢强
(5)对苯二甲酸(
 )中苯环上的碳原子的杂化方式为
)中苯环上的碳原子的杂化方式为
您最近一年使用:0次
解题方法
9 . 铜在工业中有重要作用,铜元素是人体必需的微量元素。回答下列问题:
(1)Cu元素在元素周期表中位于______ (填“s”、“p”、“d”或“ds”)区。
(2)下列说法正确的是_____ (填标号)。
(3)黄铜是人类广泛使用的合金之一,主要由Zn和Cu组成。第二电离能:I2(Zn)_____ (填“>”或“<”) I2(Cu),原因为______ 。
(4)铜锈的主要成分为Cu2(OH)2CO3,该化合物中CO 的空间结构为
的空间结构为_____ ,键角为_____ ,写出一种与CO 具有相同空间结构的化合物的化学式:
具有相同空间结构的化合物的化学式:_____ 。
(1)Cu元素在元素周期表中位于
(2)下列说法正确的是
| A.金属在常温下均为固体 | B.能导电的物质均为金属 |
| C.金属键没有饱和性和方向性 | D.有金属光泽的晶体一定是金属晶体 |
(4)铜锈的主要成分为Cu2(OH)2CO3,该化合物中CO
 的空间结构为
的空间结构为 具有相同空间结构的化合物的化学式:
具有相同空间结构的化合物的化学式:
您最近一年使用:0次
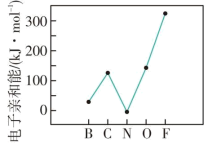
10 . 元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能( )。
)。
(1)第二周期部分元素的 变化趋势如图所示,其中除氮元素外,其他元素的
变化趋势如图所示,其中除氮元素外,其他元素的 自左而右依次增大。而氮元素的
自左而右依次增大。而氮元素的 呈现异常的原因是
呈现异常的原因是___________ 。
(2) 是离子化合物,下图是Born−Haber循环。
是离子化合物,下图是Born−Haber循环。
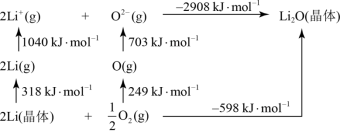
可知,Li原子的第一电离能为___________  ,
, 键键能为
键键能为___________  。
。
 )。
)。(1)第二周期部分元素的
 变化趋势如图所示,其中除氮元素外,其他元素的
变化趋势如图所示,其中除氮元素外,其他元素的 自左而右依次增大。而氮元素的
自左而右依次增大。而氮元素的 呈现异常的原因是
呈现异常的原因是
(2)
 是离子化合物,下图是Born−Haber循环。
是离子化合物,下图是Born−Haber循环。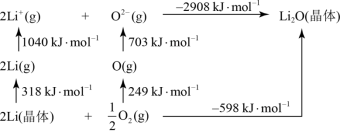
可知,Li原子的第一电离能为
 ,
, 键键能为
键键能为 。
。
您最近一年使用:0次



