解题方法
1 . 第VA族元素在化学领域具有重要的地位。请回答下列问题:N是第VA族原子半径最小的元素,基态氮原子的价电子轨道表示式为_______ ;NH3分子的空间结构名称为_______ ,中心原子的杂化轨道类型为_______ ;C、N、O三种元素第一电离能由大到小的顺序是_______ 。P和N电负性大小比较_______ 。
您最近一年使用:0次
2 . 铜及其化合物在科学研究和工业生产中具有许多用途。请回答下列问题:
(1)写出基态Cu原子的价层电子排布式___________ ;
(2)配合物[Cu(NH3)2]OOCCH3中配体是___________ ,配体中提供孤对电子对的原子是__ 。C、N、O三元素的第一电离能由大到小的顺序是___________ (用元素符号表示)。
(3)铜晶体中铜原子的堆积方式如图1,2所示,则晶体铜原子的堆积方式为___________ 。
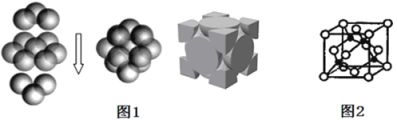
(1)写出基态Cu原子的价层电子排布式
(2)配合物[Cu(NH3)2]OOCCH3中配体是
(3)铜晶体中铜原子的堆积方式如图1,2所示,则晶体铜原子的堆积方式为

您最近一年使用:0次
解题方法
3 . N、O、S、Cl、Cu五种元素的单质及其化合物在现代工业生产中有着广泛应用。请回答下列问题:
(1)第一电离能:N_____ O(填“ ”或“
”或“ ”,下同),电负性:S
”,下同),电负性:S____ Cl。
(2) 的沸点比
的沸点比 高的原因是
高的原因是___________ ; 属于
属于________ (填“极性”或“非极性”)分子,
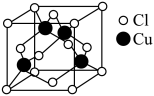
(3)Cu与Cl形成化合物的晶胞如图所示。该晶体的化学式为________ 。
(1)第一电离能:N
 ”或“
”或“ ”,下同),电负性:S
”,下同),电负性:S(2)
 的沸点比
的沸点比 高的原因是
高的原因是 属于
属于(3)Cu与Cl形成化合物的晶胞如图所示。该晶体的化学式为

您最近一年使用:0次
名校
4 . (1)某元素的全部电离能(单位:eV)如下:
写出该元素价电子轨道表示式_______________ 。
(2)分子中的大π 键可用符号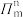 表示,其中 m 代表参与形成大 π 键的原子数,n 代表参与形成大π 键的电子数,如苯分子中的大 π 键可表示为
表示,其中 m 代表参与形成大 π 键的原子数,n 代表参与形成大π 键的电子数,如苯分子中的大 π 键可表示为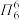 。
。
①试判断 SO2 最外层一共有_______________ 对孤对电子。
②HN3称为叠氮酸,常温下为无色有刺激性气味的液体。N3-的键角为_______________ ,N 中的大π 键应表示为
中的大π 键应表示为_______________ 。
(3)根据对角线规则,Be、Al 的化学性质相似,写出 Be(OH)2 与 NaOH 反应的离子方程式是________________________________ 。
| I1 | I2 | I3 | I4 | I5 | I6 | I7 | I8 |
| 13.6 | 35.1 | 54.9 | 77.4 | 113.9 | 138.1 | 739.1 | 871.1 |
写出该元素价电子轨道表示式
(2)分子中的大π 键可用符号
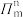 表示,其中 m 代表参与形成大 π 键的原子数,n 代表参与形成大π 键的电子数,如苯分子中的大 π 键可表示为
表示,其中 m 代表参与形成大 π 键的原子数,n 代表参与形成大π 键的电子数,如苯分子中的大 π 键可表示为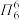 。
。①试判断 SO2 最外层一共有
②HN3称为叠氮酸,常温下为无色有刺激性气味的液体。N3-的键角为
 中的大π 键应表示为
中的大π 键应表示为(3)根据对角线规则,Be、Al 的化学性质相似,写出 Be(OH)2 与 NaOH 反应的离子方程式是
您最近一年使用:0次
5 . 如图是部分元素原子的第一电离能I1随原子序数变化的曲线图。

请回答以下问题:
(1)认真分析图中同周期元素第一电离能的变化规律,将Na~Ar之间六种元素用短线连接起来,构成完整的图象。____________________
(2)由图分析可知,同一主族元素原子的第一电离能I1变化规律是____________________ 。
(3)图中5号元素在周期表中的位置是________ 周期________ 族。
(4)图中出现的元素中最活泼的金属元素位于元素周期表的________ 周期________ 族。
(5)写出图中6号元素的价电子排布式:________ 。
(6)分析图中同周期元素第一电离能的变化规律,推断Na~Ar元素中,Al的第一电离能的大小范围________ <Al<________ (填元素符号)。

请回答以下问题:
(1)认真分析图中同周期元素第一电离能的变化规律,将Na~Ar之间六种元素用短线连接起来,构成完整的图象。
(2)由图分析可知,同一主族元素原子的第一电离能I1变化规律是
(3)图中5号元素在周期表中的位置是
(4)图中出现的元素中最活泼的金属元素位于元素周期表的
(5)写出图中6号元素的价电子排布式:
(6)分析图中同周期元素第一电离能的变化规律,推断Na~Ar元素中,Al的第一电离能的大小范围
您最近一年使用:0次
2019-08-04更新
|
438次组卷
|
8卷引用:海南省三亚华侨学校(南新校区)2020-2021学年高二下学期3月月考化学试jgh同
海南省三亚华侨学校(南新校区)2020-2021学年高二下学期3月月考化学试jgh同云南省鹤庆三中2018-2019学年高二下学期期末考试化学试题云南省屏边县民族中学2019-2020学年高二上学期12月月考化学试题云南省镇康县第一中学2019-2020学年高二12月月考化学试题云南省永平县第二中学2019-2020学年高二上学期期末考试化学试题云南省普洱市孟连县第一中学2019—2020学年高二上学期期末考试化学试题鲁科版2019选择性必修2第1章 原子结构与元素性质 第3节 元素性质及其变化规律 第1课时 原子半径 元素的电离能(人教版2019)选择性必修2第一章 原子结构与性质 第二节 原子结构与元素的性质 第2课时 原子半径、元素的电离能及其变化规律
6 . 东晋《华阳国志·南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素基态原子的电子排布式为______ ,3d能级上的未成对电子数为_______ 。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是________ 。
②在[Ni(NH3)6]SO4中Ni2+与NH3之间形成的化学键称为_______ ,提供孤电子对的成键原子是________ 。
(3)单质铜及镍都是由______ 键形成的晶体;元素铜与镍的第二电离能分别为:ICu=1 958 kJ·mol–1、INi=1 753 kJ·mol–1,ICu> INi的原因是_______________________ 。
(1)镍元素基态原子的电子排布式为
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是
②在[Ni(NH3)6]SO4中Ni2+与NH3之间形成的化学键称为
(3)单质铜及镍都是由
您最近一年使用:0次
7 . (1)C、N、O、Al、Si、Cu是常见的六种元素。
①Si位于元素周期表第________ 周期第________ 族。
②C的基态原子核外电子排布式为________ ;Cu的基态原子最外层有________ 个电子。
(2)①N、Al、Si、Zn四种元素中,有一种元素的电离能数据如下:
则该元素是________ (填写元素符号)。
②基态锗(Ge)原子的电子排布式是________ 。Ge的最高价氯化物的分子式是________ 。
③Ge元素可能的性质或应用有________ 。
A.是一种活泼的金属元素 B.其电负性大于硫
C.其单质可作为半导体材料 D.其最高价氯化物的沸点低于其溴化物的沸点
①Si位于元素周期表第
②C的基态原子核外电子排布式为
(2)①N、Al、Si、Zn四种元素中,有一种元素的电离能数据如下:
| 电离能 | I1 | I2 | I3 | I4 | …… |
| In/(kJ·mol-1) | 578 | 1 817 | 2 745 | 11 578 | …… |
则该元素是
②基态锗(Ge)原子的电子排布式是
③Ge元素可能的性质或应用有
A.是一种活泼的金属元素 B.其电负性大于硫
C.其单质可作为半导体材料 D.其最高价氯化物的沸点低于其溴化物的沸点
您最近一年使用:0次
8 . (1)元素C、N、O、K的电负性从大到小依次为______ 。
(2)CH4中共用电子对偏向C,SiH4中共用电子对偏向H,则C、Si、H的电负性由大到小的顺序为______ 。
(3)下图是周期表中短周期的一部分,A的单质是空气中含量最多的物质,其中第一电离能最小的元素是______ (填“A”“B”“C”或“D”)。

(4)氮化硼(BN)是一种重要的功能陶瓷材料。基态B原子的电子排布式为______ ;B和N相比,电负性较大的是______ ,BN中B元素的化合价为______ 。
(2)CH4中共用电子对偏向C,SiH4中共用电子对偏向H,则C、Si、H的电负性由大到小的顺序为
(3)下图是周期表中短周期的一部分,A的单质是空气中含量最多的物质,其中第一电离能最小的元素是

(4)氮化硼(BN)是一种重要的功能陶瓷材料。基态B原子的电子排布式为
您最近一年使用:0次
2019-07-07更新
|
183次组卷
|
3卷引用:海南省三亚华侨学校(南新校区)2020-2021学年高二下学期3月月考化学试jgh同
名校
9 . 请填空:
(1)A元素基态原子的最外层有2个未成对电子,次外层有2个电子,其元素符号为____________ 。
(2)B元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,B的元素号为__________ ,其正二价离子的电子排布式为____________________ 。
(3)C元素的原子最外层电子排布式为nsnnpn+1,则n=________ ;原子中能量最高的是________ 电子。
(4)第三周期中,第一电离能最小的元素是_________ ,第一电离能最大的元素是_________ 。
(5)在元素周期表中,电负性最大的元素是_________ ,第二、三周期p轨道半充满的元素是_________ 。
(6)离子化合物NaCl、KCl和RbCl的熔点由高到低的顺序是___________ 。
(7)写出一种由短周期元素中能组成原子晶体的化合物的化学式_________ 。
(1)A元素基态原子的最外层有2个未成对电子,次外层有2个电子,其元素符号为
(2)B元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,B的元素号为
(3)C元素的原子最外层电子排布式为nsnnpn+1,则n=
(4)第三周期中,第一电离能最小的元素是
(5)在元素周期表中,电负性最大的元素是
(6)离子化合物NaCl、KCl和RbCl的熔点由高到低的顺序是
(7)写出一种由短周期元素中能组成原子晶体的化合物的化学式
您最近一年使用:0次
2017-06-15更新
|
347次组卷
|
2卷引用:海南热带海洋学院附属中学2021-2022学年高二下学期第一次月考化学试题



