1 . 磷及其化合物在生产、生活中具有广泛的用途,回答下列问题:
(1)白磷(结构如图所示)在潮湿的空气中发生缓慢氧化,在40℃左右即可自燃。

①白磷( )的相对分子质量为
)的相对分子质量为___________ 。
②基态P原子中成对电子数与未成对电子数之比为___________ 。
③基态P原子中能量最高的电子所占据原子轨道的电子云轮廓图为___________ 形。
(2)磷及其部分重要化合物的相互转化如图所示。

①基态钙原子的简化电子排布式为___________ 。
②第一电离能:Si___________ (填“>”“<”或“=”)C。
③ 和
和 的组成元素相同,但二者的性质不完全相同,其原因为
的组成元素相同,但二者的性质不完全相同,其原因为___________ 。
④常温下, 与少量
与少量 溶液反应的化学方程式为
溶液反应的化学方程式为___________ 。
(3)反应Ⅲ的离子方程式为___________ (已知: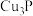 不溶于水)。
不溶于水)。
(1)白磷(结构如图所示)在潮湿的空气中发生缓慢氧化,在40℃左右即可自燃。

①白磷(
 )的相对分子质量为
)的相对分子质量为②基态P原子中成对电子数与未成对电子数之比为
③基态P原子中能量最高的电子所占据原子轨道的电子云轮廓图为
(2)磷及其部分重要化合物的相互转化如图所示。

①基态钙原子的简化电子排布式为
②第一电离能:Si
③
 和
和 的组成元素相同,但二者的性质不完全相同,其原因为
的组成元素相同,但二者的性质不完全相同,其原因为④常温下,
 与少量
与少量 溶液反应的化学方程式为
溶液反应的化学方程式为(3)反应Ⅲ的离子方程式为
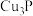 不溶于水)。
不溶于水)。
您最近一年使用:0次
解题方法
2 . MnS纳米粒子被广泛应用于除去重金属离子中的镉离子。
(1)锰的价层电子排布式为__________ 。
(2)磁性氧化铁纳米粒子除镉效率不如MnS纳米粒子,试比较两种纳米材料中的阴离子的半径大小
__________  (填>、<或=)。
(填>、<或=)。 中
中 的键角比
的键角比 中的
中的__________ (填大或小)
(3)Mn可以形成多种配合物, 中第二周期元素第一电离能由大到小关系为
中第二周期元素第一电离能由大到小关系为__________ ,配体 中心原子杂化类型为
中心原子杂化类型为__________ 配体 的空间构型为
的空间构型为__________ (用文字描述)。
(1)锰的价层电子排布式为
(2)磁性氧化铁纳米粒子除镉效率不如MnS纳米粒子,试比较两种纳米材料中的阴离子的半径大小

 (填>、<或=)。
(填>、<或=)。 中
中 的键角比
的键角比 中的
中的(3)Mn可以形成多种配合物,
 中第二周期元素第一电离能由大到小关系为
中第二周期元素第一电离能由大到小关系为 中心原子杂化类型为
中心原子杂化类型为 的空间构型为
的空间构型为
您最近一年使用:0次
3 . 回答下列问题
(1)下列状态的镁中,电离最外层一个电子所需能量最大的是_______(填标号)。
(2)Fe成为阳离子时首先失去_______ 轨道电子,Sm的价层电子排布式为4f66s2,Sm3+价层电子排布式为_______ 。
(3)Cu2+基态核外电子排布式为_______ 。
(4)Mn位于元素周期表中第四周期_______ 族,基态Mn原子核外未成对电子有_______ 个。
(5)基态Cl原子有_______ 种空间运动状态的电子,基态原子价电子排布式_______ ,属于_______ 区(填“s”或“p”或“d”或“f”)
(6)LiBH4由Li+和BH 构成,与BH
构成,与BH 互为等电子体的分子为
互为等电子体的分子为_______ ,Li、Be、B元素的电离能由大到小排列顺序为_______ 。
(7)1 mol HCHO分子中含有σ键的数目为_______ NA,CS2分子中,存在_______ 个 键和
键和_______ 个 键。
键。
(1)下列状态的镁中,电离最外层一个电子所需能量最大的是_______(填标号)。
A.[Ne] 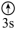 | B.[Ne] 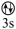 | C.[Ne]  | D.[Ne]  |
(3)Cu2+基态核外电子排布式为
(4)Mn位于元素周期表中第四周期
(5)基态Cl原子有
(6)LiBH4由Li+和BH
 构成,与BH
构成,与BH 互为等电子体的分子为
互为等电子体的分子为(7)1 mol HCHO分子中含有σ键的数目为
 键和
键和 键。
键。
您最近一年使用:0次
名校
4 . 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验。
I.用元素符号表示
(1)将钠、镁、铝各2g分别投入盛足量0.05mol/L盐酸烧杯中,实验结果:____ 与盐酸反应最剧烈;_____ 与盐酸反应转移电子最多。钠、镁、铝中第一电离能由小到大的顺序是_____ 。
(2)向Na2SiO3溶液中通入CO2出现胶状沉淀,可证明____ 元素得电子能力强,反应的离子方程式为_______ 。实验结论:随原子序数增大,同周期元素失电子能力依次_______ (填“增强”或“减弱”,下同),得电子能力依次_______ 。
II.利用如图装置可验证同主族元素非金属性的变化规律。
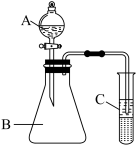
(3)仪器A的名称为_______ 。
(4)若要证明非金属性:Cl>Br,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加KBr溶液和CCl4反应一段时间后,将C振荡、静置,观察到C中现象是_______ ,此装置存在的不足之处是_______ 。
I.用元素符号表示
(1)将钠、镁、铝各2g分别投入盛足量0.05mol/L盐酸烧杯中,实验结果:
(2)向Na2SiO3溶液中通入CO2出现胶状沉淀,可证明
II.利用如图装置可验证同主族元素非金属性的变化规律。

(3)仪器A的名称为
(4)若要证明非金属性:Cl>Br,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加KBr溶液和CCl4反应一段时间后,将C振荡、静置,观察到C中现象是
您最近一年使用:0次
5 . 下表为长式周期表的一部分,其中的编号代表对应的元素。
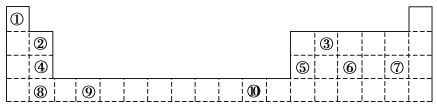
请回答下列问题:
(1)表中属于d区元素的是___________ (填元素符号)。
(2)表中元素①的6个原子与元素③的6个原子形成的某种环状分子名称为___________ ;③和⑦形成的一种常见溶剂的化学式为___________ 。
(3)元素④的第一电离能___________ 元素⑤(选填“>”、“=”或“<”)的第一电离能;元素⑥的电负性___________ 元素⑦(选填“>”、“=”或“<”)的电负性。
(4)某些不同族元素的性质也有一定的相似性,如上表中元素②与元素⑤的氢氧化物有相似的性质。请写出元素②的氢氧化物与NaOH溶液反应的化学方程式:___________

请回答下列问题:
(1)表中属于d区元素的是
(2)表中元素①的6个原子与元素③的6个原子形成的某种环状分子名称为
(3)元素④的第一电离能
(4)某些不同族元素的性质也有一定的相似性,如上表中元素②与元素⑤的氢氧化物有相似的性质。请写出元素②的氢氧化物与NaOH溶液反应的化学方程式:
您最近一年使用:0次
6 . 下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素:

(1)K的元素名称为___________ 。
(2)基态时Q元素原子的电子排布式___________ ,
(3)下列对比正确的是___________ 。
a.原子半径H>G>B>A b.第一电离能E>D>C>B
c.电负性A>H>G>Q d.最高价氧化物的水化物酸性B>A>H>G
(4)由P、A、C三种元素形成的某化合物,对氢气的相对密度为15,则该分子的键角约为___________ 。
(5)元素B和C的气态氢化物热稳定性较强的是___________ (填化学式)。

(1)K的元素名称为
(2)基态时Q元素原子的电子排布式
(3)下列对比正确的是
a.原子半径H>G>B>A b.第一电离能E>D>C>B
c.电负性A>H>G>Q d.最高价氧化物的水化物酸性B>A>H>G
(4)由P、A、C三种元素形成的某化合物,对氢气的相对密度为15,则该分子的键角约为
(5)元素B和C的气态氢化物热稳定性较强的是
您最近一年使用:0次
2021-05-07更新
|
372次组卷
|
3卷引用:内蒙古自治区赤峰市赤峰二中2020-2021学年高二下学期第二次月考化学试题
内蒙古自治区赤峰市赤峰二中2020-2021学年高二下学期第二次月考化学试题福建省福清西山学校高中部2020-2021学年高二下学期期中考试化学试题(已下线)作业02 原子结构与元素的性质-2021年高二化学暑假作业(人教版2019)
7 . 2020年,智能材料已大量涌现,为生物医疗、国防军事以及航空航天等领域发展提供支撑。
(1)快离子导体是具有优良离子导电能力的固体电解质。反应 BF3+NH3= NH3·BF3的产物分子中形成配位键提供孤电子对的配位原子名称是___ ;采取sp3杂化轨道形成化学键的原子符号是___ 。
(2)第三代半导体材料氮化镓(GaN)适合于制作高温、高频、抗辐射及大功率器件,通常称为高温半导体材料。基态Ga原子最高能层的电子数为________ ,第一电离能介于硼和氮之间的第二周期元素有_____ 种。
(3)金属钛性能优越,被誉为继Fe、Al后应用广泛的“第三金属”。钛(Ti)在元素周期表中位于___ 区,钛(Ti)的基态原子M能层中有___ 种能量不同的电子。
(4)镍能形成多种配合物,如正四面体形的Ni(CO)4和正方形的[Ni(CO)4]2-、正八面体形的[Ni(NH3)6]2+等。下列说法正确的有___ (填标号)。
A CO与N2互为等电子体,其中CO分子内σ键和π键个数之比为1:2
B NH3的空间构型为平面三角形
C Ni2+在形成配合物时,其配位数只能为4
D Ni(CO)4和[Ni(CO)4]2-中,镍元素均是sp3杂化
(5)一种四方结构的超导化合物汞钡铜氧晶体的晶胞如图所示。

则汞钡铜氧晶体的密度为____ g•cm-3(设NA为阿伏加 德罗常数的值)。
(1)快离子导体是具有优良离子导电能力的固体电解质。反应 BF3+NH3= NH3·BF3的产物分子中形成配位键提供孤电子对的配位原子名称是
(2)第三代半导体材料氮化镓(GaN)适合于制作高温、高频、抗辐射及大功率器件,通常称为高温半导体材料。基态Ga原子最高能层的电子数为
(3)金属钛性能优越,被誉为继Fe、Al后应用广泛的“第三金属”。钛(Ti)在元素周期表中位于
(4)镍能形成多种配合物,如正四面体形的Ni(CO)4和正方形的[Ni(CO)4]2-、正八面体形的[Ni(NH3)6]2+等。下列说法正确的有
A CO与N2互为等电子体,其中CO分子内σ键和π键个数之比为1:2
B NH3的空间构型为平面三角形
C Ni2+在形成配合物时,其配位数只能为4
D Ni(CO)4和[Ni(CO)4]2-中,镍元素均是sp3杂化
(5)一种四方结构的超导化合物汞钡铜氧晶体的晶胞如图所示。

则汞钡铜氧晶体的密度为
您最近一年使用:0次
2020-07-27更新
|
457次组卷
|
3卷引用:内蒙古自治区赤峰市赤峰二中2020-2021学年高二下学期第二次月考化学试题
名校
8 . (1)写出铜原子价电子排布式:______ 。与铜同一周期的副族元素原子中最外层电子数与铜原子的相同的元素有________ (填元素符号)。
(2)第三周期第一电离能处于Al和P之间的元素有______ 种。
(3)某种原子的结构示意图为 。则该原子的核电荷数x取值范围为
。则该原子的核电荷数x取值范围为______ 。
(4)Cr在周期表中位于_____ 周期___ 族,属于___ 区,价电子排布图为______
(5)ClO4-互为等电子体的分子或离子为____ 。
(6)Ni与CO能形成配合物Ni(CO)4,该分子中π键与σ键个数比为_____ 。
(2)第三周期第一电离能处于Al和P之间的元素有
(3)某种原子的结构示意图为
 。则该原子的核电荷数x取值范围为
。则该原子的核电荷数x取值范围为(4)Cr在周期表中位于
(5)ClO4-互为等电子体的分子或离子为
(6)Ni与CO能形成配合物Ni(CO)4,该分子中π键与σ键个数比为
您最近一年使用:0次
9 . Q、X、Y、Z、W 五种元素的原子序数依次递增,W 为第四周期元素,其余均为短周期主族元素,已知:
①Q原子的最外层电子数是次外层电子数的2 倍
②Y、Z同主族,Y原子价电子排布图为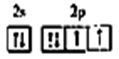 ;
;
③W元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子。
请回答下列问题:
(1)基态Q 原子中,电子运动状态有_____ 种,电子占据的最高能级符号为_____ ,该能级含有的轨道数为________
(2)W的元素名称为_____ ,其基态原子的电子排布式为________
(3)具有相同价电子数和相同原子数的分子或离子具有相同的结构特征,这一原理称为“等电子原理”,五种元素中电负性最强的非金属元素形成的一种单质A 与Y、Z 形成的化合物B 是等电子体物质,A、B分子式分别为______ 、_______ 。
(4)Q、X、Y三种元素的第一电离能数值最大的是_____ (用元素符号作答),原因是______________________________
①Q原子的最外层电子数是次外层电子数的2 倍
②Y、Z同主族,Y原子价电子排布图为
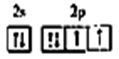 ;
;③W元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子。
请回答下列问题:
(1)基态Q 原子中,电子运动状态有
(2)W的元素名称为
(3)具有相同价电子数和相同原子数的分子或离子具有相同的结构特征,这一原理称为“等电子原理”,五种元素中电负性最强的非金属元素形成的一种单质A 与Y、Z 形成的化合物B 是等电子体物质,A、B分子式分别为
(4)Q、X、Y三种元素的第一电离能数值最大的是
您最近一年使用:0次
名校
10 . 根据下列四种元素的第一至第四电离能数据(单位:kJ/mol),回答下面各题:
(1)在周期表中,最可能处于同一族的是___________
A.S和U B.S和T C.T和U D.R和T E.R和U
(2)T的氯化物的化学式为___________________
(3)如果U元素是短周期的元素,你估计它的第2次电离能飞跃数据将是第_____ 个。
(4)如果R、S、T是同周期的三种主族元素,则它们的原子序数由小到大的顺序是_________ ,其中元素_______ 的第一电离能反常高的原因是_____________ 。
| 元素代号 | I1 | I2 | I3 | I4 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| U | 420 | 3100 | 4400 | 5900 |
(1)在周期表中,最可能处于同一族的是
A.S和U B.S和T C.T和U D.R和T E.R和U
(2)T的氯化物的化学式为
(3)如果U元素是短周期的元素,你估计它的第2次电离能飞跃数据将是第
(4)如果R、S、T是同周期的三种主族元素,则它们的原子序数由小到大的顺序是
您最近一年使用:0次



