名校
1 . 砷化镓(GaAs)是当前最重要、技术成熟度最高的半导体材料之一,我国“玉兔二号”月球车就是通过砷化镓太阳能电池提供能量。
(1)GaAs、GaN结构相似,晶体类型都为共价晶体,沸点GaAs___________ GaN(填“>”或“<”,下同),第一电离能Ga___________ As。
(2)成语“信口雌黄”中雌黄的分子式为 ,分子结构如图,As原子的杂化方式为
,分子结构如图,As原子的杂化方式为___________ 。

(3)GaAs的晶胞结构如图,在GaAs晶体中,与As原子最近且等距离的As原子数为___________ 。

(1)GaAs、GaN结构相似,晶体类型都为共价晶体,沸点GaAs
(2)成语“信口雌黄”中雌黄的分子式为
 ,分子结构如图,As原子的杂化方式为
,分子结构如图,As原子的杂化方式为
(3)GaAs的晶胞结构如图,在GaAs晶体中,与As原子最近且等距离的As原子数为

您最近一年使用:0次
2 . M、Q、R、X、Y为原子序数依次增大的短周期主族元素。M原子核外电子有6种运动状态,R和X同主族。Z、W是第四周期的过渡元素,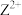 的核外d电子数是
的核外d电子数是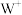 的核外d电子数的一半,
的核外d电子数的一半,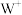 核外没有未成对电子。请回答下列问题:
核外没有未成对电子。请回答下列问题:
(1)基态Z原子的核外电子排布式为________ ,该元素位于________ 区。
(2)M、Q和R的第一电离能由小到大的顺序是________ (用元素符号表示)。
(3)比较简单离子的半径: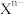
________  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(4)气态时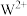 比
比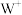
________ (填“稳定”或“不稳定”),原因是________ 。
(5)基态Y原子核外电子的空间运动状态有________ 种,与其同主族且位于第四周期元素的价层电子轨道表示式为________ 。
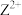 的核外d电子数是
的核外d电子数是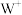 的核外d电子数的一半,
的核外d电子数的一半,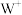 核外没有未成对电子。请回答下列问题:
核外没有未成对电子。请回答下列问题:(1)基态Z原子的核外电子排布式为
(2)M、Q和R的第一电离能由小到大的顺序是
(3)比较简单离子的半径:
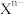
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。(4)气态时
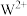 比
比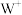
(5)基态Y原子核外电子的空间运动状态有
您最近一年使用:0次
2024-01-11更新
|
379次组卷
|
2卷引用:安徽省马鞍山市第二中学2023-2024学年高二下学期开学考试化学试题
3 . 根据已学知识,请回答下列问题:
(1)基态N原子中,核外电子占据的最高能层的符号是_______ ,占据该能层电子的原子轨道形状为_______ 。
(2)写出3p轨道上有2个未成对电子的元素的符号:_______ 。
(3)已知铁是26号元素,写出Fe的价层电子排布式:_______ ;
(4)从原子结构的角度分析B、N和O的第一电离能由大到小的顺序为_______ ,电负性由大到小的顺序是_______ 。
(5)Zn2+的核外电子排布式为_______ 。
(1)基态N原子中,核外电子占据的最高能层的符号是
(2)写出3p轨道上有2个未成对电子的元素的符号:
(3)已知铁是26号元素,写出Fe的价层电子排布式:
(4)从原子结构的角度分析B、N和O的第一电离能由大到小的顺序为
(5)Zn2+的核外电子排布式为
您最近一年使用:0次
4 . 我国科学家在月壤中发现新矿物,并命名为“嫦娥石”,其中一种物质的化学式为 。回答下列问题:
。回答下列问题: 中电负性最大的元素是
中电负性最大的元素是_______ ,该元素的原子最高能级上电子的电子云轮廓形状为_______ ,基态钙原子的核外电子排布式为_______ 。
(2)沸点: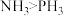 的原因是
的原因是_______ , 结构如图,则
结构如图,则 是
是_______ (填“极性”或“非极性”)分子, 中磷原子的杂化类型是
中磷原子的杂化类型是_______ ,键角:
_______ (填“>”或“<”) 。
。
(3)已知钠、镁的几组电离能(kJ∙mol−1)数据如下表所示。
第二电离能( ):
): 的原因是
的原因是_______ 。
 。回答下列问题:
。回答下列问题: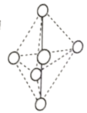
 中电负性最大的元素是
中电负性最大的元素是(2)沸点:
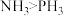 的原因是
的原因是 结构如图,则
结构如图,则 是
是 中磷原子的杂化类型是
中磷原子的杂化类型是
 。
。(3)已知钠、镁的几组电离能(kJ∙mol−1)数据如下表所示。
| 元素 |  |  |  |
| Na | 496 | 4562 | 6912 |
| Mg | 738 | 1451 | 7733 |
 ):
): 的原因是
的原因是
您最近一年使用:0次
名校
解题方法
5 . 氨硼烷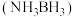 含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。回答下列问题:
含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。回答下列问题:
(1)基态N原子的价电子轨道表示式为_______ ,基态N原子中电子占据最高能级的电子云轮廓图为_______ 形; 分子中存在配位键,提供空轨道的原子是
分子中存在配位键,提供空轨道的原子是_______ ,分子中的N原子杂化方式为_______ 。
(2)B元素在周期表中的位置_______ ,B的第一电离能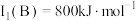 ,判断
,判断
_______  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(3) 分子中,与N原子相连的H呈正电性
分子中,与N原子相连的H呈正电性 ,与B原子相连的H呈负电性
,与B原子相连的H呈负电性 。在H、B、N三种元素中:电负性由大到小的顺序是
。在H、B、N三种元素中:电负性由大到小的顺序是_______ 。
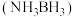 含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。回答下列问题:
含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。回答下列问题:(1)基态N原子的价电子轨道表示式为
 分子中存在配位键,提供空轨道的原子是
分子中存在配位键,提供空轨道的原子是(2)B元素在周期表中的位置
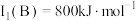 ,判断
,判断
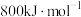 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(3)
 分子中,与N原子相连的H呈正电性
分子中,与N原子相连的H呈正电性 ,与B原子相连的H呈负电性
,与B原子相连的H呈负电性 。在H、B、N三种元素中:电负性由大到小的顺序是
。在H、B、N三种元素中:电负性由大到小的顺序是
您最近一年使用:0次
22-23高二下·安徽·期中
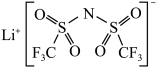
6 . 最近,科学家发现对LiTFSI(一种亲水有机盐,结构如下图所示)进行掺杂和改进,能显著提高锂离子电池传输电荷的能力。
请回答下列问题:
(1)若同学将基态氮原子的电子排布图画为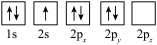 ,该排布图违背的规则有
,该排布图违背的规则有___________ 。
(2)LiTFSI中所含元素中,电负性最大的三种元素电负性由小到大的顺序为___________ (填元素符号,下同);LiTFSI中的第二周期非金属元素第一电离能由小到大的顺序为___________ 。
(3)LiTFSI中存在的化学键有___________ 。
a.离子键 b.极性键 c.金属键 d.氢键
(4)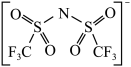 中氮原子的杂化类型为
中氮原子的杂化类型为___________ 。
(5)常见的含硫微粒有: 、
、 、
、 、
、 、
、 等,其中
等,其中 的空间构型为
的空间构型为___________ ; 、
、 中键角较大的是
中键角较大的是___________ 。

请回答下列问题:
(1)若同学将基态氮原子的电子排布图画为
 ,该排布图违背的规则有
,该排布图违背的规则有(2)LiTFSI中所含元素中,电负性最大的三种元素电负性由小到大的顺序为
(3)LiTFSI中存在的化学键有
a.离子键 b.极性键 c.金属键 d.氢键
(4)
 中氮原子的杂化类型为
中氮原子的杂化类型为(5)常见的含硫微粒有:
 、
、 、
、 、
、 、
、 等,其中
等,其中 的空间构型为
的空间构型为 、
、 中键角较大的是
中键角较大的是
您最近一年使用:0次
7 . 第二周期元素与日常生活密切相关,许多科学家因研究这些元素的相关生化内容而荣获诺贝尔奖。请回答下列问题:
(1)下列硼原子电子排布图表示的状态中,能量最低和最高的分别为_______ 、_______ (填选项字母)。
A.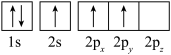 B.
B. 
C.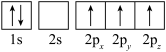 D.
D. 
(2)硼酸(H3BO3)为一元弱酸,靠结合水中的OH-使水电离而显酸性,写出硼酸电离方程式:_______ 。
(3)氮化铝为一种新型无机非金属材料,因耐磨、耐热、硬度大等优点而被广泛应用。它所属晶体类型为_______ 。
(4)①C、N、O的第一电离能由小到大的顺序是_______ ;
②N2F2 (二氟氮烯)分子中的氮原子采用sp2杂化,则N2F2的结构式为_______ ;
③氟和氧可形成O3F2,试写出O3F2的电子式:_______ 。
(1)下列硼原子电子排布图表示的状态中,能量最低和最高的分别为
A.
 B.
B. 
C.
 D.
D. 
(2)硼酸(H3BO3)为一元弱酸,靠结合水中的OH-使水电离而显酸性,写出硼酸电离方程式:
(3)氮化铝为一种新型无机非金属材料,因耐磨、耐热、硬度大等优点而被广泛应用。它所属晶体类型为
(4)①C、N、O的第一电离能由小到大的顺序是
②N2F2 (二氟氮烯)分子中的氮原子采用sp2杂化,则N2F2的结构式为
③氟和氧可形成O3F2,试写出O3F2的电子式:
您最近一年使用:0次
8 . 丁二酮肟(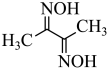 )可与
)可与 反应,生成鲜红色的沉淀丁二酮肟镍,这个反应可用来鉴定
反应,生成鲜红色的沉淀丁二酮肟镍,这个反应可用来鉴定 的存在。请回答下列问题:
的存在。请回答下列问题:
(1)Ni在元素周期表中的位置为___________ 。
(2)基态氧原子的核外电子的空间运动状态有___________ 种。
(3)丁二酮肟( )中涉及元素的电负性由大到小的顺序为
)中涉及元素的电负性由大到小的顺序为___________ ;与氮同周期的硼在成键时,能将一个2s电子激发进入2p能级参与形成化学键,请写出该激发态原子的价电子轨道表示式:___________ ,该过程形成的原子光谱为___________ (填“吸收”或“发射”)光谱。
(4)与Ni同周期的铜、锌两种元素位于元素周期表的___________ 区,两元素的第一电离能( )、第二电离能(
)、第二电离能( )数据如表所示:
)数据如表所示:
铜的 小于锌,
小于锌, 却大于锌的主要原因是
却大于锌的主要原因是___________ 。
 )可与
)可与 反应,生成鲜红色的沉淀丁二酮肟镍,这个反应可用来鉴定
反应,生成鲜红色的沉淀丁二酮肟镍,这个反应可用来鉴定 的存在。请回答下列问题:
的存在。请回答下列问题:(1)Ni在元素周期表中的位置为
(2)基态氧原子的核外电子的空间运动状态有
(3)丁二酮肟(
 )中涉及元素的电负性由大到小的顺序为
)中涉及元素的电负性由大到小的顺序为(4)与Ni同周期的铜、锌两种元素位于元素周期表的
 )、第二电离能(
)、第二电离能( )数据如表所示:
)数据如表所示:电离能/( ) ) |  |  |
| 铜 | 746 | 1958 |
| 锌 | 906 | 1733 |
 小于锌,
小于锌, 却大于锌的主要原因是
却大于锌的主要原因是
您最近一年使用:0次
2023-03-30更新
|
477次组卷
|
7卷引用:安徽省安庆市第二中学2022-2023学年高二下学期期中考试化学试题
名校
解题方法
9 . 依据原子结构知识回答下列问题。
(1)基态硅原子的电子排布式是_____ ;基态硫原子的价电子排布式是_____ 。
(2)基态的铁原子有_____ 个未成对电子。
(3)Cu、K、O、F四种元素中第一电离能最小的是_____ ,电负性最大的是_____ 。
(4)下列有关微粒性质的排列顺序错误的是_____ 。
(5)下列基态原子或离子的电子排布式或排布图正确的是_____ (填序号,下同)。
①Ca2+:1s22s22p63s23p6
②F-:1s22s23p6
③P: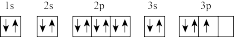
④Fe:1s22s22p63s23p64s2
⑤Mg2+:1s22s22p6
⑥C:
(6)下列硼原子电子排布图表示的状态中,能量最低和最高的分别为_____ 、_____ (填选项字母)。
A.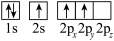 B.
B.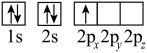
C.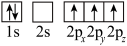 D.
D.
(1)基态硅原子的电子排布式是
(2)基态的铁原子有
(3)Cu、K、O、F四种元素中第一电离能最小的是
(4)下列有关微粒性质的排列顺序错误的是
| A.元素的电负性:P<O<F | B.元素的第一电离能: C<N<O |
| C.离子半径:O2->Na+>Mg2+ | D.原子的未成对电子数:Mn>Si>Cl |
①Ca2+:1s22s22p63s23p6
②F-:1s22s23p6
③P:
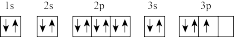
④Fe:1s22s22p63s23p64s2
⑤Mg2+:1s22s22p6
⑥C:

(6)下列硼原子电子排布图表示的状态中,能量最低和最高的分别为
A.
 B.
B.
C.
 D.
D.
您最近一年使用:0次
名校
10 . 磷酸铁锂(LiFePO4)电极材料主要用于各种锂离子电池。回答下列问题。
(1)Fe位于元素周期表中第______ 周期第______ 族,其价层电子排布式为______ 。
(2) 用“>”“<”或“=”填空:
离子半径:Li+______ H-;第一电离能:Li ______ Be;电负性:O ______ P。
(3)在周期表中,化学性质相似的邻族元素是______ 。
(4)下列Li原子轨道表示式表示的状态中,能量最低和最高的分别为______ 、______ (填字母)。
A.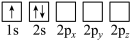 B.
B.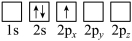
C. D.
D.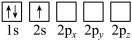
(5)基态P原子中未成对电子数为______ ,其原子核外电子占据的最高能级的电子云轮廓图为______ 形。
(1)Fe位于元素周期表中第
(2) 用“>”“<”或“=”填空:
离子半径:Li+
(3)在周期表中,化学性质相似的邻族元素是
(4)下列Li原子轨道表示式表示的状态中,能量最低和最高的分别为
A.
 B.
B.
C.
 D.
D.
(5)基态P原子中未成对电子数为
您最近一年使用:0次
2023-03-08更新
|
461次组卷
|
2卷引用:安徽省 淮北师范大学附属实验中学2022-2023学年高二下学期第一次月考化学试题



