名校
解题方法
1 . 元素周期表中第四周期的某些过渡元素(如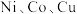 等)在生产、生活中有着广泛的应用.
等)在生产、生活中有着广泛的应用.
(1) 能与水杨醛缩对氯苯胺形成具有发光性的配合物,水杨醛缩对氯苯胺制备反应方程式如下:
能与水杨醛缩对氯苯胺形成具有发光性的配合物,水杨醛缩对氯苯胺制备反应方程式如下: 核外电子排布式
核外电子排布式_________ ;
② 元素的第一电离能由大到小的顺序为
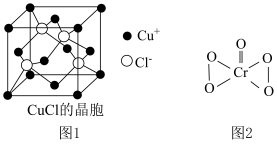
元素的第一电离能由大到小的顺序为__________ . 的晶胞如图1所示,距离每个
的晶胞如图1所示,距离每个 最近的
最近的 的个数为
的个数为_________ .
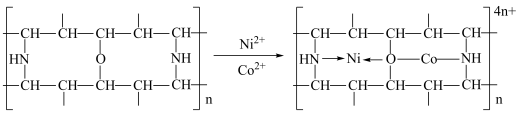
(3)已知: 结构如图2所示,该反应
结构如图2所示,该反应________ (选填“是”或“不是”)氧化还原反应,理由是__________ .
(4)有机净化剂的基本组分为大分子立体网格结构的聚合物,可用于工业废水“除钴镍”.其净化原理可表示为: ”表示出
”表示出 参与的配位键
参与的配位键_________ .
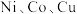 等)在生产、生活中有着广泛的应用.
等)在生产、生活中有着广泛的应用.(1)
 能与水杨醛缩对氯苯胺形成具有发光性的配合物,水杨醛缩对氯苯胺制备反应方程式如下:
能与水杨醛缩对氯苯胺形成具有发光性的配合物,水杨醛缩对氯苯胺制备反应方程式如下:
 核外电子排布式
核外电子排布式②
 元素的第一电离能由大到小的顺序为
元素的第一电离能由大到小的顺序为③对羟基苯甲醛( )的沸点为
)的沸点为 ,而水杨醛(
,而水杨醛(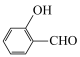 )的沸点为
)的沸点为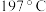 ,请从结构角度解释二者沸点差异原因
,请从结构角度解释二者沸点差异原因
 的晶胞如图1所示,距离每个
的晶胞如图1所示,距离每个 最近的
最近的 的个数为
的个数为(3)已知:
 结构如图2所示,该反应
结构如图2所示,该反应(4)有机净化剂的基本组分为大分子立体网格结构的聚合物,可用于工业废水“除钴镍”.其净化原理可表示为:
 ”表示出
”表示出 参与的配位键
参与的配位键
您最近一年使用:0次
2024-05-04更新
|
218次组卷
|
2卷引用:江苏省扬州市新华中学2023-2024学年高二下学期4月期中考试化学试题
2 . 回答下列问题
(1)金属钼(Mo)常用于工业、军事等领域,已被多个国家列为战略金属,我国的钼储量居世界第二。已知钼在元素周期表中呈现的信息如下,回答下列问题:
钼在元素周期表中的位置是________ ,基态Mo原子核外有________ 种不同运动状态的电子,其中核外电子占据最高电子层的符号是________ 。
(2)氰化钾是一种由剧毒的物质,贮存和使用时必须注意安全。已知: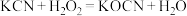 ,回答下列问题:
,回答下列问题:
 中所含三种元素的第一电离能从大到小的顺序为
中所含三种元素的第一电离能从大到小的顺序为________ (用元素符号表示,下同),电负性从大到小的顺序为________ ,基态氮原子外围电子排布式为________ 。
(1)金属钼(Mo)常用于工业、军事等领域,已被多个国家列为战略金属,我国的钼储量居世界第二。已知钼在元素周期表中呈现的信息如下,回答下列问题:
钼在元素周期表中的位置是
(2)氰化钾是一种由剧毒的物质,贮存和使用时必须注意安全。已知:
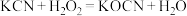 ,回答下列问题:
,回答下列问题: 中所含三种元素的第一电离能从大到小的顺序为
中所含三种元素的第一电离能从大到小的顺序为
您最近一年使用:0次
3 . 下图是元素周期表的一部分,图中所列字母分别代表一种化学元素。
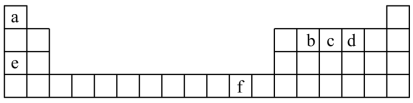
请回答下列问题:
(1)元素b位于周期表中_______ 区,其基态原子核外有_______ 种运动状态不同的电子。
(2)基态c原子中有_______ 个未成对电子。
(3)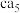 理论上为离子化合物,猜测其电子式为
理论上为离子化合物,猜测其电子式为_______ 。
(4)已知高温下化合物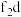 比化合物fd更稳定,试从核外电子排布的角度解释原因
比化合物fd更稳定,试从核外电子排布的角度解释原因_______ 。
(5)b、c、d三种元素的第一电离能由大到小的顺序为_______ (填元素符号)。

请回答下列问题:
(1)元素b位于周期表中
(2)基态c原子中有
(3)
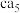 理论上为离子化合物,猜测其电子式为
理论上为离子化合物,猜测其电子式为(4)已知高温下化合物
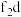 比化合物fd更稳定,试从核外电子排布的角度解释原因
比化合物fd更稳定,试从核外电子排布的角度解释原因(5)b、c、d三种元素的第一电离能由大到小的顺序为
您最近一年使用:0次
名校
解题方法
4 . 以铁、硫酸、柠檬酸、双氧水、氨水等为原料可制备柠檬酸铁铵[(NH4)3Fe(C6H5O7)2]。
(1)Fe基态核外电子排布式为_________________
(2)比较下列微粒键角的大小(填“>”或“<”,下同):
NH3______ NH ;[Cu(NH3)4]2+中的NH3
;[Cu(NH3)4]2+中的NH3 _______ NH3 ;P4_______ CH4
(3)C、N、O元素的第一电离能由大到小的顺序为_____________ 。
(4)柠檬酸的结构简式见图。

1 mol柠檬酸分子中碳原子与氧原子形成的σ键的数目为_______ mol。
(1)Fe基态核外电子排布式为
(2)比较下列微粒键角的大小(填“>”或“<”,下同):
NH3
 ;[Cu(NH3)4]2+中的NH3
;[Cu(NH3)4]2+中的NH3 (3)C、N、O元素的第一电离能由大到小的顺序为
(4)柠檬酸的结构简式见图。

1 mol柠檬酸分子中碳原子与氧原子形成的σ键的数目为
您最近一年使用:0次
5 . 按要求回答下列问题:
(1)研究发现,在CO2低压合成甲醇反应CO2+3H2=CH3OH+H2O中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。Co基态原子核外电子排布为___________ ;元素Mn与O中,第一电离能较大的是___________ ,基态原子核外未成对电子数较多的是___________ 。
(2)我国科学家成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl。
①氮原子的价层电子排布图为___________ 。
②元素的基态的气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1),第二周期部分元素的E1变化趋势如图所示。
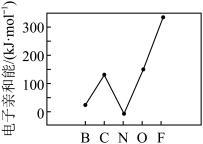
其中除氮元素外,其他元素的E1自左而右依次增大的原因是___________ ,氮元素E1呈现异常的原因是___________ 。
(1)研究发现,在CO2低压合成甲醇反应CO2+3H2=CH3OH+H2O中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。Co基态原子核外电子排布为
(2)我国科学家成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl。
①氮原子的价层电子排布图为
②元素的基态的气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1),第二周期部分元素的E1变化趋势如图所示。

其中除氮元素外,其他元素的E1自左而右依次增大的原因是
您最近一年使用:0次
2022-10-20更新
|
210次组卷
|
10卷引用:常州市武进区礼嘉中学2021-2022学年高二下学期第二次阶段测试化学试题
常州市武进区礼嘉中学2021-2022学年高二下学期第二次阶段测试化学试题湖北省咸宁市嘉鱼县第一中学2019-2020学年高二下学期期末考试化学试题广东省东莞市新世纪英才学校2021-2022学年高二上学期第一次教学质量检测化学试题(已下线)第1章 章末综合测评B-2021-2022学年高二化学同步课时跟踪训练(人教版2019选择性必修1)第一章 本章达标检测2河北省石家庄市第23中学2022-2023学年高二上学期第一次月考化学试题湖南省衡阳县第四中学 2022-2023学年高二下学期开学摸底考试(平行班)化学试题(已下线)第一章 原子结构与性质(B卷) (已下线)考点33 原子结构与性质-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点46 原子结构与性质-备战2023年高考化学一轮复习考点帮(全国通用)
名校
解题方法
6 . 回答下列问题:
(1) 中配体分子
中配体分子 以及分子
以及分子 的空间结构和相应的键角如图甲所示。
的空间结构和相应的键角如图甲所示。
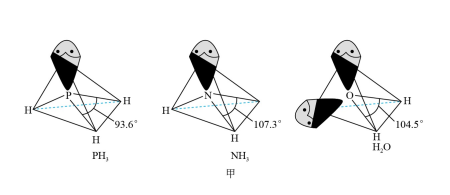
 中P的杂化类型是
中P的杂化类型是________ 。 的沸点比
的沸点比 的
的________ ,原因是________ 。 的键角小于
的键角小于 的,分析原因:
的,分析原因:________ 。
(2)磷酸根离子的空间构型为________ ,其中P的价层电子对数为________ 、杂化轨道类型为________ 。
(3) 分子中氮原子的轨道杂化类型是
分子中氮原子的轨道杂化类型是________ ;C、N、O元素的第一电离能由大到小的顺序为________ 。
(4)乙二胺 是一种有机化合物,分子中氮、碳的杂化类型分别是
是一种有机化合物,分子中氮、碳的杂化类型分别是________ 、________ 。
(5) 中,电负性最高的元素是
中,电负性最高的元素是________ ;P的________ 杂化轨道与O的2p轨道形成________ 键。
(6) 的空间构型为
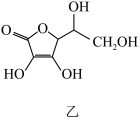
的空间构型为________ (用文字描述);抗坏血酸的分子结构如图乙所示,分子中碳原子的轨道杂化类型为________ ;推测抗坏血酸在水中的溶解性:________ (填“难溶于水”或“易溶于水”)。
(1)
 中配体分子
中配体分子 以及分子
以及分子 的空间结构和相应的键角如图甲所示。
的空间结构和相应的键角如图甲所示。
 中P的杂化类型是
中P的杂化类型是 的沸点比
的沸点比 的
的 的键角小于
的键角小于 的,分析原因:
的,分析原因:(2)磷酸根离子的空间构型为
(3)
 分子中氮原子的轨道杂化类型是
分子中氮原子的轨道杂化类型是(4)乙二胺
 是一种有机化合物,分子中氮、碳的杂化类型分别是
是一种有机化合物,分子中氮、碳的杂化类型分别是(5)
 中,电负性最高的元素是
中,电负性最高的元素是(6)
 的空间构型为
的空间构型为
您最近一年使用:0次
2022-10-07更新
|
308次组卷
|
2卷引用:江苏省扬州中学2022-2023学年高二下学期开学摸底考试化学试题
7 . 已知:A~F都是周期表中前四周期的元素,它们的原子序数依次增大。其中A、C原子的L层有2个未成对电子。D与E同主族,D的二价阳离子与C的阴离子具有相同的电子层结构。F3+的M层3d轨道电子为半充满状态。请根据以上信息,回答下列问题:
(1)A、B、C的电负性由小到大的顺序为_______ (用元素符号表示)。
(2)D元素的原子核外共有_______ 种不同运动状态的电子、_______ 种不同能级的电子。
(3)写出E的基态原子的电子排布式:_______ 。
(4)F和X(质子数为25)两元素的部分电离能数据列于下表:比较两元素的I2、I3可知,气态X2+再失去一个电子比气态F2+再失去一个电子难。对此,你的解释是_______
(1)A、B、C的电负性由小到大的顺序为
(2)D元素的原子核外共有
(3)写出E的基态原子的电子排布式:
(4)F和X(质子数为25)两元素的部分电离能数据列于下表:比较两元素的I2、I3可知,气态X2+再失去一个电子比气态F2+再失去一个电子难。对此,你的解释是
| 元素 | X | F | |
| 电离能/kJ·mol-1 | I1 | 717 | 759 |
| I2 | 1 509 | 1 561 | |
| I3 | 3 248 | 2 957 | |
您最近一年使用:0次
名校
解题方法
8 . 以铁、硫酸、柠檬酸、双氧水、氨水等为原料可制备柠檬酸铁铵【(NH4)3Fe(C6H5O7)2】。
(1)Fe2+基态核外电子排布式为___ ;NO 的空间构型为
的空间构型为___ (用文字描述)。
(2)NH3分子中氮原子的轨道杂化类型是___ ;C、N、O元素的第一电离能由大到小的顺序为___ 。
(3)柠檬酸的结构简式见图。1mol柠檬酸分子中碳原子与氧原子形成的σ键的数目为=__ mol。
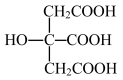
(4)利用键能数据计算反应的ΔH(请写出解题过程):N2(g)+3H2(g)=2NH3(g)。___
(1)Fe2+基态核外电子排布式为
 的空间构型为
的空间构型为(2)NH3分子中氮原子的轨道杂化类型是
(3)柠檬酸的结构简式见图。1mol柠檬酸分子中碳原子与氧原子形成的σ键的数目为=

(4)利用键能数据计算反应的ΔH(请写出解题过程):N2(g)+3H2(g)=2NH3(g)。
| 化学键 | H—H | N—H | N≡N |
| 键能/(kJ·mol-1) | 436 | 393 | 946 |
您最近一年使用:0次
2021-10-14更新
|
238次组卷
|
2卷引用:江苏省泗阳县实验高级中学2021-2022学年高二上学期第一次质量调研化学试题
9 . 根据题意,完成下列填空:
(1)基态铜离子的核外电子排布式为_______ ,基态砷原子的外围电子的轨道表示式为_______ ;
(2)通常制造的农药含元素F、P、S、Cl,四种元素的电负性从大到小的顺序为_______ ;第一电离能从大到小的顺序为_______ 。
(3)第二周期中,第一电离能介于B和N之间的元素共有_______ 种。
(4)第四周期中,原子核外电子排布有两个未成对电子的元素有_______ 种。
(5)向FeCl3溶液中滴加NaHCO3溶液,有沉淀和气体生成的离子方程式_______ 。
(1)基态铜离子的核外电子排布式为
(2)通常制造的农药含元素F、P、S、Cl,四种元素的电负性从大到小的顺序为
(3)第二周期中,第一电离能介于B和N之间的元素共有
(4)第四周期中,原子核外电子排布有两个未成对电子的元素有
(5)向FeCl3溶液中滴加NaHCO3溶液,有沉淀和气体生成的离子方程式
您最近一年使用:0次
10 . 下图是元素周期表的一部分,图中所列字母分别代表一种化学元素。
(1)元素b位于周期表中_______ 区,其基态原子核外有_______ 种运动状态不同的电子。
(2)基态c原子中有_______ 个未成对电子,其中能量最高的电子所在原子轨道的电子云轮廓图为_______ 形。
(3)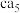 理论上为离子化合物,猜测其电子式为
理论上为离子化合物,猜测其电子式为_______ 。
(4)基态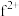 外围电子的电子排布图为
外围电子的电子排布图为_______ ,已知高温下化合物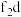 比化合物fd更稳定,试从核外电子排布的角度解释原因
比化合物fd更稳定,试从核外电子排布的角度解释原因_______ 。
(5)b、c、d三种元素的第一电离能由大到小的顺序为_______ (填元素符号)。

(1)元素b位于周期表中
(2)基态c原子中有
(3)
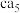 理论上为离子化合物,猜测其电子式为
理论上为离子化合物,猜测其电子式为(4)基态
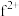 外围电子的电子排布图为
外围电子的电子排布图为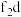 比化合物fd更稳定,试从核外电子排布的角度解释原因
比化合物fd更稳定,试从核外电子排布的角度解释原因(5)b、c、d三种元素的第一电离能由大到小的顺序为
您最近一年使用:0次
2021-07-09更新
|
899次组卷
|
6卷引用:江苏省无锡市市北高级中学2023-2024学年高二上学期期末检测化学试卷
江苏省无锡市市北高级中学2023-2024学年高二上学期期末检测化学试卷广东省肇庆市2020-2021学年高二下学期末教学质量检测化学(物质结构与性质)试题(已下线)1.2.2 原子结构与元素周期律(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修2)(已下线)第一章 原子结构与性质 章节过关检测-2021-2022学年高二化学链接教材精准变式练(人教版2019选择性必修2)广西南宁市2022-2023学年高二下学期开学考试化学试题(已下线)猜想01 原子结构与性质 【考题猜想】(8大题型)-2023-2024学年高二化学下学期期末考点大串讲(人教版2019)



