解题方法
1 . 氮化硼(BN)是一种重要的功能陶瓷材料。以天然硼砂为原料,经过一系列反应可以得到,流程如图所示。请回答下列问题:
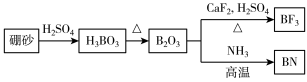
(1) 分子为
分子为_______ (填“极性”或“非极性”)分子。
(2) 和过量NaF作用可生成
和过量NaF作用可生成 ,
, 中
中_______ (填“有”或“无”)配位键。
(3)与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为_______ ,层间作用力为_______ 。
(4)第一电离能O<N。原因是_______ 。
(5)实验室合成了一种由C和N两种元素形成的化合物,该化合物具有空间网状结构,其中每个C原子与4个N原子形成共价键,每个N原子与3个C原子形成共价键。则有C、N两元素形成的化合物化学式为_______ ,预测该化合物熔点_______ 金刚石(填“高于”或“低于”)。

(1)
 分子为
分子为(2)
 和过量NaF作用可生成
和过量NaF作用可生成 ,
, 中
中(3)与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为
(4)第一电离能O<N。原因是
(5)实验室合成了一种由C和N两种元素形成的化合物,该化合物具有空间网状结构,其中每个C原子与4个N原子形成共价键,每个N原子与3个C原子形成共价键。则有C、N两元素形成的化合物化学式为
您最近一年使用:0次
名校
2 . 近年来我国科学家发现了一系列意义重大的铁系、铜系超导材料,其中一类为Fe-Sm-As-F-O组成的化合物。回答下列问题:
(1)元素As与N同族。预测As的氢化物分子的立体结构为______ ,杂化类型为______ ,其沸点比 的
的______ (填“高”或“低”),其判断理由是____________ 。
(2)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成,第一电离能:
______ (填“大于”或“小于”) ,原因是
,原因是____________ 。
(3)研究发现,阳离子的颜色与未成对电子数有关。例如: 、
、 、
、 等。
等。 呈无色,其原因是
呈无色,其原因是____ 。
(1)元素As与N同族。预测As的氢化物分子的立体结构为
 的
的(2)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成,第一电离能:

 ,原因是
,原因是(3)研究发现,阳离子的颜色与未成对电子数有关。例如:
 、
、 、
、 等。
等。 呈无色,其原因是
呈无色,其原因是
您最近一年使用:0次
2023-04-03更新
|
125次组卷
|
2卷引用:重庆市璧山来凤中学校2023-2024学年高二下学期3月月考化学试题
名校
解题方法
3 . 依据原子结构知识回答下列问题。
(1)基态In原子的核外电子排布简式___________ 。
(2)下列有关微粒的说法错误的是___________ 。
a.第一电离能:Al<Mg<F
b. :
: 违反了能量最低原理
违反了能量最低原理
c.离子半径: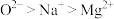
d.原子的未成对电子数:Mn>Cr>Cl
(3)短周期部分原子电离能(I)数据如下:
①F原子核外的电子云共有___________ 种伸展方向。
②表格中 均大于
均大于 的原因是
的原因是___________ 。
③已知高温下易发生反应: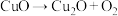 ,铜在周期表中的位置是
,铜在周期表中的位置是___________ ,从物质结构来分析,该反应易发生的原因是___________ 。
④依据泡利原理,可用“ ”、“
”、“ ”来表示电子的自旋状态,该数值称为电子的自旋磁量子数。对于基态的碳原子,其电子自旋磁量子数的代数和为
”来表示电子的自旋状态,该数值称为电子的自旋磁量子数。对于基态的碳原子,其电子自旋磁量子数的代数和为___________ 。
(1)基态In原子的核外电子排布简式
(2)下列有关微粒的说法错误的是
a.第一电离能:Al<Mg<F
b.
 :
: 违反了能量最低原理
违反了能量最低原理c.离子半径:
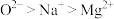
d.原子的未成对电子数:Mn>Cr>Cl
(3)短周期部分原子电离能(I)数据如下:
| 元素 | C | N | F | |
电离能/( ) ) |  | 1086 | 1402.23 | 1681 |
 | 2352 | 2856.0 | 5388.3 | |
②表格中
 均大于
均大于 的原因是
的原因是③已知高温下易发生反应:
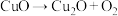 ,铜在周期表中的位置是
,铜在周期表中的位置是④依据泡利原理,可用“
 ”、“
”、“ ”来表示电子的自旋状态,该数值称为电子的自旋磁量子数。对于基态的碳原子,其电子自旋磁量子数的代数和为
”来表示电子的自旋状态,该数值称为电子的自旋磁量子数。对于基态的碳原子,其电子自旋磁量子数的代数和为
您最近一年使用:0次
4 . N、P两种元素位于元素周期表第VA族。请回答下列问题:
(1)基态氮原子的电子排布式为________ ;基态氮原子的价层电子的轨道表示式为________ 。
(2)基态磷原子中,其占据的最高能层的符号是________ ;基态磷原子占据的最高能级共有________ 个原子轨道,其形状是________ 。
(3)电负性:N________ P(填>或<)。
(4)雷酸汞曾被用作起爆药,雷酸汞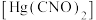 中C、N、O三种元素第一电离能从大到小的顺序为
中C、N、O三种元素第一电离能从大到小的顺序为________ >________ >________ (填元素符号)。
(1)基态氮原子的电子排布式为
(2)基态磷原子中,其占据的最高能层的符号是
(3)电负性:N
(4)雷酸汞曾被用作起爆药,雷酸汞
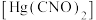 中C、N、O三种元素第一电离能从大到小的顺序为
中C、N、O三种元素第一电离能从大到小的顺序为
您最近一年使用:0次
2023-02-15更新
|
383次组卷
|
2卷引用:重庆市九龙坡区2022-2023学年高二上学期期末测试(开学测试)化学试题
名校
5 . 卤素单质及其化合物在科研和工农业生产中有着广泛的应用,回答下列问题:
(1)Cl原子激发态的电子排布式有_______(填标号)。
(2)C、N、O、F都是第二周期的典型非金属元素,下列说法不正确的是_______(填标号)。
(3)固态氟化氢中存在 形式,画出
形式,画出 的链状结构
的链状结构_______ 。
(4)配制碘水时,加入浓KI溶液可以增大碘的溶解性,原理为_______ (用离子方程式表示)。
(1)Cl原子激发态的电子排布式有_______(填标号)。
A. | B. |
C. | D.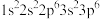 |
| A.第一电离能:C<N<O<F |
| B.原子半径:C>N>O>F |
| C.最简单气态氢化物的热稳定性:C<N<O<F |
| D.元素的最高正价:C<N<O<F |
 形式,画出
形式,画出 的链状结构
的链状结构(4)配制碘水时,加入浓KI溶液可以增大碘的溶解性,原理为
您最近一年使用:0次
名校
解题方法
6 . A~H元素在周期表中的位置如图所示,回答下列问题:

(1)G是地壳中含量第5的元素,在地壳中全部以化合态存在,其化合物的焰色反应为砖红色,这与G原子核外电子发生跃迁______ (填“吸收”或“释放”)能量有关。
(2)第一电离能介于C、D之间的第二周期元素有_______ 种。
(3)H被称为“人类的第三金属”,与H同周期且其基态原子的未成对电子数与H原子相同的元素另有_______ 种。
(4)D的某种氢化物(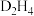 )可用作火箭燃料,燃烧时发生的反应是:
)可用作火箭燃料,燃烧时发生的反应是: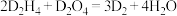 ,若该反应中有
,若该反应中有 电子转移,则形成的
电子转移,则形成的 键有
键有_______  。
。
(5) 是有机合成中常用的还原剂,
是有机合成中常用的还原剂,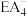 中E元素基态原子的价层电子轨道表示式为
中E元素基态原子的价层电子轨道表示式为______ ;离子半径:
______  (填“
(填“ ”或“
”或“ ”);
”); 中不存在
中不存在______ (填字母)。
A.离子键 B.共价键 C. 键 D.
键 D. 键 E.氢键
键 E.氢键
(6)F元素能形成多种含氧酸及盐,其中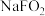 是常用的消毒剂,其酸根离子
是常用的消毒剂,其酸根离子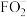 的价层电子对数为
的价层电子对数为______ ,空间构型为______ 。

(1)G是地壳中含量第5的元素,在地壳中全部以化合态存在,其化合物的焰色反应为砖红色,这与G原子核外电子发生跃迁
(2)第一电离能介于C、D之间的第二周期元素有
(3)H被称为“人类的第三金属”,与H同周期且其基态原子的未成对电子数与H原子相同的元素另有
(4)D的某种氢化物(
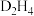 )可用作火箭燃料,燃烧时发生的反应是:
)可用作火箭燃料,燃烧时发生的反应是: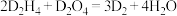 ,若该反应中有
,若该反应中有 电子转移,则形成的
电子转移,则形成的 键有
键有 。
。(5)
 是有机合成中常用的还原剂,
是有机合成中常用的还原剂,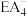 中E元素基态原子的价层电子轨道表示式为
中E元素基态原子的价层电子轨道表示式为
 (填“
(填“ ”或“
”或“ ”);
”); 中不存在
中不存在A.离子键 B.共价键 C.
 键 D.
键 D. 键 E.氢键
键 E.氢键(6)F元素能形成多种含氧酸及盐,其中
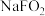 是常用的消毒剂,其酸根离子
是常用的消毒剂,其酸根离子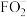 的价层电子对数为
的价层电子对数为
您最近一年使用:0次
名校
7 . 合成氨是人类科学技术发展史上的一项重大成就,在很大程度上解决了地球上因粮食不足而导致的饥饿问题,是化学和技术对社会发展与进步的巨大贡献。
(1)基态N原子中,能量最高的电子的电子云在空间有___________ 个伸展方向,原子轨道呈___________ 形。
(2) 分子中,N、H电负性大小顺序为
分子中,N、H电负性大小顺序为___________ 。从原子结构的角度分析B、N和O的第一电离能由大到小的顺序为___________ 。
(3)铁触媒是普遍使用的以铁为主体的多成分催化剂,通常还含有 、
、 、CaO、MgO、
、CaO、MgO、 等氧化物中的几种。
等氧化物中的几种。
①Cr原子的价电子排布图为___________ 。
②上述氧化物所涉及的元素中,处于元素周期表中p区的元素是___________ 。
(4)目前合成氨通常采用的压强为10MPa-30MPa、温度为400-500℃,十分耗能。我国科研人员研制出了“Fe-LiH”等催化剂,温度,压强分别降到了350℃、1MPa,这是近年来合成氨反应研究中的重要突破。
①第三电离能
___________ 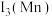 (填“>”或“<”),原因是
(填“>”或“<”),原因是___________ 。
②比较 与
与 的半径大小关系:
的半径大小关系: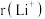
___________  。(填“>”或“<”)
。(填“>”或“<”)
(1)基态N原子中,能量最高的电子的电子云在空间有
(2)
 分子中,N、H电负性大小顺序为
分子中,N、H电负性大小顺序为(3)铁触媒是普遍使用的以铁为主体的多成分催化剂,通常还含有
 、
、 、CaO、MgO、
、CaO、MgO、 等氧化物中的几种。
等氧化物中的几种。①Cr原子的价电子排布图为
②上述氧化物所涉及的元素中,处于元素周期表中p区的元素是
(4)目前合成氨通常采用的压强为10MPa-30MPa、温度为400-500℃,十分耗能。我国科研人员研制出了“Fe-LiH”等催化剂,温度,压强分别降到了350℃、1MPa,这是近年来合成氨反应研究中的重要突破。
①第三电离能

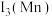 (填“>”或“<”),原因是
(填“>”或“<”),原因是②比较
 与
与 的半径大小关系:
的半径大小关系: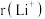
 。(填“>”或“<”)
。(填“>”或“<”)
您最近一年使用:0次
2022-11-12更新
|
826次组卷
|
4卷引用:重庆第八中学2022-2023学年高二上学期期中考试化学试题
名校
8 . 回答下列问题:
(1)A元素基态的正一价离子的3d轨道为半充满,其元素符号为_______ ,该离子占据的最高能层的符号是_______ 。
(2)利用现代仪器与方法可以测定物质的结构,其中,利用_______ 法可测定分子的相对分子质量。利用_______ 法可区分晶体与非晶体。
(3)如图的NaCl晶胞中,每个 周围与之等距离且最近的
周围与之等距离且最近的 有
有_______ 个, 的配位数为
的配位数为_______ 。
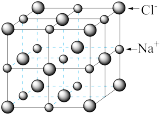
(4) 能与水混溶,却不溶于
能与水混溶,却不溶于 ,原因是
,原因是_______ 。
(5)Mn与Fe两元素的部分电离能数据如下表所示,比较两元素的 和
和 可知,气态
可知,气态 再失去一个电子比气态
再失去一个电子比气态 再失去一个电子更难,原因是
再失去一个电子更难,原因是_______ 。
(1)A元素基态的正一价离子的3d轨道为半充满,其元素符号为
(2)利用现代仪器与方法可以测定物质的结构,其中,利用
(3)如图的NaCl晶胞中,每个
 周围与之等距离且最近的
周围与之等距离且最近的 有
有 的配位数为
的配位数为
(4)
 能与水混溶,却不溶于
能与水混溶,却不溶于 ,原因是
,原因是(5)Mn与Fe两元素的部分电离能数据如下表所示,比较两元素的
 和
和 可知,气态
可知,气态 再失去一个电子比气态
再失去一个电子比气态 再失去一个电子更难,原因是
再失去一个电子更难,原因是| 元素 | Mn | Fe | |
电离能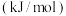 |  | 717 | 759 |
 | 1509 | 1561 | |
 | 3248 | 2957 | |
您最近一年使用:0次
名校
9 . (NH4)2Fe(SO4)2·6H2O俗称摩尔盐。
(1)基态Fe原子的价层电子的电子排布图为___ ,其最外层电子的电子云形状为___ 。
(2)Fe元素在周期表中位置是___ ,属于___ 区元素(选填“s”、“p”、“d”或“ds”)。
(3)O、S两元素的电负性由大到小的顺序为___ (用元素符号表示)。
(4)N、O两元素的第一电离能由大到小的顺序为___ (用元素符号表示)。
(5)摩尔盐的水溶液中,各离子浓度的大小关系为___ 。
(6)称取3.920g含有杂质的摩尔盐样品(杂质不参加反应),溶于适量稀硫酸中,转入100mL容量瓶定容,每次用移液管取25.00mL溶液放入锥形瓶中,用0.02000mol/L的KMnO4溶液滴定(还原产物为Mn2+),三次平均消耗24.30mL的KMnO4溶液。则产品中(NH4)2Fe(SO4)2·6H2O的质量分数为___ (已知(NH4)2Fe(SO4)2·6H2O的相对分子质量为392)。
(1)基态Fe原子的价层电子的电子排布图为
(2)Fe元素在周期表中位置是
(3)O、S两元素的电负性由大到小的顺序为
(4)N、O两元素的第一电离能由大到小的顺序为
(5)摩尔盐的水溶液中,各离子浓度的大小关系为
(6)称取3.920g含有杂质的摩尔盐样品(杂质不参加反应),溶于适量稀硫酸中,转入100mL容量瓶定容,每次用移液管取25.00mL溶液放入锥形瓶中,用0.02000mol/L的KMnO4溶液滴定(还原产物为Mn2+),三次平均消耗24.30mL的KMnO4溶液。则产品中(NH4)2Fe(SO4)2·6H2O的质量分数为
您最近一年使用:0次
名校
解题方法
10 . 下表是元素周期表的一部分。表中所列的字母分别代表一种元素。
回答下列问题:
(1)D的简单气态氢化物分子的立体构型为___________ 。
(2)第一电离能H___________ X(填“>”、“<”或“=”)。
(3)DA3的沸点比D2E的沸点高,其原因是___________ 。
(4)YE 的立体构型为
的立体构型为___________ ,YE 的键角比YE
的键角比YE 的键角小的原因是
的键角小的原因是___________ 。
| A | R | ||||||||||||||||
| B | D | E | M | T | |||||||||||||
| G | H | X | J | Y | L | ||||||||||||
| N |
(1)D的简单气态氢化物分子的立体构型为
(2)第一电离能H
(3)DA3的沸点比D2E的沸点高,其原因是
(4)YE
 的立体构型为
的立体构型为 的键角比YE
的键角比YE 的键角小的原因是
的键角小的原因是
您最近一年使用:0次
2022-05-05更新
|
101次组卷
|
2卷引用:重庆市万州纯阳中学校2021-2022学年高二下学期5月月考化学试题



