名校
1 . 能源、材料与生产生活和社会发展密切相关。
I.光伏材料是指能将太阳能直接转换成电能的材料。光伏材料又称太阳能材料,只有半导体材料具有这种功能。可作太阳能电池材料的有单晶硅、多晶硅、非晶硅、GaAs、GaAlAs、InP、CdS、CdTe等。
(1)写出31号元素镓(Ga)的原子结构示意图:_______ 。
(2)P、S、Ga电负性从大到小的顺序为_______ 。
(3)As元素的第一电离能_______ (填“大于”“小于”或“等于”)Se元素的第一电离能。
(4)写出原子序数最小的第VIII族元素基态原子的核外电子排布式:_______ 。
(5)写出3p轨道上只有2个未成对电子的元素的符号:_______ 、_______ 。
II.从化学键的角度分析,化学反应的过程就是反应物的化学键断裂和生成物的化学键形成的过程。在化学反应过程中,断裂化学键需要消耗能量,形成化学键又会释放能量。
(6)已知:
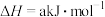 ,根据上表中所列键能数据可计算出a=
,根据上表中所列键能数据可计算出a=_______ 。
I.光伏材料是指能将太阳能直接转换成电能的材料。光伏材料又称太阳能材料,只有半导体材料具有这种功能。可作太阳能电池材料的有单晶硅、多晶硅、非晶硅、GaAs、GaAlAs、InP、CdS、CdTe等。
(1)写出31号元素镓(Ga)的原子结构示意图:
(2)P、S、Ga电负性从大到小的顺序为
(3)As元素的第一电离能
(4)写出原子序数最小的第VIII族元素基态原子的核外电子排布式:
(5)写出3p轨道上只有2个未成对电子的元素的符号:
II.从化学键的角度分析,化学反应的过程就是反应物的化学键断裂和生成物的化学键形成的过程。在化学反应过程中,断裂化学键需要消耗能量,形成化学键又会释放能量。
| 化学键 | H—H | N—H | N≡N |
| 键能/(kJ/mol) | 436 | 391 | 945 |

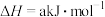 ,根据上表中所列键能数据可计算出a=
,根据上表中所列键能数据可计算出a=
您最近一年使用:0次
2 . N、P两种元素位于元素周期表第VA族。请回答下列问题:
(1)基态氮原子的电子排布式为________ ;基态氮原子的价层电子的轨道表示式为________ 。
(2)基态磷原子中,其占据的最高能层的符号是________ ;基态磷原子占据的最高能级共有________ 个原子轨道,其形状是________ 。
(3)电负性:N________ P(填>或<)。
(4)雷酸汞曾被用作起爆药,雷酸汞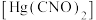 中C、N、O三种元素第一电离能从大到小的顺序为
中C、N、O三种元素第一电离能从大到小的顺序为________ >________ >________ (填元素符号)。
(1)基态氮原子的电子排布式为
(2)基态磷原子中,其占据的最高能层的符号是
(3)电负性:N
(4)雷酸汞曾被用作起爆药,雷酸汞
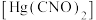 中C、N、O三种元素第一电离能从大到小的顺序为
中C、N、O三种元素第一电离能从大到小的顺序为
您最近一年使用:0次
2023-02-15更新
|
383次组卷
|
2卷引用:天津市朱唐庄中学2022-2023学年高二下学期3月阶段性检测化学试题
名校
解题方法
3 . 如图是元素周期表的一部分,根据元素在周期表中的位置,回答下列问题:
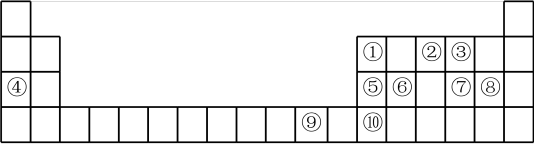
(1)⑨号元素在周期表中的位置是_______ ,其最高能层的电子占据的原子轨道电子云轮廓为_______ 形。若将其最高价氧化物的水化物溶于氨水中可得到一种透明的深蓝色溶液,写出反应的化学方程式为:_______ 。
(2)第二周期所有元素中第一电离能介于①②之间的有_______ 种。由②③④形成的简单离子半径由小到大顺序是_______ (填化学用语)。
(3)元素⑦⑧可形成原子个数比为1:1的共价化合物,分子中各原子最外层均达到8电子的稳定结构,试写出其结构式_______ ,该分子为_______ (填“极性分子”或“非极性分子”) 。
(4)元素②⑥可形成的化合物是一种性质优良的无机非金属材料,根据元素周期律知识,写出其化学式_______ ,它的熔点高,硬度大,电绝缘性好,化学性质稳定,它的晶体类型是_______ 。
(5)下列有关性质的比较正确且能用元素周期律解释的是_______(填标号)
(6)⑩可形成的卤化物的熔点如下表:
⑩的氟化物的化学式为_______ ,该物质的熔点比氯化物熔点高很多的原因是 _______ 。

(1)⑨号元素在周期表中的位置是
(2)第二周期所有元素中第一电离能介于①②之间的有
(3)元素⑦⑧可形成原子个数比为1:1的共价化合物,分子中各原子最外层均达到8电子的稳定结构,试写出其结构式
(4)元素②⑥可形成的化合物是一种性质优良的无机非金属材料,根据元素周期律知识,写出其化学式
(5)下列有关性质的比较正确且能用元素周期律解释的是_______(填标号)
| A.电负性:②>③ | B.氢化物的稳定性:③>⑦ |
| C.最高价氧化物对应的水化物的碱性:④>⑤ | D.氢化物的沸点:③>⑦ |
| 卤化物 | 氟化物 | 氯化物 | 溴化物 |
| 熔点/°C | > 1000 | 77.75 | 122.3 |
您最近一年使用:0次
2023-01-13更新
|
1513次组卷
|
3卷引用:天津市武清区城关中学、杨村第四中学、黄花店中学2022-2023学年高二下学期第一次阶段考化学试题
4 . 回答下列问题:
(1)氟原子激发态的电子排布式有______ ,其中能量较高的是______ 。(填标号)
a.1s22s22p43s1 b.1s22s22p43d2 c.1s22s12p5 d.1s22s22p33p2
(2)某元素原子的位于周期表的第四周期,元素原子的最外层只有一个电子,其次外层内的所以轨道电子均成对。该元素位于周期表的______ 区,写出该基态原子电子排布式为______ 。
(3)图a、b、c分别表示C、N、O和F的逐级电离能I变化趋势(纵坐标的标度不同)。第一电离能的变化图是______ (填标号),判断的根据是______ ;第三电离能的变化图是______ (填标号)。
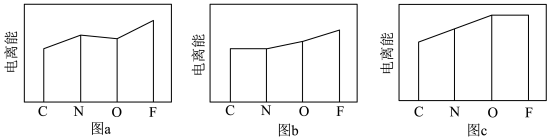
(4)短周期元素X、Y、Z、W的原子序数依次增大。根据表中信息完成下列空白。
①元素的电负性:Z______ W(填“大于”“小于”或“等于”)。
②简单离子半径:W______ Y(填“大于”“小于”或“等于”)。
③氢化物的稳定性:X______ Z(填“大于”“小于”或“等于”)。
(1)氟原子激发态的电子排布式有
a.1s22s22p43s1 b.1s22s22p43d2 c.1s22s12p5 d.1s22s22p33p2
(2)某元素原子的位于周期表的第四周期,元素原子的最外层只有一个电子,其次外层内的所以轨道电子均成对。该元素位于周期表的
(3)图a、b、c分别表示C、N、O和F的逐级电离能I变化趋势(纵坐标的标度不同)。第一电离能的变化图是

(4)短周期元素X、Y、Z、W的原子序数依次增大。根据表中信息完成下列空白。
| 元素 | X | Y | Z | W |
| 最高价氧化物的水化物 | H3ZO4 | |||
| 0.1 mol∙L−1溶液对应的pH(25℃) | 1.00 | 13.00 | 1.57 | 0.70 |
②简单离子半径:W
③氢化物的稳定性:X
您最近一年使用:0次
2023-01-03更新
|
421次组卷
|
2卷引用:天津市和平区2022-2023学年高二上学期期末质量调查化学试卷
5 . 根据元素周期表中完整周期元素的性质,填写下列空白。
(1)在第三周期中,第一电离能最小的元素符号是_______ ,其原子的结构示意图为_______ ,第一电离能最大的元素符号是_______ ,其电子排布式为_______ 。
(2)在元素周期表中,电负性最大的元素名称是_______ ,其价电子排布图为_______ 。
(3)第四周期元素中未成对电子数最多的元素符号是_______ ,其基态原子的简化电子排布式为_______ ,有_______ 个未成对电子,有_______ 个能级,能量最高的能级符号为_______ 。
(4)某元素的基态原子价电子排布式为3d104s1 ,该元素符号是_______ ,原子中所有电子占有_______ 个轨道,核外共有_______ 个不同运动状态的电子。
(5)某元素的正三价离子的3d能级为半充满,其硫酸盐水溶液显_______ 性(填“酸”、“碱”或“中”),用离子方程式解释其原因_______ 。
(6)用惰性电极电解第三周期原子半径最大的元素的氯化物的水溶液,其阳极反应的电极方程式为_______ 。电解一段时间后,阴极区pH_______ (填“增大”、“减小”或“不变”)
(1)在第三周期中,第一电离能最小的元素符号是
(2)在元素周期表中,电负性最大的元素名称是
(3)第四周期元素中未成对电子数最多的元素符号是
(4)某元素的基态原子价电子排布式为3d104s1 ,该元素符号是
(5)某元素的正三价离子的3d能级为半充满,其硫酸盐水溶液显
(6)用惰性电极电解第三周期原子半径最大的元素的氯化物的水溶液,其阳极反应的电极方程式为
您最近一年使用:0次
6 . 根据已学知识,请回答下列问题:
(1)基态N原子中,核外电子占据的最高能层的符号是___________ ,占据该能层电子的电子云轮廓图形状为___________ 。
(2)写出3p轨道上有2个未成对电子的元素的符号:___________ 。
(3)某元素被科学家称之为人体微量元素中的“防癌之王”,其原子的外围电子排布式为4s24p4,该元素的名称是___________ 。
(4)已知铁是26号元素,写出Fe的价层电子排布式___________ ;在元素周期表中,该元素在_____________ 填“s”“p”“d”“f”或“ds”)区。
(5)从原子结构的角度分析B、N和O的第一电离能由大到小的顺序为___________ 。电负性的顺序是___________ 。
(6)写出C的核外电子排布图为:___________ 。
(7)Zn2+的核外电子排布式为___________ 。
(1)基态N原子中,核外电子占据的最高能层的符号是
(2)写出3p轨道上有2个未成对电子的元素的符号:
(3)某元素被科学家称之为人体微量元素中的“防癌之王”,其原子的外围电子排布式为4s24p4,该元素的名称是
(4)已知铁是26号元素,写出Fe的价层电子排布式
(5)从原子结构的角度分析B、N和O的第一电离能由大到小的顺序为
(6)写出C的核外电子排布图为:
(7)Zn2+的核外电子排布式为
您最近一年使用:0次
2022-01-19更新
|
655次组卷
|
8卷引用:天津市红桥区2021-2022学年高二上学期期末考试化学试题
7 . Goodenough等人因在锂离子电池及钴酸锂、磷酸铁锂等正极材料研究方面的卓越贡献而获得2019年诺贝尔化学奖。回答下列问题:
(1)氧的基态原子的轨道表示式___ 。写出钴的简化电子排布式___ 。基态Fe2+与Fe3+离子中未成对的电子数之比为___ 。
(2)Li在周期表的位置___ ,其位于元素周期表5个分区中的___ 区。Li与Na的第一电离能(I1)大小比较:I1(Li)___ I1(Na),原因是___ 。
(1)氧的基态原子的轨道表示式
(2)Li在周期表的位置
您最近一年使用:0次
名校
解题方法
8 . 下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。
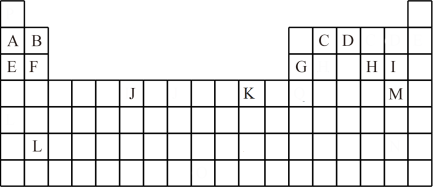
试回答下列问题:
(1)写出基态 原子的电子排布式:
原子的电子排布式:_______ , 的原子序数:
的原子序数:_______ , 的简化电子排布式:
的简化电子排布式:_______ 。
(2)下列关于元素在元素周期表中的位置的叙述正确的是_______ (填选项字母)。
A. 位于元素周期表中第四周期第ⅡB族,属于
位于元素周期表中第四周期第ⅡB族,属于 区元素
区元素
B. 位于元素周期表中第四周期第ⅣB族,属于
位于元素周期表中第四周期第ⅣB族,属于 区元素
区元素
C. 位于元素周期表中第三周期第ⅡA族,属于
位于元素周期表中第三周期第ⅡA族,属于 区元素
区元素
D. 位于元素周期表中第三周期第ⅦA族,属于
位于元素周期表中第三周期第ⅦA族,属于 区元素
区元素
(3)下列有关说法正确的是_______ (填选项字母)。
A.第一电离能:G>F>E B.电负性:D>C C.原子半径:B>E D.最高价含氧酸的酸性:I>H

试回答下列问题:
(1)写出基态
 原子的电子排布式:
原子的电子排布式: 的原子序数:
的原子序数: 的简化电子排布式:
的简化电子排布式:(2)下列关于元素在元素周期表中的位置的叙述正确的是
A.
 位于元素周期表中第四周期第ⅡB族,属于
位于元素周期表中第四周期第ⅡB族,属于 区元素
区元素B.
 位于元素周期表中第四周期第ⅣB族,属于
位于元素周期表中第四周期第ⅣB族,属于 区元素
区元素C.
 位于元素周期表中第三周期第ⅡA族,属于
位于元素周期表中第三周期第ⅡA族,属于 区元素
区元素D.
 位于元素周期表中第三周期第ⅦA族,属于
位于元素周期表中第三周期第ⅦA族,属于 区元素
区元素(3)下列有关说法正确的是
A.第一电离能:G>F>E B.电负性:D>C C.原子半径:B>E D.最高价含氧酸的酸性:I>H
您最近一年使用:0次
2021-01-19更新
|
1123次组卷
|
4卷引用:天津市耀华中学2020-2021学年高二上学期期末考试化学试题
天津市耀华中学2020-2021学年高二上学期期末考试化学试题(已下线)专题二 原子结构与元素的性质-2020-2021学年高二《新题速递·化学》(人教版选修3)2月刊 (同步课堂必刷题)(已下线)专题二 原子结构与元素的性质-2020-2021学年高二《新题速递·化学》(人教版2019选择性必修2)2月刊 (同步课堂必刷题)第一章原子结构与性质(提升卷)
解题方法
9 . 如图是部分元素的第一电离能随原子序数变化的曲线(其中12~17号元素的有关数据缺失)。
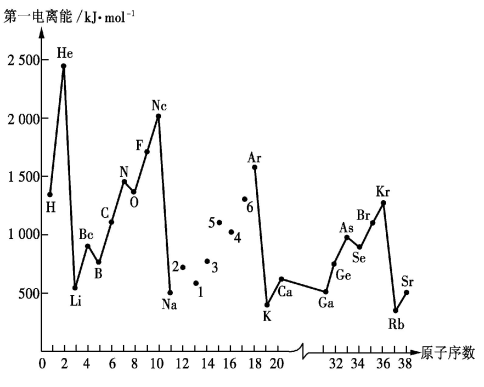
请回答下列问题:
(1)请写出ds区铜原子基态电子排布式_______
(2)同主族元素的第一电离能的变化规律是_______ 。
(3)图中第一电离能最小的元素在周期表中的位置是_______ 。
(4)根据对角线规则,Be、Al的最高价氧化物对应水化物的性质相似,它们都具有_______ 性,能证明 该性质的实验结论是
该性质的实验结论是______________ 。
(5)Na~Ar元素中,某元素M电离能如表所示:
①由此判断该元素是_______ ;
②分析图中同周期元素第一电离能的变化规律,推断:I1(Mg)_______ I1(M),其原因是_______ 。

请回答下列问题:
(1)请写出ds区铜原子基态电子排布式
(2)同主族元素的第一电离能的变化规律是
(3)图中第一电离能最小的元素在周期表中的位置是
(4)根据对角线规则,Be、Al的最高价氧化物对应水化物的性质相似,它们都具有
 该性质的实验结论是
该性质的实验结论是(5)Na~Ar元素中,某元素M电离能如表所示:
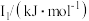 |  | 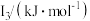 | 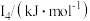 | 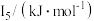 |
| 578 | 1817 | 2745 | 11575 | 14830 |
①由此判断该元素是
②分析图中同周期元素第一电离能的变化规律,推断:I1(Mg)
您最近一年使用:0次
解题方法
10 . 砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。回答下列问题:
(1)写出基态As 原子的核外电子排布式_____________ 。
(2)根据元素周期律,原子半径 Ga_____________ As(填“>”或“<”,下同),第一电离能 Ga_____________ As。
(3)AsCl3 分子的立体构型为_____________ 。
(4)锗(Ge)是典型的半导体元素,比较下表中锗卤化物的熔点和沸点,分析其变化规律及原因_____________ 。
(1)写出基态As 原子的核外电子排布式
(2)根据元素周期律,原子半径 Ga
(3)AsCl3 分子的立体构型为
(4)锗(Ge)是典型的半导体元素,比较下表中锗卤化物的熔点和沸点,分析其变化规律及原因
| GeCl4 | GeBr4 | GeI4 | |
| 熔点/℃ | −49.5 | 26 | 146 |
| 沸点/℃ | 83.1 | 186 | 约 400 |
您最近一年使用:0次



