解题方法
1 . A、B、C、D、E、F为六种原子序数依次增大的短周期元素,A、B、D位于同一主族,且D的原子半径在短周期元素原子中最大。C是周期表中电负性最大的元素。基态E原子的核外电子有7种空间运动状态。基态F原子有3个未成对电子。按要求回答下列问题:
(1)A和E可形成一种正四面体形的配合物离子,请写出该离子的化学式___________ 。
(2)基态原子第一电离能大小介于E和F之间的元素有___________ 。(用元素符号表示)
(3)氨硼烷(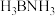 )是一种安全、高效的储氢材料。与N原子相连的H呈正电性,与B原子相连的H呈负电性,则氨硼烷分子中原子的电负性从大到小的顺序为
)是一种安全、高效的储氢材料。与N原子相连的H呈正电性,与B原子相连的H呈负电性,则氨硼烷分子中原子的电负性从大到小的顺序为___________ (用元素符号表示)。
(4)磷酸盐在微生物作用下可转化为 ,
, 的中心原子的杂化方式为
的中心原子的杂化方式为___________ 。 键角为93.6°,小于
键角为93.6°,小于 模型的预测值,原因为
模型的预测值,原因为___________ 。
(1)A和E可形成一种正四面体形的配合物离子,请写出该离子的化学式
(2)基态原子第一电离能大小介于E和F之间的元素有
(3)氨硼烷(
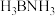 )是一种安全、高效的储氢材料。与N原子相连的H呈正电性,与B原子相连的H呈负电性,则氨硼烷分子中原子的电负性从大到小的顺序为
)是一种安全、高效的储氢材料。与N原子相连的H呈正电性,与B原子相连的H呈负电性,则氨硼烷分子中原子的电负性从大到小的顺序为(4)磷酸盐在微生物作用下可转化为
 ,
, 的中心原子的杂化方式为
的中心原子的杂化方式为 键角为93.6°,小于
键角为93.6°,小于 模型的预测值,原因为
模型的预测值,原因为
您最近一年使用:0次
2024-03-04更新
|
234次组卷
|
2卷引用:湖北省十堰市郧阳区第二中学2023-2024学年高二下学期三月月考化学试题
2 . 铜及其化合物在工农业生产中有广泛的应用。
I. 能与
能与 、
、 、
、 、
、 等形成配位数为4的配合物。
等形成配位数为4的配合物。
(1)向 溶液中加入过量
溶液中加入过量 溶液可生成
溶液可生成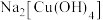 。
。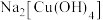 中除了配位键外,还存在的化学键类型有
中除了配位键外,还存在的化学键类型有_______ (填字母)。
A.离子键 B.金属键 C.极性共价键 D.非极性共价键 E.氢键
(2) 可以与乙二胺
可以与乙二胺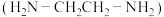 形成配离子,如图所示:
形成配离子,如图所示:
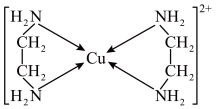
(1)C、N、O三种元素的第一电离能从大到小的顺序为_______ 。
(2)该配离子中的配体数与配位数之比为_______ 。
II.将含有未成对电子的物质置于外磁场中,会使磁场强度增大,称其为顺磁性物质。
(3)下列物质中,属于顺磁性物质的是_______(填字母)。
III.请回答以下问题:
(4)① ②
② ③
③
将上述物质键角按由大到小的顺序排列:_______ (用序号表示)。
(5)三甲胺(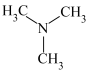 )和异丙胺(
)和异丙胺(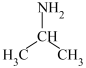 )的沸点大小关系为:三甲胺
)的沸点大小关系为:三甲胺_______ (填“>”“<”或“=”)异丙胺,原因是_______ 。
(6)基态原子的核外电子填充在5个轨道中的元素有_______ 种。
I.
 能与
能与 、
、 、
、 、
、 等形成配位数为4的配合物。
等形成配位数为4的配合物。(1)向
 溶液中加入过量
溶液中加入过量 溶液可生成
溶液可生成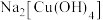 。
。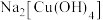 中除了配位键外,还存在的化学键类型有
中除了配位键外,还存在的化学键类型有A.离子键 B.金属键 C.极性共价键 D.非极性共价键 E.氢键
(2)
 可以与乙二胺
可以与乙二胺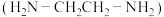 形成配离子,如图所示:
形成配离子,如图所示:
(1)C、N、O三种元素的第一电离能从大到小的顺序为
(2)该配离子中的配体数与配位数之比为
II.将含有未成对电子的物质置于外磁场中,会使磁场强度增大,称其为顺磁性物质。
(3)下列物质中,属于顺磁性物质的是_______(填字母)。
A. | B. | C. | D. |
III.请回答以下问题:
(4)①
 ②
② ③
③
将上述物质键角按由大到小的顺序排列:
(5)三甲胺(
 )和异丙胺(
)和异丙胺( )的沸点大小关系为:三甲胺
)的沸点大小关系为:三甲胺(6)基态原子的核外电子填充在5个轨道中的元素有
您最近一年使用:0次
3 . 太阳能的开发利用在新能源研究领域中占据重要地位。单晶硅太阳能电池片在加工时,一般掺杂微量的铜、硼、镓、硒、钛、矾等。回答下列问题:
(1)基态钒原子的电子排布式为___________ ,其中能量最高的电子所占据能级的原子轨道有_________ 个伸展方向。
(2)VO2+与 可形成配合物。
可形成配合物。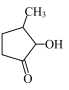 中,第二周期元素的第一电离能由大到小的顺序为
中,第二周期元素的第一电离能由大到小的顺序为_________ (用元素符号表示)。
(3)镓与硒相比,电负性更大的是________ (填元素符号)。
(4)已知高温下Cu2O比CuO更稳定,试从铜原子核外电子结构角度解释其原因:________________________________________ 。
(5)与钛同周期的所有元素的基态原子中,未成对电子数与钛相同的有_________ (填元素符号,下同)。
(6)在第二周期元素中,第一电离能介于B和N两元素之间的有_________ 。
(7)硒、硅均能与氢元素形成气态氢化物,若“Si—H”中共用电子对偏向氢元素,氢气与硒反应时单质硒是氧化剂,则硒与硅的电负性相对大小为 Se_________ (填“>”或“<”) Si 。与 Si 同周期的部分元素的电离能如图所示,其中a、b和c分别代表_________ (填字母)。
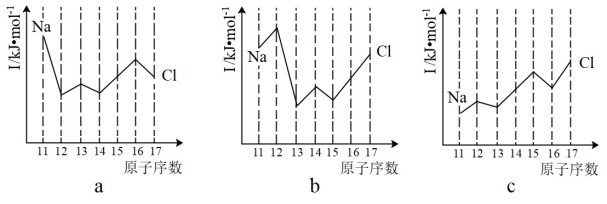
A. a为 ,b为
,b为 ,c为I3 B. a为
,c为I3 B. a为 ,b为
,b为 ,c为
,c为
C. a为 ,b为
,b为 ,c为I1 D. a为
,c为I1 D. a为 ,b为
,b为 ,c为
,c为
(1)基态钒原子的电子排布式为
(2)VO2+与
 可形成配合物。
可形成配合物。 中,第二周期元素的第一电离能由大到小的顺序为
中,第二周期元素的第一电离能由大到小的顺序为(3)镓与硒相比,电负性更大的是
(4)已知高温下Cu2O比CuO更稳定,试从铜原子核外电子结构角度解释其原因:
(5)与钛同周期的所有元素的基态原子中,未成对电子数与钛相同的有
(6)在第二周期元素中,第一电离能介于B和N两元素之间的有
(7)硒、硅均能与氢元素形成气态氢化物,若“Si—H”中共用电子对偏向氢元素,氢气与硒反应时单质硒是氧化剂,则硒与硅的电负性相对大小为 Se

A. a为
 ,b为
,b为 ,c为I3 B. a为
,c为I3 B. a为 ,b为
,b为 ,c为
,c为
C. a为
 ,b为
,b为 ,c为I1 D. a为
,c为I1 D. a为 ,b为
,b为 ,c为
,c为
您最近一年使用:0次
2023-03-26更新
|
354次组卷
|
2卷引用:湖北省鄂东南三校联考2022-2023学年高二下学期期中考试化学试题
名校
4 . 钇及其化合物在航天、电子、超导等方面有着广泛的应用,工业上以硅铍钇矿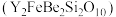 为原料生产氧化钇
为原料生产氧化钇 。
。
(1)钇( )位于元素周期表中钪(
)位于元素周期表中钪( )的下一周期,基态钇(
)的下一周期,基态钇( )原子的价电子排布图为
)原子的价电子排布图为_______ ,与 元素同周期的基态原子中,末成对电子数与
元素同周期的基态原子中,末成对电子数与 原子相同的元素还有
原子相同的元素还有_______ 种。
(2)在元素周期表中, 和
和 处于第二周期和第三周期的对角线位置,化学性质相似。
处于第二周期和第三周期的对角线位置,化学性质相似。
①写出 的最高价氧化物对应水化物与烧碱溶液反应的离子方程式:
的最高价氧化物对应水化物与烧碱溶液反应的离子方程式:_______ ;
②已知 元素和
元素和 元素的电负性分别为1.5和4.0,则它们形成的化合物是
元素的电负性分别为1.5和4.0,则它们形成的化合物是_______ (填“离子化合物”或“共价化合物”)。
(3) 与
与 、
、 均为第二周期元素,其部分电离能(I)数据如下:
均为第二周期元素,其部分电离能(I)数据如下:
① 元素的原子核外共有
元素的原子核外共有_______ 种不同空间运动状态的电子。
②由表格中数据可知 ;原因是
;原因是_______ 。判断a_______ b(填“>或 ”)。
”)。
(4)Fe位于元素周期表中_______ 区(按电子排布分区),实验室检验 的离子方程式为:
的离子方程式为:_______ 。
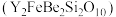 为原料生产氧化钇
为原料生产氧化钇 。
。(1)钇(
 )位于元素周期表中钪(
)位于元素周期表中钪( )的下一周期,基态钇(
)的下一周期,基态钇( )原子的价电子排布图为
)原子的价电子排布图为 元素同周期的基态原子中,末成对电子数与
元素同周期的基态原子中,末成对电子数与 原子相同的元素还有
原子相同的元素还有(2)在元素周期表中,
 和
和 处于第二周期和第三周期的对角线位置,化学性质相似。
处于第二周期和第三周期的对角线位置,化学性质相似。①写出
 的最高价氧化物对应水化物与烧碱溶液反应的离子方程式:
的最高价氧化物对应水化物与烧碱溶液反应的离子方程式:②已知
 元素和
元素和 元素的电负性分别为1.5和4.0,则它们形成的化合物是
元素的电负性分别为1.5和4.0,则它们形成的化合物是(3)
 与
与 、
、 均为第二周期元素,其部分电离能(I)数据如下:
均为第二周期元素,其部分电离能(I)数据如下:| 元素 |  |  |  | |
电离能 |  | 1086.5 | 1402.23 | 1313.9 |
 | 2352.6 | 2856.0 | 3388.3 | |
 | a | b | 5300.5 | |
 元素的原子核外共有
元素的原子核外共有②由表格中数据可知
 ;原因是
;原因是 ”)。
”)。(4)Fe位于元素周期表中
 的离子方程式为:
的离子方程式为:
您最近一年使用:0次
2023-01-12更新
|
264次组卷
|
3卷引用:湖北省云学新高考联盟2022-2023学年高二上学期期末联考化学试题
5 . I.雄黄( )、雌黄(
)、雌黄( )均可入药,具有解毒、杀菌、去燥湿的功效,也是中国画主要的黄色矿物质颜料。回答下列问题:
)均可入药,具有解毒、杀菌、去燥湿的功效,也是中国画主要的黄色矿物质颜料。回答下列问题:
(1)基态硫原子核外电子的运动轨道数有_______ 种;有___________ 种能量不同的电子;
(2)基态砷原子的价层电子的轨道表示式为___________ 。
(3)S和As比较,电负性较大的是___________
(4)As元素的第一电离能___________ Se元素的第一电离能(填“大于”“小于”或“等于”),原因是_______________________________ 。
II.目前已发现,在元素周期表中某些元素与右下方的主族元素的有些性质相似,这种相似性被称为对角线规则。据此回答下列问题:
(5)铍的最高价氧化物对应水化物的化学式是________ ,属于两性化合物,证明这一结论的有关离子方程式为__________________________ 、________________ 。
(6)若已知反应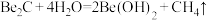 ,则
,则 与足量强碱溶液反应的离子方程式为
与足量强碱溶液反应的离子方程式为______________________ 。
(7)科学家证实, 属于共价化合物,请设计一个简单实验证明,方法是
属于共价化合物,请设计一个简单实验证明,方法是________________ 。用电子式表示 的形成过程:
的形成过程:__________
 )、雌黄(
)、雌黄( )均可入药,具有解毒、杀菌、去燥湿的功效,也是中国画主要的黄色矿物质颜料。回答下列问题:
)均可入药,具有解毒、杀菌、去燥湿的功效,也是中国画主要的黄色矿物质颜料。回答下列问题:(1)基态硫原子核外电子的运动轨道数有
(2)基态砷原子的价层电子的轨道表示式为
(3)S和As比较,电负性较大的是
(4)As元素的第一电离能
II.目前已发现,在元素周期表中某些元素与右下方的主族元素的有些性质相似,这种相似性被称为对角线规则。据此回答下列问题:
(5)铍的最高价氧化物对应水化物的化学式是
(6)若已知反应
 ,则
,则 与足量强碱溶液反应的离子方程式为
与足量强碱溶液反应的离子方程式为(7)科学家证实,
 属于共价化合物,请设计一个简单实验证明,方法是
属于共价化合物,请设计一个简单实验证明,方法是 的形成过程:
的形成过程:
您最近一年使用:0次
6 . 按要求回答下列问题:
(1)研究发现,在CO2低压合成甲醇反应CO2+3H2=CH3OH+H2O中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。Co基态原子核外电子排布为___________ ;元素Mn与O中,第一电离能较大的是___________ ,基态原子核外未成对电子数较多的是___________ 。
(2)我国科学家成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl。
①氮原子的价层电子排布图为___________ 。
②元素的基态的气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1),第二周期部分元素的E1变化趋势如图所示。
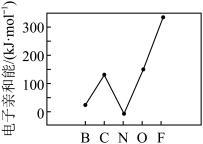
其中除氮元素外,其他元素的E1自左而右依次增大的原因是___________ ,氮元素E1呈现异常的原因是___________ 。
(1)研究发现,在CO2低压合成甲醇反应CO2+3H2=CH3OH+H2O中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。Co基态原子核外电子排布为
(2)我国科学家成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl。
①氮原子的价层电子排布图为
②元素的基态的气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1),第二周期部分元素的E1变化趋势如图所示。

其中除氮元素外,其他元素的E1自左而右依次增大的原因是
您最近一年使用:0次
2022-10-20更新
|
210次组卷
|
10卷引用:湖北省咸宁市嘉鱼县第一中学2019-2020学年高二下学期期末考试化学试题
湖北省咸宁市嘉鱼县第一中学2019-2020学年高二下学期期末考试化学试题广东省东莞市新世纪英才学校2021-2022学年高二上学期第一次教学质量检测化学试题(已下线)第1章 章末综合测评B-2021-2022学年高二化学同步课时跟踪训练(人教版2019选择性必修1)第一章 本章达标检测2河北省石家庄市第23中学2022-2023学年高二上学期第一次月考化学试题常州市武进区礼嘉中学2021-2022学年高二下学期第二次阶段测试化学试题湖南省衡阳县第四中学 2022-2023学年高二下学期开学摸底考试(平行班)化学试题(已下线)第一章 原子结构与性质(B卷) (已下线)考点33 原子结构与性质-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点46 原子结构与性质-备战2023年高考化学一轮复习考点帮(全国通用)
解题方法
7 . 研究发现,火星岩的主要成分有K2O、CaO、Na2O、MgO、Al2O3、Fe2O3、FeO、SiO2和H2O。
(1)基态铁原子的价层电子排布式为_______ 。
(2)Na、Mg、Al的第一电离能由大到小的是_______ 。
(3)Al2O3溶于NaOH溶液生成Na[Al(OH)4,[Al(OH)4]-中Al的杂化类型是_______ 。
(4)实验室用K3[Fe(CN)6]检验Fe2+,[Fe(CN)6]3-中σ键、π键数目之比为_______ 。
(5)晶体熔点:K2O_______ (填“>”或“<”)CaO,原因是_______ 。
(6)已知铁和镁形成的晶胞如图所示:

①在该晶胞中铁的配位数为_______ 。
②图中a处原子坐标参数为_______ 。
③已知该晶胞密度为ρg/cm3,NA为阿伏加德罗常数的值。该晶胞中Fe原子与Mg原子的最近距离是_______ pm(用含NA、ρ的代数式表示)。
(1)基态铁原子的价层电子排布式为
(2)Na、Mg、Al的第一电离能由大到小的是
(3)Al2O3溶于NaOH溶液生成Na[Al(OH)4,[Al(OH)4]-中Al的杂化类型是
(4)实验室用K3[Fe(CN)6]检验Fe2+,[Fe(CN)6]3-中σ键、π键数目之比为
(5)晶体熔点:K2O
(6)已知铁和镁形成的晶胞如图所示:

①在该晶胞中铁的配位数为
②图中a处原子坐标参数为
③已知该晶胞密度为ρg/cm3,NA为阿伏加德罗常数的值。该晶胞中Fe原子与Mg原子的最近距离是
您最近一年使用:0次
2022-04-20更新
|
1199次组卷
|
3卷引用:湖北省宜昌英杰学校2022-2023学年高二3月月考化学试题
8 . 根据原子结构、元素周期表和元素周期律的知识回答下列问题:
(1)A是1~36号元素原子核外电子排布中未成对电子数最多的元素,A元素的名称是______ ,在元素周期表中的位置是_______ 。
(2)B元素基态原子的轨道表示式是下图中的________ (填序号),另一轨道表示式不能作为基态原子的轨道表示式是因为它不符合_______ (填序号)。
①
②
A.能量最低原则 B.泡利不相容原理 C.洪特规则
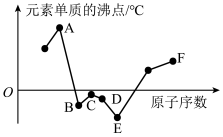
(3)下图表示8种短周期元素的原子序数(图中原子序数是连续的)和元素常见单质沸点的关系。其中第一电离能和电负性最大的元素分别是______ 、_______ (填序号);C、D、F元素的简单离子的半径由大到小的顺序是______ (用离子符号表示)。
(1)A是1~36号元素原子核外电子排布中未成对电子数最多的元素,A元素的名称是
(2)B元素基态原子的轨道表示式是下图中的
①

②

A.能量最低原则 B.泡利不相容原理 C.洪特规则
(3)下图表示8种短周期元素的原子序数(图中原子序数是连续的)和元素常见单质沸点的关系。其中第一电离能和电负性最大的元素分别是

您最近一年使用:0次
名校
解题方法
9 . 已知A、B、C、D都是短周期元素,它们的原子半径大小顺序为B>C>D>A。B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子有2个未成对电子。A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体。E是第四周期元素,其原子核外最外层电子数与A原子相同,其余各层电子均充满。
试回答下列问题(用元素符号或化学式表示):
(1)基态B原子中,核外存在___________ 个未成对电子。
(2)基态E2+的核外电子排布式为___________ 。
(3)基态D原子的最高能层的电子排布图为___________
(4)M分子中B原子轨道的杂化类型为___________ 。
(5)B、C、D三种元素的第一电离能由小到大的顺序为___________ 。
试回答下列问题(用元素符号或化学式表示):
(1)基态B原子中,核外存在
(2)基态E2+的核外电子排布式为
(3)基态D原子的最高能层的电子排布图为
(4)M分子中B原子轨道的杂化类型为
(5)B、C、D三种元素的第一电离能由小到大的顺序为
您最近一年使用:0次
2021-10-26更新
|
290次组卷
|
5卷引用:湖北省潜江市华中师范大学潜江附属中学高二上学期12月月考化学试题
10 . 完成下列填空
(1)写出下列基态原子的核外电子排布式。
Li:___________ ;N:___________ ;Ti:___________ ;Cu___________ 。
(2)钒元素在元素周期表中的位置是___________ 。
(3)X元素位于第三周期,同周期元素中其第一电离能最小,X的元素符号是___________ 。
(1)写出下列基态原子的核外电子排布式。
Li:
(2)钒元素在元素周期表中的位置是
(3)X元素位于第三周期,同周期元素中其第一电离能最小,X的元素符号是
您最近一年使用:0次
2021-10-03更新
|
382次组卷
|
3卷引用:湖北省潜江市华中师范大学潜江附属中学高二上学期12月月考化学试题
湖北省潜江市华中师范大学潜江附属中学高二上学期12月月考化学试题北京市昌平区2020-2021学年高二下学期期末考试化学试题(已下线)1.2.2 原子结构与元素周期律(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修2)



