解题方法
1 . 太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置。其材料除单晶硅外,还有铜、铟、镓、硒的化合物。
(1)镓的基态原子的核外电子排布式为___________ 。
(2)硒为第四周期元素,相邻的元素有砷和溴,则三种元素的第一电离能从大到小顺序为___________ (用元素符号表示)。
(3)气态SeO3的空间结构为___________ 。
(4)与镓元素处于同一主族的硼元素具有缺电子性,其化合物往往具有加合性,因而硼酸(H3BO3)在水溶液中能与水反应生成[B(OH)4]-而体现一元弱酸的性质,则[B(OH)4]-中B原子的杂化类型为___________ ,该离子___________ (填“含有”或“不含有”)配位键,其空间结构是___________ 。
(5)金属Cu单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,反应的离子方程式为___________ ,用价层电子对互斥模型分析,NH3分子和H2O分子的空间结构分别是___________ 、___________ 。
(1)镓的基态原子的核外电子排布式为
(2)硒为第四周期元素,相邻的元素有砷和溴,则三种元素的第一电离能从大到小顺序为
(3)气态SeO3的空间结构为
(4)与镓元素处于同一主族的硼元素具有缺电子性,其化合物往往具有加合性,因而硼酸(H3BO3)在水溶液中能与水反应生成[B(OH)4]-而体现一元弱酸的性质,则[B(OH)4]-中B原子的杂化类型为
(5)金属Cu单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,反应的离子方程式为
您最近一年使用:0次
解题方法
2 . 氮、氟及其化合物在生产及生活中有着广泛的用途。请回答下列问题:
(1)氟磷灰石可用于制取磷肥,基态P原子有_______________ 个未成对电子, 的中心P原子的杂化方式为
的中心P原子的杂化方式为____________________ 。
(2)氟气可以用于制取惰性强于 的保护气
的保护气 ,也可以用于制取聚合反应的催化剂
,也可以用于制取聚合反应的催化剂 ,
, 可以作为工业制取硅单质的中间物质
可以作为工业制取硅单质的中间物质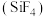 的原料。S、P、
的原料。S、P、 的第一电离能由大到小的顺序为
的第一电离能由大到小的顺序为_________________ 。
(3)键角比较:
___________  (填“>”或“<”)。
(填“>”或“<”)。
(1)氟磷灰石可用于制取磷肥,基态P原子有
 的中心P原子的杂化方式为
的中心P原子的杂化方式为(2)氟气可以用于制取惰性强于
 的保护气
的保护气 ,也可以用于制取聚合反应的催化剂
,也可以用于制取聚合反应的催化剂 ,
, 可以作为工业制取硅单质的中间物质
可以作为工业制取硅单质的中间物质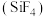 的原料。S、P、
的原料。S、P、 的第一电离能由大到小的顺序为
的第一电离能由大到小的顺序为(3)键角比较:

 (填“>”或“<”)。
(填“>”或“<”)。
您最近一年使用:0次
3 . 黄铁矿(主要成分为FeS2)的利用对资源和环境具有重要意义,一种酸性条件下催化氧化黄铁矿的物质转化关系如图所示,回答下列问题:
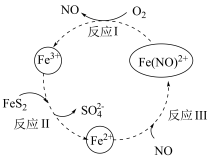
(1)基态氮原子的价层电子排布式为____________ 。
(2)基态氧原子的核外电子有________ 种空间运动状态,其电子占据的最高能级的电子云轮廓图为____ 形。
(3)第一电离能:N________ (填“>”“<”或“=”)O。
(4)反应Ⅱ的离子方程式为____________________ ,Fe3+的半径比Fe2+________ (填“大”或“小”),Fe3+的稳定性比Fe2+更________ (填“强”或“弱”)。

(1)基态氮原子的价层电子排布式为
(2)基态氧原子的核外电子有
(3)第一电离能:N
(4)反应Ⅱ的离子方程式为
您最近一年使用:0次
4 . 明代科学家宋应星在《天工开物》中写道:“凡玉入中国,贵者尽出于田、葱岭”。和田玉的主要化学成分是含水的钙镁硅酸盐。回答下列问题:
(1)某同学所画基态镁原子的核外电子排布图为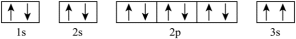 ,该电子排布图违背了
,该电子排布图违背了___________ 。
(2) 四种元素的第一电离能由大到小的顺序是
四种元素的第一电离能由大到小的顺序是___________ ; 的空间结构是
的空间结构是___________ 。
(3)Ca元素位于元素周期表中的___________ 区,Ca的前三级电离能数据依次为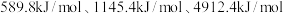 ,第三电离能增大较多的原因是
,第三电离能增大较多的原因是___________ 。
(4)硅与碳同族,键能:C-H___________ (填“大于”或“小于”) 。
。
(5)硅元素与碳元素同主族,硅元素和卤素单质反应可以得到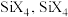 的熔、沸点如下表所示
的熔、沸点如下表所示 :
:
20℃时,呈液态的是___________ (填化学式),熔、沸点依次升高的原因是___________ 。
(1)某同学所画基态镁原子的核外电子排布图为
 ,该电子排布图违背了
,该电子排布图违背了(2)
 四种元素的第一电离能由大到小的顺序是
四种元素的第一电离能由大到小的顺序是 的空间结构是
的空间结构是(3)Ca元素位于元素周期表中的
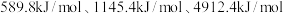 ,第三电离能增大较多的原因是
,第三电离能增大较多的原因是(4)硅与碳同族,键能:C-H
 。
。(5)硅元素与碳元素同主族,硅元素和卤素单质反应可以得到
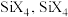 的熔、沸点如下表所示
的熔、沸点如下表所示 :
:| 化合物 |  |  |  |  |
熔点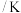 | 183.0 | 203.2 | 278.6 | 393.7 |
沸点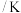 | 187.2 | 330.8 | 427.2 | 560.7 |
您最近一年使用:0次
5 . 钇及其化合物在航天、电子、超导等方面有着广泛的应用,工业上以硅铍钇矿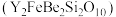 为原料生产氧化钇(
为原料生产氧化钇( )。
)。
(1)钇(Y)与钪同族,位于元素周期表中钪(Sc)的下一周期,基态钇(Y)原子的价电子排布图为______ ,与 元素同周期的基态原子中,未成对电子数与
元素同周期的基态原子中,未成对电子数与 原子相同的元素还有种
原子相同的元素还有种________ 。
(2)在元素周期表中, 和
和 处于第二周期和第三周期的对角线位置,化学性质相似。
处于第二周期和第三周期的对角线位置,化学性质相似。
①写出 的最高价氧化物对应水化物与烧碱溶液反应的离子方程式:
的最高价氧化物对应水化物与烧碱溶液反应的离子方程式:___________ 。
②已知 元素和
元素和 元素的电负性分别为1.5和4.0,则它们形成的化合物是
元素的电负性分别为1.5和4.0,则它们形成的化合物是_______ (填“离子化合物”或“共价化合物”)。
(3) 与
与 均为第二周期元素:
均为第二周期元素:
① 元素的原子核外共有
元素的原子核外共有____ 种不同空间运动状态的电子。
②电离能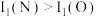 ,原因是
,原因是__________ 。
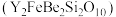 为原料生产氧化钇(
为原料生产氧化钇( )。
)。(1)钇(Y)与钪同族,位于元素周期表中钪(Sc)的下一周期,基态钇(Y)原子的价电子排布图为
 元素同周期的基态原子中,未成对电子数与
元素同周期的基态原子中,未成对电子数与 原子相同的元素还有种
原子相同的元素还有种(2)在元素周期表中,
 和
和 处于第二周期和第三周期的对角线位置,化学性质相似。
处于第二周期和第三周期的对角线位置,化学性质相似。①写出
 的最高价氧化物对应水化物与烧碱溶液反应的离子方程式:
的最高价氧化物对应水化物与烧碱溶液反应的离子方程式:②已知
 元素和
元素和 元素的电负性分别为1.5和4.0,则它们形成的化合物是
元素的电负性分别为1.5和4.0,则它们形成的化合物是(3)
 与
与 均为第二周期元素:
均为第二周期元素:①
 元素的原子核外共有
元素的原子核外共有②电离能
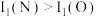 ,原因是
,原因是
您最近一年使用:0次
2024-01-06更新
|
368次组卷
|
3卷引用:陕西省榆林市第十中学2023-2024学年高二下学期第一次质量检测化学试题
名校
解题方法
6 . Goodenough等人因在锂离子电池及钴酸锂、磷酸铁锂等正极材料研究方面的卓越贡献而获得诺贝尔化学奖。回答下列问题:
(1)下列Li原子电子排布图表示的状态中,能量最低的为______ ,能量最高的为______ (填标号)。 与
与 离子中未成对的电子数之比为
离子中未成对的电子数之比为______ 。
(3) 与
与 具有相同的电子构型,
具有相同的电子构型,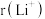 小于
小于 ,原因是
,原因是______ 。
(4)与铁同周期元素中,4s轨道半充满的元素______ (用元素符号表示)。
(5)已知:元素的一个气态原子获得电子成为气态阴离子时所放出的能量称为电子亲和能。下列有关说法正确的是______ (填字母)。
b.Na的第一电离能为603.4kJ/mol
c.Cl的第一电子亲和能为348.3kJ/mol
(1)下列Li原子电子排布图表示的状态中,能量最低的为
A. B.
B.
C. D.
D.
 与
与 离子中未成对的电子数之比为
离子中未成对的电子数之比为(3)
 与
与 具有相同的电子构型,
具有相同的电子构型,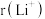 小于
小于 ,原因是
,原因是(4)与铁同周期元素中,4s轨道半充满的元素
(5)已知:元素的一个气态原子获得电子成为气态阴离子时所放出的能量称为电子亲和能。下列有关说法正确的是

b.Na的第一电离能为603.4kJ/mol
c.Cl的第一电子亲和能为348.3kJ/mol
您最近一年使用:0次
2024-01-03更新
|
259次组卷
|
2卷引用:陕西师范大学附属中学2023-2024学年高二上学期期中考试化学试题
7 . 火药的爆炸反应原理为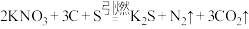 。请回答下列问题:
。请回答下列问题:
(1)基态 原子核外有
原子核外有___________ 种空间运动状态的电子。
(2)原子核外运动的电子有两种相反的自旋状态,若一种自旋状态用 表示,与之相反的用
表示,与之相反的用 表示称为电子的自旋磁量子数。对于基态的N原子,其价电子自旋磁量子数可能的代数和为
表示称为电子的自旋磁量子数。对于基态的N原子,其价电子自旋磁量子数可能的代数和为_______ 。
(3)基态钾离子的电子占据的最高能层符号是___________ ; 与
与 具有相同的核外电子排布,
具有相同的核外电子排布,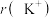 小于
小于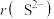 ,原因是
,原因是___________ 。
(4)元素的气态基态原子得到一个电子形成气态负一价离子时所放出的能量称为第一电子亲和能( )。MgO的Born-Haber循环(原理为盖斯定律)如图所示。
)。MgO的Born-Haber循环(原理为盖斯定律)如图所示。

由图可知,Mg原子的第二电离能为___________ kJ/mol;O=O键的键能为___________ kJ/mol;氧原子的第一电子亲和能为___________ kJ/mol(取正值)。
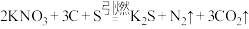 。请回答下列问题:
。请回答下列问题:(1)基态
 原子核外有
原子核外有(2)原子核外运动的电子有两种相反的自旋状态,若一种自旋状态用
 表示,与之相反的用
表示,与之相反的用 表示称为电子的自旋磁量子数。对于基态的N原子,其价电子自旋磁量子数可能的代数和为
表示称为电子的自旋磁量子数。对于基态的N原子,其价电子自旋磁量子数可能的代数和为(3)基态钾离子的电子占据的最高能层符号是
 与
与 具有相同的核外电子排布,
具有相同的核外电子排布,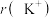 小于
小于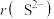 ,原因是
,原因是(4)元素的气态基态原子得到一个电子形成气态负一价离子时所放出的能量称为第一电子亲和能(
 )。MgO的Born-Haber循环(原理为盖斯定律)如图所示。
)。MgO的Born-Haber循环(原理为盖斯定律)如图所示。
由图可知,Mg原子的第二电离能为
您最近一年使用:0次
8 . 请回答下列问题:
(1)I 离子的立体构型是
离子的立体构型是___________ 。
(2)下列氟元素的不同微粒,用光谱仪可捕捉到发射光谱的是___________。
(3)第四周期主族元素中,第一电离能介于Ga、As之间的元素有___________ 种。
(4)Mn、Fe均为第四周期过渡金属元素,两元素的部分电离能数据如下表所示:
比较两元素的I2、I3可知,气态Mn2+再失去1个电子比气态Fe2+再失去1个电子难,对此你的解释是___________ 。
(5)氧是地壳中含量最多的元素。H+可与H2O形成H3O+,H3O+中H-O-H键角比H2O中H-O-H键角大,原因为___________ 。
(1)I
 离子的立体构型是
离子的立体构型是(2)下列氟元素的不同微粒,用光谱仪可捕捉到发射光谱的是___________。
| A.1s22s22p43s1 | B.1s22s22p43d2 | C.1s22s22p5 | D.1s22s22p6 |
(3)第四周期主族元素中,第一电离能介于Ga、As之间的元素有
(4)Mn、Fe均为第四周期过渡金属元素,两元素的部分电离能数据如下表所示:
| 元素 | Mn | Fe | |
| 电离能/kJ·mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
(5)氧是地壳中含量最多的元素。H+可与H2O形成H3O+,H3O+中H-O-H键角比H2O中H-O-H键角大,原因为
您最近一年使用:0次
9 . 铁、铬、锰统称为黑色金属,它们的单质、合金及其化合物在科研和生产中有着重要用途。请回答下列问题:
(1)铁位于周期表中___________ 族,铬的基态电子排布式为___________ 。
(2)基态铁、铬、锰原子中第一电离能较大的是___________ (填元素符号),原因为:___________ 。
(3)MnF2和MnCl2均为离子化合物,MnF2的熔点高于MnCl2熔点的原因为___________ 。
(4)化学式为CrC13·6H2O的化合物有三种结构,一种呈紫罗兰色,一种呈暗绿色,一种呈亮绿色,已知Cr3+的配位数均为6,将它们配制成等体积等浓度的溶液,分别加入足量AgNO3溶液,所得AgCl沉淀的物质的量之比为3:2:1。呈暗绿色的配合物的化学式为___________ 。
(1)铁位于周期表中
(2)基态铁、铬、锰原子中第一电离能较大的是
(3)MnF2和MnCl2均为离子化合物,MnF2的熔点高于MnCl2熔点的原因为
(4)化学式为CrC13·6H2O的化合物有三种结构,一种呈紫罗兰色,一种呈暗绿色,一种呈亮绿色,已知Cr3+的配位数均为6,将它们配制成等体积等浓度的溶液,分别加入足量AgNO3溶液,所得AgCl沉淀的物质的量之比为3:2:1。呈暗绿色的配合物的化学式为
您最近一年使用:0次
10 . 1869年2月17日,门捷列夫根据当时已有的63种元素编制出第一张元素周期表,门捷列夫在适当的位置预留下空格,并预言了新元素的性质。其中镓Ga和锗Ge的发现是对元素周期律有力的证明。镓位于元素周期表中第IIIA族、锗位于元素周期表中第IVA族。回答下列问题:
(1)基态锗原子的核外电子排布式为___________ 。基态As原子中核外电子的运动状态有___________ 种。第四周期主族元素中,第一电离能介于Ga、As之间的元素有___________ 种。
(2)氯化铝熔点为194℃,会升华,熔融态不易导电。实验测得气态氯化铝分子组成为Al2Cl6,其结构式为___________ (已知Al2Cl6中原子均满足8e-稳定结构)。
(3)钴元素可形成配合物[Co(NH3)6]Cl3,1mol该配合物含有σ键的数目为___________ 。该配合物中存在的化学键有___________ (填字母)。
A.离子键 B.极性键 C.非极性键 D.氢键 E.配位键
(4)键能的大小可以衡量化学键的强弱,也可以用于计算化学反应的反应热,回答下列问题:已知H—H键能为436kJ·mol-1,N—H键能为391kJ·mol-1,N≡N键能为946kJ·mol-1,合成氨反应中,反应前充入N2和H2各6mol,达到平衡时,N2的转化率为15%,试计算这种情况下,反应___________ 能量(填“吸收”或“放出”,1分)___________ kJ。
(1)基态锗原子的核外电子排布式为
(2)氯化铝熔点为194℃,会升华,熔融态不易导电。实验测得气态氯化铝分子组成为Al2Cl6,其结构式为
(3)钴元素可形成配合物[Co(NH3)6]Cl3,1mol该配合物含有σ键的数目为
A.离子键 B.极性键 C.非极性键 D.氢键 E.配位键
(4)键能的大小可以衡量化学键的强弱,也可以用于计算化学反应的反应热,回答下列问题:已知H—H键能为436kJ·mol-1,N—H键能为391kJ·mol-1,N≡N键能为946kJ·mol-1,合成氨反应中,反应前充入N2和H2各6mol,达到平衡时,N2的转化率为15%,试计算这种情况下,反应
您最近一年使用:0次
2023-05-21更新
|
355次组卷
|
3卷引用:陕西省西安市陕西师范大学附属中学渭北中学2022-2023学年高二下学期5月月考化学试题



