1 . 按要求回答问题。
(1)1 mol HCHO分子中含有σ键的数目为___________ NA。
(2)CS2分子中,共价键的类型有___________ 。
(3)下列物质中:
①MgCl2;②Na2O2; ③CS2 ;④NaOH;⑤H2。
只存在极性键的是___________ (填序号,下同),只存在非极性键的是___________ ,只存在离子键的是___________ ,既存在离子键又存在极性共价键的是___________ ,既存在离子键又存在非极性共价键的是___________ 。
(4)第一电离能比较Mg___________ Al,解释原因___________ 。
(1)1 mol HCHO分子中含有σ键的数目为
(2)CS2分子中,共价键的类型有
(3)下列物质中:
①MgCl2;②Na2O2; ③CS2 ;④NaOH;⑤H2。
只存在极性键的是
(4)第一电离能比较Mg
您最近一年使用:0次
2 . 磷酸亚铁锂(LiFePO4)和锰酸锂(LiMn2O4)均可用作锂电池的正极材料。回答下列问题:
(1)在周期表中,与Li化学性质最相似的邻族元素是___________ (填元素符号)。基态O原子的价电子排布图为___________ 。基态P原子电子占据最高能级的电子云在空间有___________ 个伸展方向。
(2)写出H2O2的电子式___________ 。
(3)原子核外电子有两种相反的自旋状态,分别用 和
和 表示,称为电子的自旋磁量子数。基态Mn原子的价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。基态Mn原子的价电子自旋磁量子数的代数和为___________ 。
(4)第三周期元素中,第一电离能介于A1和P之间的元素有___________ 种。
(5)Fe元素位于周期表的___________ 区。已知:I3(Mn)=3248kJ/mol,I3(Fe)=2957kJ/mol。第三电离能I3(Mn)>I3(Fe),其主要原因是___________ 。
(1)在周期表中,与Li化学性质最相似的邻族元素是
(2)写出H2O2的电子式
(3)原子核外电子有两种相反的自旋状态,分别用
 和
和 表示,称为电子的自旋磁量子数。基态Mn原子的价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。基态Mn原子的价电子自旋磁量子数的代数和为(4)第三周期元素中,第一电离能介于A1和P之间的元素有
(5)Fe元素位于周期表的
您最近一年使用:0次
3 . 硼及其化合物在制造、化工等领域都有广泛应用,回答下列问题:
(1)基态硼原子的价电子排布图为__________ ,其占据最高能级电子的电子云轮廓图形状为__________ ,基态硼原子比基态氮原子的第一电离能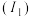 小,其原因为
小,其原因为__________ 。
(2) 是一种储氢材料,可由
是一种储氢材料,可由 和
和 反应制得:
反应制得:
① 由
由 和
和 构成,
构成, 的空间结构为
的空间结构为__________ 。
② 中B原子的杂化轨道类型为
中B原子的杂化轨道类型为__________ 。
③ 的键角为
的键角为__________ 。
(3)写出B与 溶液反应的离子方程式:
溶液反应的离子方程式:__________ 。
(4) 为一元弱酸[常温下,
为一元弱酸[常温下,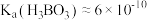 ]:
]:
① 与
与 溶液反应的离子方程式为
溶液反应的离子方程式为__________ 。
②常温下, 的硼酸的pH约为
的硼酸的pH约为__________ (已知: ,
, )。
)。
(1)基态硼原子的价电子排布图为
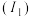 小,其原因为
小,其原因为(2)
 是一种储氢材料,可由
是一种储氢材料,可由 和
和 反应制得:
反应制得:①
 由
由 和
和 构成,
构成, 的空间结构为
的空间结构为②
 中B原子的杂化轨道类型为
中B原子的杂化轨道类型为③
 的键角为
的键角为(3)写出B与
 溶液反应的离子方程式:
溶液反应的离子方程式:(4)
 为一元弱酸[常温下,
为一元弱酸[常温下,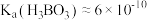 ]:
]:①
 与
与 溶液反应的离子方程式为
溶液反应的离子方程式为②常温下,
 的硼酸的pH约为
的硼酸的pH约为 ,
, )。
)。
您最近一年使用:0次
2024-03-07更新
|
128次组卷
|
2卷引用:河南省许平汝名校2023-2024学年高二下学期开学化学试题
4 . 根据已学知识,请回答下列问题:
(1)基态 N 原子中,核外电子占据的最高能层的符号是___________ ,占据该能层电子的原子轨道形状为___________ 。
(2)写出3p轨道上有2个未成对电子的元素的符号:___________ 。
(3)某元素被科学家称之为人体微量元素中的"防癌之王",其原子的价层电子排布式为4s24p4,该元素的名称是___________ 。
(4)已知铁是26号元素,写出基态 Fe 的价层电子排布式:___________ ;在元素周期表中,该元素在___________ (填“s”“p”“d”“f”或“ds”)区。
(5)从原子结的角度分析 B 、N和O的第一电能由大到小的顺序为___________ ,电负性由大到小的顺序是___________ 。
(1)基态 N 原子中,核外电子占据的最高能层的符号是
(2)写出3p轨道上有2个未成对电子的元素的符号:
(3)某元素被科学家称之为人体微量元素中的"防癌之王",其原子的价层电子排布式为4s24p4,该元素的名称是
(4)已知铁是26号元素,写出基态 Fe 的价层电子排布式:
(5)从原子结的角度分析 B 、N和O的第一电能由大到小的顺序为
您最近一年使用:0次
名校
5 . 2008年北京奥运会的“水立方”,在2022年冬奥会上华丽转身为“冰立方”,实现了奥运场馆的再利用,其美丽的透光气囊材料由乙烯 与四氟乙烯
与四氟乙烯 的共聚物(ETFE)制成。回答下列问题:
的共聚物(ETFE)制成。回答下列问题:
(1)基态F原子的价电子排布图(轨道表示式)为_______ 。
(2)图a、b、c分别表示C、N、O和F的逐级电离能Ⅰ变化趋势(纵坐标的标度不同)。第一电离能的变化图是_______ (填标号),判断的根据是_______ ;第三电离能的变化图是_______ (填标号)。

(3)氟化氢的沸点高于氯化氢的原因是_______ 。
(4)聚四氟乙烯的化学稳定性高于聚乙烯,从化学键的角度解释原因_______ 。
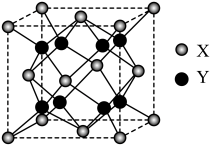
(5)萤石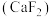 是自然界中常见的含氟矿物,其晶胞结构如图所示,X代表的离子是
是自然界中常见的含氟矿物,其晶胞结构如图所示,X代表的离子是_______ ;若该立方晶胞参数为a pm,正负离子的核间距最小为_______ pm。
 与四氟乙烯
与四氟乙烯 的共聚物(ETFE)制成。回答下列问题:
的共聚物(ETFE)制成。回答下列问题:(1)基态F原子的价电子排布图(轨道表示式)为
(2)图a、b、c分别表示C、N、O和F的逐级电离能Ⅰ变化趋势(纵坐标的标度不同)。第一电离能的变化图是

(3)氟化氢的沸点高于氯化氢的原因是
(4)聚四氟乙烯的化学稳定性高于聚乙烯,从化学键的角度解释原因
(5)萤石
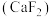 是自然界中常见的含氟矿物,其晶胞结构如图所示,X代表的离子是
是自然界中常见的含氟矿物,其晶胞结构如图所示,X代表的离子是
您最近一年使用:0次
6 . M、Q、R、X、Y为原子序数依次增大的短周期主族元素。M原子核外电子有6种运动状态,R和X同主族。Z、W是第四周期的过渡元素,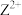 的核外d电子数是
的核外d电子数是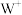 的核外d电子数的一半,
的核外d电子数的一半,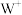 核外没有未成对电子。请回答下列问题:
核外没有未成对电子。请回答下列问题:
(1)基态Z原子的核外电子排布式为________ ,该元素位于________ 区。
(2)M、Q和R的第一电离能由小到大的顺序是________ (用元素符号表示)。
(3)比较简单离子的半径: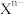
________  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(4)气态时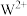 比
比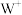
________ (填“稳定”或“不稳定”),原因是________ 。
(5)基态Y原子核外电子的空间运动状态有________ 种,与其同主族且位于第四周期元素的价层电子轨道表示式为________ 。
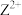 的核外d电子数是
的核外d电子数是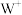 的核外d电子数的一半,
的核外d电子数的一半,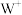 核外没有未成对电子。请回答下列问题:
核外没有未成对电子。请回答下列问题:(1)基态Z原子的核外电子排布式为
(2)M、Q和R的第一电离能由小到大的顺序是
(3)比较简单离子的半径:
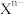
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。(4)气态时
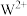 比
比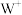
(5)基态Y原子核外电子的空间运动状态有
您最近一年使用:0次
2024-01-11更新
|
379次组卷
|
2卷引用:安徽省马鞍山市第二中学2023-2024学年高二下学期开学考试化学试题
名校
解题方法
7 . 我国科学家构建了新型催化剂“纳米片” ,该“纳米片”可用于氧化
,该“纳米片”可用于氧化 和吸附
和吸附 。回答下列问题:
。回答下列问题:
(1)基态Co原子的价层电子排布式为_______ ,N、C、Co中第一电离能最大的是_______ (填元素符号)。
(2)在空气中 会被氧化成
会被氧化成 ,
, 中S原子采用
中S原子采用_______ 杂化。已知氧族元素氢化物的熔沸点高低顺序为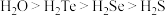 ,其原因是
,其原因是_______ 。
(3)氰 称为拟卤素,它的分子中每个原子最外层都达到8电子结构,则
称为拟卤素,它的分子中每个原子最外层都达到8电子结构,则 分子中σ键、π键个数之比为
分子中σ键、π键个数之比为_______ 。
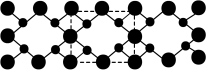
(4)氮和碳组成的一种新型材料,硬度超过金刚石,其部分结构如下图所示,它的化学式为_______ 。
 ,该“纳米片”可用于氧化
,该“纳米片”可用于氧化 和吸附
和吸附 。回答下列问题:
。回答下列问题:(1)基态Co原子的价层电子排布式为
(2)在空气中
 会被氧化成
会被氧化成 ,
, 中S原子采用
中S原子采用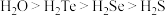 ,其原因是
,其原因是(3)氰
 称为拟卤素,它的分子中每个原子最外层都达到8电子结构,则
称为拟卤素,它的分子中每个原子最外层都达到8电子结构,则 分子中σ键、π键个数之比为
分子中σ键、π键个数之比为(4)氮和碳组成的一种新型材料,硬度超过金刚石,其部分结构如下图所示,它的化学式为

您最近一年使用:0次
2024-01-01更新
|
188次组卷
|
3卷引用:山东省菏泽市东明县第一中学2023-2024学年高二下学期开学化学试题
名校
解题方法
8 . 氮元素可以形成多种化合物。回答以下问题:
(1)基态氮原子的核外电子排布式是___________ 。
(2)N原子的第一电离能比O原子的第一电离能要大,可能原因是___________ 。
(3)NH3分子的VSEPR模型名称是___________ 。
(4)图1表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体的4个顶点(见图2),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别。
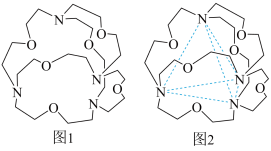
下列分子或离子中,能被该有机化合物识别的是___________(填标号)。
(5)下列说法正确的是___________。
(1)基态氮原子的核外电子排布式是
(2)N原子的第一电离能比O原子的第一电离能要大,可能原因是
(3)NH3分子的VSEPR模型名称是
(4)图1表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体的4个顶点(见图2),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别。

下列分子或离子中,能被该有机化合物识别的是___________(填标号)。
A. | B. | C. | D. |
| A.NO2、BF3、NCl3分子中没有一个分子中原子的最外层电子都满足了8电子稳定结构 |
| B.HCN的分子结构为直线形 |
C. 离子的VSEPR模型与空间结构是一致的 离子的VSEPR模型与空间结构是一致的 |
| D.NH3分子中有一对未成键的孤电子对,它对成键电子的排斥作用较强 |
您最近一年使用:0次
9 . 现有六种元素,其中A、B、C、D、E为短周期主族元素,F为第4周期元素,它们的原子序数依次增大。请根据下列相关信息回答问题。
(1)B元素基态原子具有_______ 种运动状态不同的电子,能量最高的电子,其电子云在空间有_______ 个伸 展方向。
(2)根据上述信息,画出C元素基态原子的轨道表示式_______ 。
(3)F在元素周期表中属于_______ 区元素,其基态原子核外共有_______ 个未成对电子。
(4)D、E两元素的第一电离能大小关系是_______ (用元素符号表示,下同),B、D两元素的电负性大小关系是_______ 。
(5)写出DA3的电子式:_______ (用元素符号表示)。
| 元素 | 相关信息 |
| A | 元素的原子核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B | 元素原子的核外p电子数比s电子数少1 |
| C | 元素的第一至第四电离能分别是I1=738 kJ/mol、I2=1451 kJ/mol、I3= 7733 kJ/mol、I4= 10540 kJ/mol |
| D | 原子核外填充电子的所有p轨道全满或半满 |
| E | 元素的主族序数与周期序数的差为3 |
| F | 在元素周期表的第6列 |
(2)根据上述信息,画出C元素基态原子的轨道表示式
(3)F在元素周期表中属于
(4)D、E两元素的第一电离能大小关系是
(5)写出DA3的电子式:
您最近一年使用:0次
2023-02-14更新
|
430次组卷
|
2卷引用:河北省唐山市2022-2023学年高二下学期开学考试化学试题
名校
10 . 我国科学家构建了新型催化剂“纳米片”(Co−N−C),该“纳米片”可用于氧化 和吸附
和吸附 。回答下列问题:
。回答下列问题:
(1)基态Co原子的价层电子排布式为______ ,N、C、Co中第一电离能最大的是______ (填元素符号)。
(2)在空气中 会被氧化成
会被氧化成 。
。 的空间结构是
的空间结构是______ , 中S原子采用
中S原子采用______ 杂化。已知氧族元素氢化物的熔沸点高低顺序为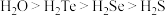 ,其原因是
,其原因是______ 。
(3)氰气 称为拟卤素,它的分子中每个原子最外层都达到8电子结构,则
称为拟卤素,它的分子中每个原子最外层都达到8电子结构,则 分子中σ键、π键个数之比为
分子中σ键、π键个数之比为______ 。
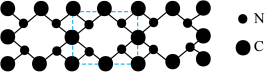
(4)氮和碳组成的一种新型材料,硬度超过金刚石,其部分结构如下图所示。它的化学式为______ 。
 和吸附
和吸附 。回答下列问题:
。回答下列问题:(1)基态Co原子的价层电子排布式为
(2)在空气中
 会被氧化成
会被氧化成 。
。 的空间结构是
的空间结构是 中S原子采用
中S原子采用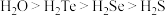 ,其原因是
,其原因是(3)氰气
 称为拟卤素,它的分子中每个原子最外层都达到8电子结构,则
称为拟卤素,它的分子中每个原子最外层都达到8电子结构,则 分子中σ键、π键个数之比为
分子中σ键、π键个数之比为(4)氮和碳组成的一种新型材料,硬度超过金刚石,其部分结构如下图所示。它的化学式为

您最近一年使用:0次
2023-02-10更新
|
619次组卷
|
3卷引用:湖南省株洲市炎陵县2023-2024学年高二下学期开学化学试题



