1 . 下表为元素周期表的一部分,请参照元素①—⑩在表中的位置,回答下列问题:___________ (用元素符号表示)。
(2)④、⑤、⑥的原子半径由大到小的顺序为___________ (用元素符号表示);
(3)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是___________ (用化学式表示)。
(4)①、④、⑤、⑧中的某些 元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:___________ 。
(5)第一电离能 :
: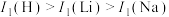 ,原因是
,原因是___________ 。
(6)基态⑧原子占据的最高能级的电子云轮廓图的形状是___________ 形;基态⑨原子的价层电子排布的轨道表示式为___________ ;元素⑩属于___________ 区(填“s”、“d”、“ds”或“p”)。
(7)由④元素形成的常见物质有很多,例如: 、
、 、
、 等,基态④原子的核外电子排布式是
等,基态④原子的核外电子排布式是___________ ,对 分子结构的研究,曾有以下推测:
分子结构的研究,曾有以下推测: 分子中
分子中___________ (填字母序号),确定其结构一定不是甲。
a. 键长 b.
键长 b. 键能 c.
键能 c. 键角
键角
(2)④、⑤、⑥的原子半径由大到小的顺序为
(3)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是
(4)①、④、⑤、⑧中的
(5)第一电离能
 :
: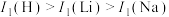 ,原因是
,原因是(6)基态⑧原子占据的最高能级的电子云轮廓图的形状是
(7)由④元素形成的常见物质有很多,例如:
 、
、 、
、 等,基态④原子的核外电子排布式是
等,基态④原子的核外电子排布式是 分子结构的研究,曾有以下推测:
分子结构的研究,曾有以下推测: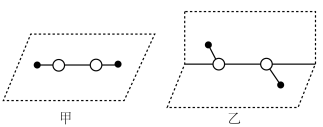
 分子中
分子中a.
 键长 b.
键长 b. 键能 c.
键能 c. 键角
键角
您最近一年使用:0次
2 . 将第二周期元素 、
、 、B按第一电离能递减顺序排列:
、B按第一电离能递减顺序排列:___________ >___________ >___________ 。
 、
、 、B按第一电离能递减顺序排列:
、B按第一电离能递减顺序排列:
您最近一年使用:0次
3 . 元素第一电离能的变化规律
(1)对于同一周期的元素而言,_____ 元素的第一电离能最小,_____ 元素的第一电离能最大;从左到右,元素的第一电离能在总体上呈现从_____ 到_____ 的变化趋势,表示元素原子越来越难失去电子。
(2)同主族元素,总体上自上而下第一电离能逐渐_____ ,表明自上而下原子越来越_____ 失去电子。
(3)过渡元素的第一电离能的变化不太规则,随着元素原子序数的增加,第一电离能总体上略有增加。这是因为对这些元素的原子来说,增加的电子大部分排布在_____ 或_____ 轨道上,原子核对外层电子的有效吸引作用变化不是太大。
(1)对于同一周期的元素而言,
(2)同主族元素,总体上自上而下第一电离能逐渐
(3)过渡元素的第一电离能的变化不太规则,随着元素原子序数的增加,第一电离能总体上略有增加。这是因为对这些元素的原子来说,增加的电子大部分排布在
您最近一年使用:0次
4 . 电离能的定义:_____ ,符号_____ ,单位_____ 。
第一电离能:_____ ,符号_____ ,
第二电离能:_____ ,符号_____ 。
第三电离能:……
同一原子的各级电离能之间存在如下关系:I1_____ I2_____ I3……。
第一电离能:
第二电离能:
第三电离能:……
同一原子的各级电离能之间存在如下关系:I1
您最近一年使用:0次
5 . 比较下列元素的第一电离能大小:
(1)N、O、F_____________
(2)He、Ne、Ar_______________
(3)Na、Mg、Al____________
(4)F、Cl、Br________________
(1)N、O、F
(2)He、Ne、Ar
(3)Na、Mg、Al
(4)F、Cl、Br
您最近一年使用:0次
6 . 合成氨是人类科学技术上的一项重大突破,在很大程度上解决了地球上因粮食不足而导致的饥饿问题,是化学和技术对社会发展与进步的巨大贡献。
(1)自然界中的氮元素主要以分子的形式存在于空气中,是人工固氮的主要来源。
①基态氮原子的核外电子排布式为______ ,占据最高能级电子的电子云轮廓图为______ 形。
②NH3分子中,与N原子相连的H显正电性。N、H电负性由大到小的顺序为______ 。
(2)铁触媒是普遍使用的以铁为主体的多成分催化剂,通常还含有Al2O3、K2O、CaO、MgO、Cr2O3等氧化物中的几种。
①上述氧化物所涉及的元素中,处于元素周期表中p区的元素是______ 。
②比较Mg、Ca的第一电离能:I1(Mg)______ (填“大于”或“小于”)I1(Ca)。
(3)我国科研人员研制出了“Fe-LiH”催化剂,温度、压强分别降到了350℃、1MPa。这是近年来合成氨反应研究中的重要突破。
①基态Fe原子的价电子排布图为______ ,铁在元素周期表中的位置_____ 。
②比较Li+与H-的半径大小关系:r(H-)______ r(Li+)(填“>”或“<”)。
(1)自然界中的氮元素主要以分子的形式存在于空气中,是人工固氮的主要来源。
①基态氮原子的核外电子排布式为
②NH3分子中,与N原子相连的H显正电性。N、H电负性由大到小的顺序为
(2)铁触媒是普遍使用的以铁为主体的多成分催化剂,通常还含有Al2O3、K2O、CaO、MgO、Cr2O3等氧化物中的几种。
①上述氧化物所涉及的元素中,处于元素周期表中p区的元素是
②比较Mg、Ca的第一电离能:I1(Mg)
(3)我国科研人员研制出了“Fe-LiH”催化剂,温度、压强分别降到了350℃、1MPa。这是近年来合成氨反应研究中的重要突破。
①基态Fe原子的价电子排布图为
②比较Li+与H-的半径大小关系:r(H-)
您最近一年使用:0次
7 . 元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能( )。
)。
(1)第二周期部分元素的 变化趋势如图所示,其中除氮元素外,其他元素的
变化趋势如图所示,其中除氮元素外,其他元素的 自左而右依次增大。而氮元素的
自左而右依次增大。而氮元素的 呈现异常的原因是
呈现异常的原因是___________ 。
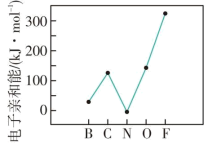
(2) 是离子化合物,下图是Born−Haber循环。
是离子化合物,下图是Born−Haber循环。
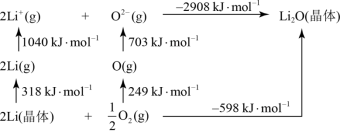
可知,Li原子的第一电离能为___________  ,
, 键键能为
键键能为___________  。
。
 )。
)。(1)第二周期部分元素的
 变化趋势如图所示,其中除氮元素外,其他元素的
变化趋势如图所示,其中除氮元素外,其他元素的 自左而右依次增大。而氮元素的
自左而右依次增大。而氮元素的 呈现异常的原因是
呈现异常的原因是
(2)
 是离子化合物,下图是Born−Haber循环。
是离子化合物,下图是Born−Haber循环。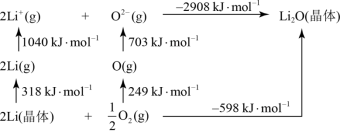
可知,Li原子的第一电离能为
 ,
, 键键能为
键键能为 。
。
您最近一年使用:0次
8 . 砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料。回答下列问题:
(1)写出基态33As原子的核外电子排布式_______
(2)原子半径Ga_______ As,第一电离能Ga_______ As。
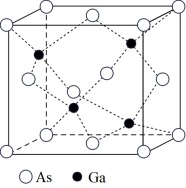
(3)GaAs熔点为1238℃,晶胞结构如图所示则晶体的类型为_______ 。
(1)写出基态33As原子的核外电子排布式
(2)原子半径Ga
(3)GaAs熔点为1238℃,晶胞结构如图所示则晶体的类型为

您最近一年使用:0次
9 . Li及其周期表中相邻元素的第一电离能(I1)如表所示。 ,原因是
,原因是_______ 。 ,原因是
,原因是_______ 。
 ,原因是
,原因是 ,原因是
,原因是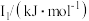 | ||
| Li 520 | Be 900 | B 801 |
| Na 496 | Mg 738 | Al 578 |
您最近一年使用:0次
10 . 三价铬离子(Cr3+)是葡萄糖耐量因子(GTF)的重要组成成分,GTF能够协助胰岛素发挥作用。构成葡萄糖耐量因子和蛋白质的元素有C、H、O、N、S、Cr等。回答下列问题:
(1)Cr的价层电子排布式为____ 。
(2)O、N、C的第一电离能由大到小的顺序为____ 。
(3)SO2分子的VSEPR模型名称为____ ,其中心原子的杂化方式为____ 。
(4)化学式为CrCl3•6H2O的化合物有多种结构,其中一种可表示为[CrCl2(H2O)4]Cl•2H2O,该物质的配离子中提供孤电子对的原子为____ ,配位数为____ 。
(1)Cr的价层电子排布式为
(2)O、N、C的第一电离能由大到小的顺序为
(3)SO2分子的VSEPR模型名称为
(4)化学式为CrCl3•6H2O的化合物有多种结构,其中一种可表示为[CrCl2(H2O)4]Cl•2H2O,该物质的配离子中提供孤电子对的原子为
您最近一年使用:0次



