1 . 回答下问题:
(1)Sm的价层电子排布式为 4f66s2 ,Sm3+价层电子排布式为___________ 。
(2)依据第二周期元素第一电离能的变化规律,参照如图元素 B 、F 的位置,用小黑点标 出 C 、N 、O 三种元素的相对位置___________ 。___________ 。
(4)H2S 和 H2Se 的参数对比见下表,其中 H2S 的键角大于 H2Se 的键角的原因可能为___________
(1)Sm的价层电子排布式为 4f66s2 ,Sm3+价层电子排布式为
(2)依据第二周期元素第一电离能的变化规律,参照如图元素 B 、F 的位置,用小黑点标 出 C 、N 、O 三种元素的相对位置

(4)H2S 和 H2Se 的参数对比见下表,其中 H2S 的键角大于 H2Se 的键角的原因可能为
| 化学式 | 键长/nm | 键角 | 沸点/℃ |
| H2S | 1.34 | 92.3° | -60.75 |
| H2Se | 1.47 | 91.0° | -41.50 |
您最近一年使用:0次
名校
解题方法
2 . 回答下列问题:
(1)麻醉剂的发现和使用是人类医学史上一项了不起的成就。一种常用麻醉剂氯仿常因保存不慎而被氧化,产生剧毒光气(COCl2):2CHCl3+O2→2HCl+2COCl2,光气(COCl2)分子的立体构型是___________ 形。
(2)某有机物的结构简式为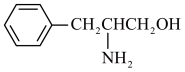 。该有机物分子是
。该有机物分子是___________ (填“极性”或“非极性”)分子,该有机物分子中采取sp3杂化的原子对应元素的第一电离能由大到小的顺序为___________ 。
(3)乙二胺(H2NCH2CH2NH2)分子中氮原子杂化类型为___________ ,乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高很多,原因___________ 。
(4)叠氮化合物是一类重要的化合物,其中氢叠氮酸(HN3)是一种弱酸,其分子结构可表示为H—N=N≡N,肼(N2H4)被亚硝酸氧化时便可得到氢叠氮酸(HN3),发生的反应为N2H4+HNO2=2H2O+HN3.HN3的酸性和醋酸相近,可微弱电离出H+和N 。
。
①叠氮酸根能与许多金属离子等形成配合物,如[Co(N3)(NH3)5]SO4,根据价层电子对互斥理论判断SO 的空间构型为
的空间构型为___________ 。
②下列有关说法正确的是___________ (填序号)。
A.HN3中含有5个σ键
B.HN3中的三个氮原子均采用sp2杂化
C.HN3、HNO2、H2O、N2H4都是极性分子
D.肼(N2H4)的沸点高达113.5℃,说明肼分子间可形成氢键
(1)麻醉剂的发现和使用是人类医学史上一项了不起的成就。一种常用麻醉剂氯仿常因保存不慎而被氧化,产生剧毒光气(COCl2):2CHCl3+O2→2HCl+2COCl2,光气(COCl2)分子的立体构型是
(2)某有机物的结构简式为
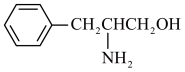 。该有机物分子是
。该有机物分子是(3)乙二胺(H2NCH2CH2NH2)分子中氮原子杂化类型为
(4)叠氮化合物是一类重要的化合物,其中氢叠氮酸(HN3)是一种弱酸,其分子结构可表示为H—N=N≡N,肼(N2H4)被亚硝酸氧化时便可得到氢叠氮酸(HN3),发生的反应为N2H4+HNO2=2H2O+HN3.HN3的酸性和醋酸相近,可微弱电离出H+和N
 。
。①叠氮酸根能与许多金属离子等形成配合物,如[Co(N3)(NH3)5]SO4,根据价层电子对互斥理论判断SO
 的空间构型为
的空间构型为②下列有关说法正确的是
A.HN3中含有5个σ键
B.HN3中的三个氮原子均采用sp2杂化
C.HN3、HNO2、H2O、N2H4都是极性分子
D.肼(N2H4)的沸点高达113.5℃,说明肼分子间可形成氢键
您最近一年使用:0次
名校
3 . 回答下列问题
(1)写出 的价电子排布式
的价电子排布式______ 。
(2)实验室用软锰矿和浓盐酸制氯气,写出该反应的化学方程式______ 。
(3)在常温下, 溶液的pH=9,则溶液中由水电离出来的
溶液的pH=9,则溶液中由水电离出来的
______ 。
(4)火箭发射可以用肼( ,液态)作燃料,
,液态)作燃料, 作氧化剂,两者反应生成
作氧化剂,两者反应生成 和水蒸气。
和水蒸气。
已知: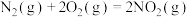
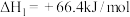 ;
;
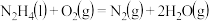
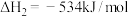
请写出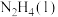 与
与 反应的热化学方程式
反应的热化学方程式______ 。
(5)下表列出了某短周期元素R的各级电离能数据(用 、
、 ……表示)。
……表示)。
关于元素R的下列推断中,正确的是______ (用相应的编号填写)
①R元素位于元素周期表中第ⅡA族
②R元素基态原子的电子排布式为
③R元素的最高价氧化物可表示为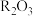
④R元素的第一电离能高于同周期相邻元素的第一电离能
(1)写出
 的价电子排布式
的价电子排布式(2)实验室用软锰矿和浓盐酸制氯气,写出该反应的化学方程式
(3)在常温下,
 溶液的pH=9,则溶液中由水电离出来的
溶液的pH=9,则溶液中由水电离出来的
(4)火箭发射可以用肼(
 ,液态)作燃料,
,液态)作燃料, 作氧化剂,两者反应生成
作氧化剂,两者反应生成 和水蒸气。
和水蒸气。已知:
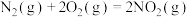
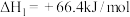 ;
;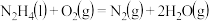
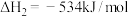
请写出
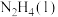 与
与 反应的热化学方程式
反应的热化学方程式(5)下表列出了某短周期元素R的各级电离能数据(用
 、
、 ……表示)。
……表示)。元素 | 电离能 | |||||
|
|
|
|
| … | |
| 740 | 1500 | 7700 | 10500 | 13630 | … |
①R元素位于元素周期表中第ⅡA族
②R元素基态原子的电子排布式为

③R元素的最高价氧化物可表示为
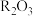
④R元素的第一电离能高于同周期相邻元素的第一电离能
您最近一年使用:0次
解题方法
4 . 中国第一辆火星车“祝融号”成功登陆火星。探测发现火星上存在大量橄榄石矿物(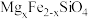 )。回答下列问题:
)。回答下列问题:
(1)基态Fe原子的价电子排布式为__________ 。橄榄石中,各元素电负性大小顺序为__________ ,铁的化合价为__________ 。
(2) 分子的空间结构(以
分子的空间结构(以 为中心)名称为
为中心)名称为__________ ,分子中氮原子的杂化轨道类型是__________ 。 原子核外有种不同运动状态的电子
原子核外有种不同运动状态的电子__________ 。
(3)由硅原子核形成的三种微粒,电子排布式分别为:① 、②
、② 、③
、③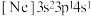 ,有关这些微粒的叙述,正确的是___________。
,有关这些微粒的叙述,正确的是___________。
(4)根据价层电子对互斥理论,NH3、 、
、 中,中心原子价层电子对数不同于其他两种粒子的是
中,中心原子价层电子对数不同于其他两种粒子的是___________ (填化学式); 与
与 中O-N-O的键角:
中O-N-O的键角: 
________  (填“<”、“>”、“=”),解释原因
(填“<”、“>”、“=”),解释原因__________ 。
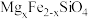 )。回答下列问题:
)。回答下列问题:(1)基态Fe原子的价电子排布式为
(2)
 分子的空间结构(以
分子的空间结构(以 为中心)名称为
为中心)名称为 原子核外有种不同运动状态的电子
原子核外有种不同运动状态的电子(3)由硅原子核形成的三种微粒,电子排布式分别为:①
 、②
、② 、③
、③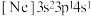 ,有关这些微粒的叙述,正确的是___________。
,有关这些微粒的叙述,正确的是___________。| A.微粒半径:③>①>② |
| B.电子排布属于基态原子(或离子)的是:①② |
| C.电离一个电子所需最低能量:①>②>③ |
| D.得电子能力:①>② |
 、
、 中,中心原子价层电子对数不同于其他两种粒子的是
中,中心原子价层电子对数不同于其他两种粒子的是 与
与 中O-N-O的键角:
中O-N-O的键角: 
 (填“<”、“>”、“=”),解释原因
(填“<”、“>”、“=”),解释原因
您最近一年使用:0次
解题方法
5 . 太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置。其材料除单晶硅外,还有铜、铟、镓、硒的化合物。
(1)镓的基态原子的核外电子排布式为___________ 。
(2)硒为第四周期元素,相邻的元素有砷和溴,则三种元素的第一电离能从大到小顺序为___________ (用元素符号表示)。
(3)气态SeO3的空间结构为___________ 。
(4)与镓元素处于同一主族的硼元素具有缺电子性,其化合物往往具有加合性,因而硼酸(H3BO3)在水溶液中能与水反应生成[B(OH)4]-而体现一元弱酸的性质,则[B(OH)4]-中B原子的杂化类型为___________ ,该离子___________ (填“含有”或“不含有”)配位键,其空间结构是___________ 。
(5)金属Cu单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,反应的离子方程式为___________ ,用价层电子对互斥模型分析,NH3分子和H2O分子的空间结构分别是___________ 、___________ 。
(1)镓的基态原子的核外电子排布式为
(2)硒为第四周期元素,相邻的元素有砷和溴,则三种元素的第一电离能从大到小顺序为
(3)气态SeO3的空间结构为
(4)与镓元素处于同一主族的硼元素具有缺电子性,其化合物往往具有加合性,因而硼酸(H3BO3)在水溶液中能与水反应生成[B(OH)4]-而体现一元弱酸的性质,则[B(OH)4]-中B原子的杂化类型为
(5)金属Cu单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,反应的离子方程式为
您最近一年使用:0次
名校
解题方法
6 . 晶体硅是制备太阳能电池板的主要原料,电池板中还含有硼、氮、钛、钴、钙等多种化学物质。请回答下列问题:
(1)科学家常利用仪器进行___________ 实验来区分晶体硼和无定形硼,二者之间的关系互为___________ 。第二周期元素的第一电离能按由小到大的顺序排列,B元素排在第___________ 位,其基态能量最高的能级电子云轮廓图为___________ 形。
(2)硅酸根有多种结构形式,一种无限长链状结构如图1所示,其化学式为___________ ,Si原子的杂化类型为___________ 。 的几何构型为正八面体形,Co在中心。
的几何构型为正八面体形,Co在中心。 中,1个Co提供
中,1个Co提供___________ 个空轨道。该配位离子的作用力为___________ (填序号)。
A.金属键 B.离子键 C.共价键 D.配位键 E.氢键
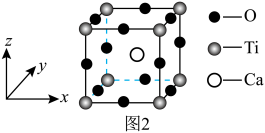
(4)一种由Ca、Ti、O三种元素形成的晶体的立方晶胞结构如图2所示。与Ti紧邻的Ca有___________ 个。晶胞中Ca原子坐标参数为___________ 。
(1)科学家常利用仪器进行
(2)硅酸根有多种结构形式,一种无限长链状结构如图1所示,其化学式为

 的几何构型为正八面体形,Co在中心。
的几何构型为正八面体形,Co在中心。 中,1个Co提供
中,1个Co提供A.金属键 B.离子键 C.共价键 D.配位键 E.氢键
(4)一种由Ca、Ti、O三种元素形成的晶体的立方晶胞结构如图2所示。与Ti紧邻的Ca有
您最近一年使用:0次
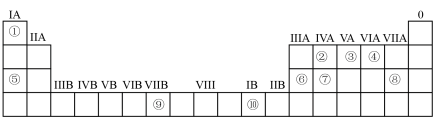
7 . 下表为元素周期表的一部分,请参照元素①—⑩在表中的位置,回答下列问题:___________ (用元素符号表示)。
(2)④、⑤、⑥的原子半径由大到小的顺序为___________ (用元素符号表示);
(3)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是___________ (用化学式表示)。
(4)①、④、⑤、⑧中的某些 元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:___________ 。
(5)第一电离能 :
: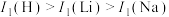 ,原因是
,原因是___________ 。
(6)基态⑧原子占据的最高能级的电子云轮廓图的形状是___________ 形;基态⑨原子的价层电子排布的轨道表示式为___________ ;元素⑩属于___________ 区(填“s”、“d”、“ds”或“p”)。
(7)由④元素形成的常见物质有很多,例如: 、
、 、
、 等,基态④原子的核外电子排布式是
等,基态④原子的核外电子排布式是___________ ,对 分子结构的研究,曾有以下推测:
分子结构的研究,曾有以下推测: 分子中
分子中___________ (填字母序号),确定其结构一定不是甲。
a. 键长 b.
键长 b. 键能 c.
键能 c. 键角
键角
(2)④、⑤、⑥的原子半径由大到小的顺序为
(3)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是
(4)①、④、⑤、⑧中的
(5)第一电离能
 :
: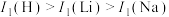 ,原因是
,原因是(6)基态⑧原子占据的最高能级的电子云轮廓图的形状是
(7)由④元素形成的常见物质有很多,例如:
 、
、 、
、 等,基态④原子的核外电子排布式是
等,基态④原子的核外电子排布式是 分子结构的研究,曾有以下推测:
分子结构的研究,曾有以下推测: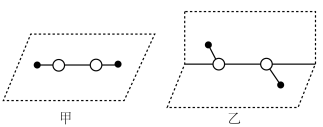
 分子中
分子中a.
 键长 b.
键长 b. 键能 c.
键能 c. 键角
键角
您最近一年使用:0次
解题方法
8 . 回答下列问题。
(1)写出铬原子价电子排布式:___________ ;与铬同一周期的元素原子中最外层电子数与铬原子的相同的元素有___________ (填元素符号)。
(2)第三周期第一电离能处于Al和P之间的元素有___________ 种。
(3)NO 互为等电子体的分子或离子为
互为等电子体的分子或离子为___________ 。
(4)1 mol CH2=CH-CH2OH含___________ molσ键,该分子中碳原子的杂化类型为___________ 。
(1)写出铬原子价电子排布式:
(2)第三周期第一电离能处于Al和P之间的元素有
(3)NO
 互为等电子体的分子或离子为
互为等电子体的分子或离子为(4)1 mol CH2=CH-CH2OH含
您最近一年使用:0次
9 . 按要求回答问题。
(1)1 mol HCHO分子中含有σ键的数目为___________ NA。
(2)CS2分子中,共价键的类型有___________ 。
(3)下列物质中:
①MgCl2;②Na2O2; ③CS2 ;④NaOH;⑤H2。
只存在极性键的是___________ (填序号,下同),只存在非极性键的是___________ ,只存在离子键的是___________ ,既存在离子键又存在极性共价键的是___________ ,既存在离子键又存在非极性共价键的是___________ 。
(4)第一电离能比较Mg___________ Al,解释原因___________ 。
(1)1 mol HCHO分子中含有σ键的数目为
(2)CS2分子中,共价键的类型有
(3)下列物质中:
①MgCl2;②Na2O2; ③CS2 ;④NaOH;⑤H2。
只存在极性键的是
(4)第一电离能比较Mg
您最近一年使用:0次
解题方法
10 . 硅材料在生活中占有重要地位。请回答:
(1) 分子的空间结构(以
分子的空间结构(以 为中心)名称为
为中心)名称为___________ ,分子中氮原子的杂化轨道类型是___________ 。 受热分解生成
受热分解生成 和
和 ,其受热不稳定的原因是
,其受热不稳定的原因是___________ 。
(2)由硅原子核形成的三种微粒,电子排布式分别为:①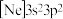 、②
、② 、③
、③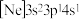 ,有关这些微粒的叙述,正确的是___________。
,有关这些微粒的叙述,正确的是___________。
(1)
 分子的空间结构(以
分子的空间结构(以 为中心)名称为
为中心)名称为 受热分解生成
受热分解生成 和
和 ,其受热不稳定的原因是
,其受热不稳定的原因是(2)由硅原子核形成的三种微粒,电子排布式分别为:①
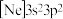 、②
、② 、③
、③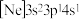 ,有关这些微粒的叙述,正确的是___________。
,有关这些微粒的叙述,正确的是___________。| A.微粒半径:③>②>① | B.电子排布属于基态原子(或离子)的是:①② |
| C.电离一个电子所需最低能量:①>②>③ | D.得电子能力:①>② |
您最近一年使用:0次








