2014·山东德州·二模
1 . 天冬酰胺(结构如图)在芦笋中含量丰富,具有提高身体免疫力的功效。

(1)天冬酰胺所含元素中, (填元素名称)元素基态原子核外未成对电子数最多,天冬酰胺中碳原子的杂化轨道类型有 种。
(2)H2S和H2Se的参数对比见表。
①H2Se的晶体类型为 ,含有的共价键类型为 。
②H2S的键角大于H2Se的原因可能为 。
(3)已知钼(Mo)位于第五周期VIB族,钼、铬、锰的部分电离能如下表所示
A是 (填元素符号),B的价电子排布式为 。

(1)天冬酰胺所含元素中, (填元素名称)元素基态原子核外未成对电子数最多,天冬酰胺中碳原子的杂化轨道类型有 种。
(2)H2S和H2Se的参数对比见表。
| 化学式 | 键长/nm | 键角 | 沸点/℃ |
| H2S | 1.34 | 92.3o | 一60.75 |
| H2Se | 1.47 | 91.0o | 一41.50 |
①H2Se的晶体类型为 ,含有的共价键类型为 。
②H2S的键角大于H2Se的原因可能为 。
(3)已知钼(Mo)位于第五周期VIB族,钼、铬、锰的部分电离能如下表所示
| 编号 | I5/kJ·mol-1 | I6/kJ·mol-1 | I7/kJ·mol-1 | I8/kJ·mol-1 |
| A | 6990 | 9220 | 11500 | 18770 |
| B | 6702 | 8745 | 15455 | 17820 |
| C | 5257 | 6641 | 12125 | 13860 |
A是 (填元素符号),B的价电子排布式为 。
您最近一年使用:0次
13-14高二下·湖北襄阳·期中
2 . A、B、C、D、E都是元素周期表中的前20号元素,它们的原子序数依次递增。已知B、D两种元素原子的最外层电子数是最内层电子数的两倍,而C元素原子的最外层电子数等于B元素原子的核外电子数,E的价电子数为1.回答下列问题。
(1)画出C元素的原子结构示意图_______ 。
(2)在1mol DC2中,有___ mol D—C键。
(3)在化合物BC2的晶体中,每个BC2分子周围与它距离最近的BC2分子有___ 个。
(4)原子序数介于B、C之间的元素X和B、C都可与A形成10e-的化合物。则X、B、C的第一电离能顺序是_____ (填元素符号),三种10e-的化合物中沸点最低的___ 。
(5)已知高温下C和E元素形成的晶体呈立方体结构,晶体中元素C的化合价部分为0价,部分为-2价。如下图所示为C和E元素形成的晶体的一个晶胞(晶体中最小的重复单元),则下列说法中正确的是__________ 。
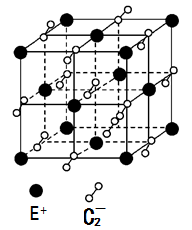
A.该晶体化学式为EC2(KO2),每个晶胞含有个4个E+和4个C2-
B.晶体中每个E+周围有8个C2-,每个C2-周围有8个E+
C.晶体中与每个E+距离最近的E+有8个
D.晶体中,0价C与-2价C的数目比为3:1
E.C2-与N2互为等电子体
(1)画出C元素的原子结构示意图
(2)在1mol DC2中,有
(3)在化合物BC2的晶体中,每个BC2分子周围与它距离最近的BC2分子有
(4)原子序数介于B、C之间的元素X和B、C都可与A形成10e-的化合物。则X、B、C的第一电离能顺序是
(5)已知高温下C和E元素形成的晶体呈立方体结构,晶体中元素C的化合价部分为0价,部分为-2价。如下图所示为C和E元素形成的晶体的一个晶胞(晶体中最小的重复单元),则下列说法中正确的是

A.该晶体化学式为EC2(KO2),每个晶胞含有个4个E+和4个C2-
B.晶体中每个E+周围有8个C2-,每个C2-周围有8个E+
C.晶体中与每个E+距离最近的E+有8个
D.晶体中,0价C与-2价C的数目比为3:1
E.C2-与N2互为等电子体
您最近一年使用:0次
9-10高二下·吉林·期中
3 . A、B、C、D是四种短周期元素,E是过渡元素。A、B、C同周期,C、D同主族,A的原子结构示意图为: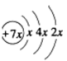 ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:
(1)写出下列元素的符号:A_________ B__________ C __________ D __________
(2)用化学式表示上述五种元素中最高价氧化物对应水化物酸性最强的是__________ ,碱性最强的是_________ 。
(3)用元素符号表示D所在周期(除稀有气体元素外)第一电离能最大的元素是__________ ,电负性最大的元素是__________ 。
(4)D的氢化物比C的氢化物的沸点__________ (填"高"或"低"),原因_____________
(5)E元素原子的核电荷数是__________ ,E元素在周期表的第_______ 周期,第________ 族,已知元素周期表可按电子排布分为s区、p区等,则E元素在_______ 区。
(6)A、B、C最高价氧化物的晶体类型是分别是______ 晶体、______ 晶体、_____ 晶体。
(7)画出D的核外电子排布图_____________________ ,这样排布遵循了_______ 规则。
(8)用电子式表示B的硫化物的形成过程:______________________________________
 ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:(1)写出下列元素的符号:A
(2)用化学式表示上述五种元素中最高价氧化物对应水化物酸性最强的是
(3)用元素符号表示D所在周期(除稀有气体元素外)第一电离能最大的元素是
(4)D的氢化物比C的氢化物的沸点
(5)E元素原子的核电荷数是
(6)A、B、C最高价氧化物的晶体类型是分别是
(7)画出D的核外电子排布图
(8)用电子式表示B的硫化物的形成过程:
您最近一年使用:0次
11-12高二下·福建福州·阶段练习
4 . 根据下列五种元素的电离能数据(单位:kJ/mol),回答(1)~(5)小题:
(1)在周期表中,最可能处于同一族的是_________ ;
A.Q和R B.S和T C.T和V D.R和V
(2)若R、S、T、V均为金属元素,且R、S、T同周期,则这四种元素中最活泼的是_________ ;
A.R B.S C.T D.V
(3)S元素最可能是_________ ;
A.s区元素 B.p区元素 C.d区元素 D.稀有气体元素
(4)由T元素形成的氯化物的化学式为_________ ;
A.TCl B.TCl2 C.TCl3 D.TCl4
(5)下列元素中物理性质和化学性质最像Q元素的是_________ 。
A.氢 B.氦 C.碳 D.铍
| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 2080 | 4000 | 6100 | 9400 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| V | 420 | 3100 | 4400 | 5900 |
(1)在周期表中,最可能处于同一族的是
A.Q和R B.S和T C.T和V D.R和V
(2)若R、S、T、V均为金属元素,且R、S、T同周期,则这四种元素中最活泼的是
A.R B.S C.T D.V
(3)S元素最可能是
A.s区元素 B.p区元素 C.d区元素 D.稀有气体元素
(4)由T元素形成的氯化物的化学式为
A.TCl B.TCl2 C.TCl3 D.TCl4
(5)下列元素中物理性质和化学性质最像Q元素的是
A.氢 B.氦 C.碳 D.铍
您最近一年使用:0次
11-12高二上·四川成都·期中
5 . 下表为长式周期表的一部分,其中的编号代表对应的元素。
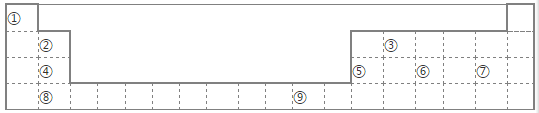
请回答下列问题:
(1)表中元素①的6个原子与元素③的6个原子形成的某种环状分子名称为 ;③和⑦形成的一种常见溶剂的化学式为 ,其立体构型为________________。
(2)某元素原子的外围电子排布式为nsnnpn+1,该元素原子的最外电子层上孤电子对数为 ;该元素与元素①形成的最简单分子X属于 分子(填“极性”或“非极性”)。
(3)元素④的第一电离能 元素⑤(选填“>”、“=”、“<”)的第一电离能;元素⑥的电负性 元素⑦(选填“>”、“=”、“<”)的电负性。
(4)元素⑦和⑧形成的化合物的电子式为 。
(5)元素⑨的基态原子核外电子排布式是 。
(6)某些不同族元素的性质也有一定的相似性,如上表中元素②与元素⑤的氢氧化物有相似的性质。请写出元素②的氢氧化物与NaOH溶液反应的化学方程式:________________。

请回答下列问题:
(1)表中元素①的6个原子与元素③的6个原子形成的某种环状分子名称为 ;③和⑦形成的一种常见溶剂的化学式为 ,其立体构型为________________。
(2)某元素原子的外围电子排布式为nsnnpn+1,该元素原子的最外电子层上孤电子对数为 ;该元素与元素①形成的最简单分子X属于 分子(填“极性”或“非极性”)。
(3)元素④的第一电离能 元素⑤(选填“>”、“=”、“<”)的第一电离能;元素⑥的电负性 元素⑦(选填“>”、“=”、“<”)的电负性。
(4)元素⑦和⑧形成的化合物的电子式为 。
(5)元素⑨的基态原子核外电子排布式是 。
(6)某些不同族元素的性质也有一定的相似性,如上表中元素②与元素⑤的氢氧化物有相似的性质。请写出元素②的氢氧化物与NaOH溶液反应的化学方程式:________________。
您最近一年使用:0次
2011高二·福建龙岩·学业考试
6 . W、X、Y、Z是周期表前36号元素中的四种常见元素,其原子序数依次增大。W、Y的氧化物是导致酸雨的主要物质,X的基态原子核外有7个原子轨道填充了电子,Z能形成红色(或砖红色)的Z2O和黑色的ZO两种氧化物。
(1)W的第一电离能比氧原子的________ (填“大”或“小”),W的气态氢化物稳定性比H2O(g)_______ (填“强”或“弱”),W的单质分子中含_________ 个∏键;
(2)Z位于元素周期表第__ 周期第___ 族,Z的基态原子核外电子排布式是________ ;
(3)X、Y的最高价氧化物对应水化物相互反应的离子方程式是
_______________________________________________________________ 。
(1)W的第一电离能比氧原子的
(2)Z位于元素周期表第
(3)X、Y的最高价氧化物对应水化物相互反应的离子方程式是
您最近一年使用:0次
7 . 第4周期的A、B、C、D四种元素,其价电子数依次为1、2、2、7。其原子序数按A、B、C、D顺序增大,已知A与B的次外层电子数为8,而C与D次外层电子数为18,根据结构填空:
(1)写出元素名称:A_______ ,B_________ ,C_______ ,D_______ 。
(2)D的简单离子是______________ 。
(3)元素的氢氧化物碱性最强的是_____________ 。
(4)B与D二原子间能形成化合物的化学式是______________ 。
(5)写出A、B的第一电离能顺序___________ 。
(6)写出C基态原子的电子排布式_________ 。
(1)写出元素名称:A
(2)D的简单离子是
(3)元素的氢氧化物碱性最强的是
(4)B与D二原子间能形成化合物的化学式是
(5)写出A、B的第一电离能顺序
(6)写出C基态原子的电子排布式
您最近一年使用:0次
9-10高二下·吉林延边·期末
8 . 用“>”或“<”填空:
(1)第一电离能C_____ N
(2)电负性Cl________ Br
(3)晶格能 KCl____ CsCl
(4)硬度 MgO_______ CaO
(5)酸性 HClO3____ HClO
(1)第一电离能C
(2)电负性Cl
(3)晶格能 KCl
(4)硬度 MgO
(5)酸性 HClO3
您最近一年使用:0次
9-10高二下·辽宁锦州·期末
9 . 根据下列五种元素的第一至第四电离能数据(单位:kJ·mol-1)
请回答下列问题:
(1)在周期表中,最可能处于同一族的是____
A.Q和R B.S和T
C.T和U D.R和U
(2)电解它们的熔融氯化物,阴极电极反应式最可能正确的是____
A.U2++2e-→U B.R2++2e-→R
C.S3++3e-→S D.T3++3e-→T
(3)它们的氯化物的化学式,最可能正确的是____
A.UCl4 B. RCl C.SCl3D.TCl
(4)S元素最可能是_____
A.s区元素 B.p区元素
C.过渡金属 D.d区元素
(5)下列元素中,化学性质和物理性质最像Q元素的是____
A.硼(1s22s22p1) B.铍(1s22s2) C.锂(1s22s1) D.氦(1s2)
| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 2080 | 4000 | 6100 | 9400 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| U | 420 | 3100 | 4400 | 5900 |
请回答下列问题:
(1)在周期表中,最可能处于同一族的是
A.Q和R B.S和T
C.T和U D.R和U
(2)电解它们的熔融氯化物,阴极电极反应式最可能正确的是
A.U2++2e-→U B.R2++2e-→R
C.S3++3e-→S D.T3++3e-→T
(3)它们的氯化物的化学式,最可能正确的是
A.UCl4 B. RCl C.SCl3D.TCl
(4)S元素最可能是
A.s区元素 B.p区元素
C.过渡金属 D.d区元素
(5)下列元素中,化学性质和物理性质最像Q元素的是
A.硼(1s22s22p1) B.铍(1s22s2) C.锂(1s22s1) D.氦(1s2)
您最近一年使用:0次
真题
10 . W、X、Y、Z是周期表前36号元素中的四种常见元素,其原子序数一次增大。W、Y的氧化物是导致酸雨的主要物质,X的基态原子核外有7个原子轨道填充了电子,Z能形成红色(或砖红色)的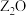 和黑色的ZO两种氧化物。
和黑色的ZO两种氧化物。
(1)W位于元素周期表第_________ 周期第_________ 族。W的气态氢化物稳定性比

__________ (填“强”或“弱”)。
(2)Y的基态原子核外电子排布式是________ ,Y的第一电离能比X的__________ (填“大”或“小”)。
(3)Y的最高价氧化物对应水化物的浓溶液与Z的单质反应的化学方程式是
_________________________________________________________________________ 。
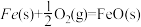
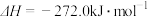
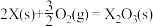
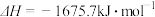
X的单质和FeO反应的热化学方程式是_________________________________________ 。
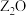 和黑色的ZO两种氧化物。
和黑色的ZO两种氧化物。(1)W位于元素周期表第

(2)Y的基态原子核外电子排布式是
(3)Y的最高价氧化物对应水化物的浓溶液与Z的单质反应的化学方程式是
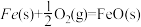
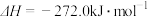
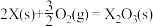
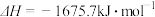
X的单质和FeO反应的热化学方程式是
您最近一年使用:0次



