1 . 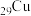 在元素周期表中的位置是第
在元素周期表中的位置是第___________ 周期___________ 族,除去稀有气体,Cu元素所在周期原子半径最小的元素是___________ (填写元素符号);元素周期表中电负性大于氧元素的是___________ (填写元素符号)。
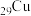 在元素周期表中的位置是第
在元素周期表中的位置是第
您最近半年使用:0次
解题方法
2 . 电负性是由美国化学家鲍林提出的。下列不能根据元素电负性判断的是
| A.元素原子的得电子能力 |
| B.元素形成化合物中的化合价正、负 |
| C.不同元素之间形成的化学键类型 |
| D.氢化物水溶液的酸性 |
您最近半年使用:0次
2024-02-22更新
|
93次组卷
|
2卷引用:河南省濮阳市2023-2024学年高二上学期1月期末化学试题
23-24高二·全国·假期作业
解题方法
3 . 同一周期电负性最大的元素为稀有气体元素。(_____)
您最近半年使用:0次
解题方法
4 . 食用碱是人们生活中常用的食品疏松剂和肉类嫩化剂,其成分为纯碱 和小苏打
和小苏打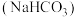 。下列说法正确的是
。下列说法正确的是
 和小苏打
和小苏打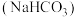 。下列说法正确的是
。下列说法正确的是A.离子半径: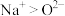 | B.电负性: |
C.非金属性: | D.第一电离能: |
您最近半年使用:0次
2023-12-01更新
|
539次组卷
|
5卷引用:河北省邯郸市六校联考2023-2024学年高二上学期11月月考化学试题
5 . 离子键的形成
形成过程:电负性较大的非金属元素的原子容易___________ 形成阴离子,电负性较小的金属元素的原子容易___________ 形成阳离子。当这两种原子相互接近到一定程度时,容易发生电子得、失而形成阴、阳离子,阴、阳离子通过___________ 可形成稳定的化合物。
实质:离子键的实质是___________ 之间的___________ 作用。包括___________ 和 ___________ 。
形成条件:成键原子所属元素的___________ 差值越大,原子之间越容易发生___________ ,形成离子键。
形成过程:电负性较大的非金属元素的原子容易
实质:离子键的实质是
形成条件:成键原子所属元素的
您最近半年使用:0次
解题方法
6 . 离子键的百分数是依据电负性的差值计算出来的,差值越大,离子键的百分数越大,下列几种化合物的化学键中离子键的百分数最大的是
| A.LiF | B.AlCl3 | C.MgO | D.SO3 |
您最近半年使用:0次
2023-09-09更新
|
110次组卷
|
3卷引用:重庆市2023-2024学年高三上学期9月联考化学试题
7 . 电负性的变化规律:
(1)主族元素,同一周期从左到右,元素的电负性_____ ;
(2)同一主族自上而下,元素的电负性_____ 。
(3)电负性大的元素集中在元素周期表的_____ ,电负性小的元素集中在元素周期表的_____ 。
(1)主族元素,同一周期从左到右,元素的电负性
(2)同一主族自上而下,元素的电负性
(3)电负性大的元素集中在元素周期表的
您最近半年使用:0次
8 . 柠檺酸铁铵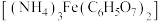 可用作铁质强化剂,以铁、硫酸、柠檬酸、过氧化氢、氨水等为原料可制备柠檬酸铁铵。下列说法中错误的是
可用作铁质强化剂,以铁、硫酸、柠檬酸、过氧化氢、氨水等为原料可制备柠檬酸铁铵。下列说法中错误的是
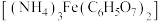 可用作铁质强化剂,以铁、硫酸、柠檬酸、过氧化氢、氨水等为原料可制备柠檬酸铁铵。下列说法中错误的是
可用作铁质强化剂,以铁、硫酸、柠檬酸、过氧化氢、氨水等为原料可制备柠檬酸铁铵。下列说法中错误的是A.基态 的价层电子轨道表示式为 的价层电子轨道表示式为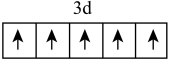 |
| B.铁是金属晶体,硫酸是离子晶体 |
C.电负性: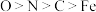 |
D.过氧化氢分子中只存在 键 键 |
您最近半年使用:0次
2023-07-18更新
|
206次组卷
|
3卷引用:海南省省直辖县级行政单位2022-2023学年高二下学期期末考试化学试题
解题方法
9 . 判断化学键的类型。
(1)一般来说,如果两种成键元素的电负性差值大于1.7,它们之间通常形成__________ 。
(2)一般来说,如果两种成键元素的电负性差值小于1.7,它们之间通常形成__________ 。
(1)一般来说,如果两种成键元素的电负性差值大于1.7,它们之间通常形成
(2)一般来说,如果两种成键元素的电负性差值小于1.7,它们之间通常形成
您最近半年使用:0次
解题方法
10 . 主族元素电负性的变化规律
同一周期,主族元素的电负性从左到右依次_______ ,表明其吸引电子的能力逐渐_______ ,_______ 逐渐减弱,_________ 逐渐增强。
同一主族,元素的电负性从上到下呈现_______ 的趋势,表明其吸引电子的能力逐渐_______ ,_______ 逐渐增强,__________ 逐渐减弱。
同一周期,主族元素的电负性从左到右依次
同一主族,元素的电负性从上到下呈现
您最近半年使用:0次



