1 . “证据推理与模型认知”是化学学科培养的核心素养之一、下列推论合理的是
| 选项 | 已知信息 | 推论 |
| A |  分子空间结构为V形 分子空间结构为V形 |  分子中两碳原子和氧原子不在同一直线上 分子中两碳原子和氧原子不在同一直线上 |
| B | 电负性: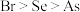 | 第一电离能: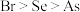 |
| C | 沸点: | 非金属性: |
| D | 原子半径: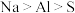 | 离子半径: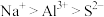 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
名校
2 . 2023年诺贝尔化学奖授予蒙吉·G·巴文迪等三位科学家,以表彰他们在发现和合成量子点方面所作出的贡献,碳量子点是一类具有显著荧光性能的零维碳纳米材料,其结构如图所示。回答下列问题:_______ 区,图中C的杂化方式为_______ 。
(2)碳量子点结构包含的元素中电负性由大到小排列为:_______ 。
(3)碳量子点水溶性_______ (选填“>”“<”“=”)石墨水溶性,理由是:_______ 。
(4)高压合成金刚石的原料是廉价的石墨,用高压釜持续施加高温高压并加入金属镍等金属催化剂,石墨可转化为金刚石。基态镍原子核外电子的空间运动状态有_______ 种,比较二者C-C共价键的键长:石墨_______ 金刚石(选填“>”“<”“=”)。
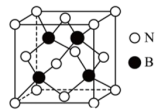
(5)氮化硼(BN)是一种性能优异、潜力巨大的新型材料,其中一种结构为立方氮化硼(如图),类似于金刚石。_______ ,则立方氮化硼晶体密度为_______ g·cm-3(列出计算式,阿伏加德罗常数的值为NA)。

(2)碳量子点结构包含的元素中电负性由大到小排列为:
(3)碳量子点水溶性
(4)高压合成金刚石的原料是廉价的石墨,用高压釜持续施加高温高压并加入金属镍等金属催化剂,石墨可转化为金刚石。基态镍原子核外电子的空间运动状态有
(5)氮化硼(BN)是一种性能优异、潜力巨大的新型材料,其中一种结构为立方氮化硼(如图),类似于金刚石。
您最近半年使用:0次
解题方法
3 . 现有10种元素,其中X、Y、Z、A、E为短周期主族元素,原子序数依次增大;M、R、Q为第4周期元素。X元素原子的核外电子只有一种自旋取向;Y的基态原子核外2个能级上有电子,且每个能级上的电子数相等;Z原子核外有6种运动状态不同的电子。A元素原子核外s能级上的电子总数与p能级上的电子总数相等,但第一电离能都低于同周期相邻元素;E元素原子半径在同周期元素中最大;M是第四周期最外层只有一个电子的元素中原子序数最大的。R的3价阳离子遇KSCN溶液显红色。Q是ds区元素,基态原子核外7个能级上的电子均充满。请根据相关信息回答问题。
(1)Y、Z、A、E四种元素电负性由大到小的顺序:___________ (填元素符号)。Y、Z、A、E四种元素原子半径由大到小的顺序:___________ (填元素符号)。
(2)R元素的基态原子的电子排布式___________ ,占据最高能级电子的电子云轮廓图为___________ 形。Q在周期表中位于第四周期第___________ 族。
(3)X与Z形成的化合物的相对分子质量是26,其分子中σ键与π键的数目之比为___________ 。
(4)Y的氧化物与E的氢氧化物发生化学反应的离子方程式:___________ 。
(5)E在火焰上灼烧产生的黄光是一种___________ 光谱(填“发射”“吸收”)。
(6)从结构角度看,R2+易被氧化成R3+的原因是___________ 。
(7)过渡元素的金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般而言,为d0或d10排布时,无颜色,为d1~d9排布时,有颜色,如[R(H2O)6]3+显棕黄色。据此判断,[Q(H2O)4]2+___________ (填“无”或“有”)颜色。
(1)Y、Z、A、E四种元素电负性由大到小的顺序:
(2)R元素的基态原子的电子排布式
(3)X与Z形成的化合物的相对分子质量是26,其分子中σ键与π键的数目之比为
(4)Y的氧化物与E的氢氧化物发生化学反应的离子方程式:
(5)E在火焰上灼烧产生的黄光是一种
(6)从结构角度看,R2+易被氧化成R3+的原因是
(7)过渡元素的金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般而言,为d0或d10排布时,无颜色,为d1~d9排布时,有颜色,如[R(H2O)6]3+显棕黄色。据此判断,[Q(H2O)4]2+
您最近半年使用:0次
名校
4 . 科学家合成了一种含硼阴离子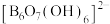 ,其结构如图所示下列叙述错误的是
,其结构如图所示下列叙述错误的是
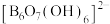 ,其结构如图所示下列叙述错误的是
,其结构如图所示下列叙述错误的是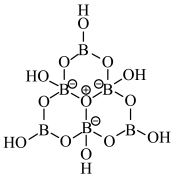
| A.基态硼原子的核外电子的空间运动状态有3种 |
| B.电负性大小为:O>B>H |
| C.该结构中硼原子的杂化方式为sp2、sp3 |
| D.该结构中共有4种不同化学环境的氧原子 |
您最近半年使用:0次
昨日更新
|
166次组卷
|
2卷引用:2024年辽宁省抚顺市普通高中高三下学期模拟考试化学试卷
名校
5 . 下列对事实的分析正确的是
| 选项 | 事实 | 分析 |
| A | 键角: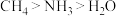 | 电负性:C<N<O |
| B | 第一电离能:P>S | 原子半径:P>S |
| C | 沸点:CO> | CO为极性分子, 为非极性分子 为非极性分子 |
| D | 热稳定性:HF>HCl | HF中存在氢键,HCl中不存在氢键 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
名校
解题方法
6 . 硼、碳、氮元素形成的化合物极为丰富。
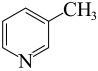
(1)吡啶( )是一种常见的配体,其中含有与苯类似的大
)是一种常见的配体,其中含有与苯类似的大 键,则吡啶中N原子的价层孤电子对占据的轨道为__________(填标号)。
键,则吡啶中N原子的价层孤电子对占据的轨道为__________(填标号)。
(2) 、
、 、
、 均可作为配体,则三者中配位能力最弱的是
均可作为配体,则三者中配位能力最弱的是__________ ,其原因为__________ 。
(3)某种新型储氢材料的晶胞如图所示,其中八面体中心为 ,顶点均为配体
,顶点均为配体 ;四面体中心为硼原子,顶点均为氢原子。该晶胞为立方体形,边长为a pm,则
;四面体中心为硼原子,顶点均为氢原子。该晶胞为立方体形,边长为a pm,则__________ ,晶体类型是__________ , 与硼原子间的最短距离为
与硼原子间的最短距离为__________ cm(用含a代数式表示)。
(4)下列有关说法正确的是__________。
(1)吡啶(
 )是一种常见的配体,其中含有与苯类似的大
)是一种常见的配体,其中含有与苯类似的大 键,则吡啶中N原子的价层孤电子对占据的轨道为__________(填标号)。
键,则吡啶中N原子的价层孤电子对占据的轨道为__________(填标号)。A. 轨道 轨道 | B. 轨道 轨道 | C. 杂化轨道 杂化轨道 | D. 杂化轨道 杂化轨道 |
(2)
 、
、 、
、 均可作为配体,则三者中配位能力最弱的是
均可作为配体,则三者中配位能力最弱的是(3)某种新型储氢材料的晶胞如图所示,其中八面体中心为
 ,顶点均为配体
,顶点均为配体 ;四面体中心为硼原子,顶点均为氢原子。该晶胞为立方体形,边长为a pm,则
;四面体中心为硼原子,顶点均为氢原子。该晶胞为立方体形,边长为a pm,则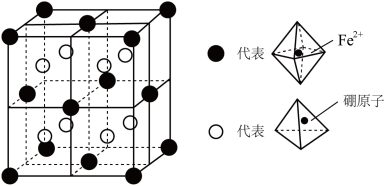
 与硼原子间的最短距离为
与硼原子间的最短距离为(4)下列有关说法正确的是__________。
| A.电负性:N>H>B | B.沸点:吡啶>苯 |
| C.第一电离能:N>C>O | D.基态 的简化电子排布式: 的简化电子排布式: |
您最近半年使用:0次
名校
7 . 一种以 (晶胞如下图所示)为原料制备
(晶胞如下图所示)为原料制备 的工艺流程如下:
的工艺流程如下:
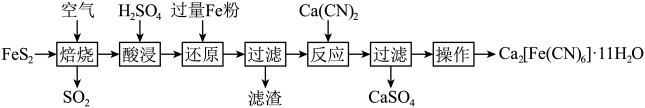
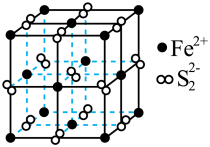
下列说法正确的是
 (晶胞如下图所示)为原料制备
(晶胞如下图所示)为原料制备 的工艺流程如下:
的工艺流程如下:

下列说法正确的是
A.焙烧每生成1mol 转移4mol电子 转移4mol电子 |
B. 晶胞中距离每个 晶胞中距离每个 最近的 最近的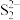 有6个 有6个 |
C.“还原”得到的滤液中大量存在 、 、 、 、 |
D. 各元素电负性的大小顺序: 各元素电负性的大小顺序: |
您最近半年使用:0次
名校
8 . 我国科学家在实验室中成功地实现了“空气变馒头”的壮举:化学总反应可表示为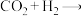

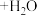 (未配平),下列说法错误的是
(未配平),下列说法错误的是
A.从电子云重叠方式角度看, 中存在两类共价键 中存在两类共价键 |
| B.从共用电子对是否发生偏移角度看,Starch中存在两类共价键 |
| C.键的极性:H—O>C—O |
| D.键长:C=C>C—C |
您最近半年使用:0次
解题方法
9 . 近年来,我国半导体材料市场发展迅速,其中以氮化嫁、碳化硅、氧化锌、金刚石等为主的材料备受关注。回答下列问题:
(1)基态Ga原子的价电子轨道表示式为___________ ,基态N原子核外电子有___________ 种空间运动状态。Zn在元素周期表中位于___________ 区。
(2)C,N、O的第一电离能由大到小的顺序为___________ 。 的空间结构为
的空间结构为___________ 。
(3)SiC的立方晶胞结构如图1所示,已知;1号C原子的坐标参数为( ,
, ,
, ),晶胞参数为apm。则晶胞中2号C原子的坐标参数为
),晶胞参数为apm。则晶胞中2号C原子的坐标参数为___________ ,C和Si原子的最短距离为___________ pm。
①GaN晶体中N原子的杂化轨道类型为___________ 。
②GaN晶体的密度为___________ g/cm3(列出计算式,用含b、c、NA的代数式表示)。
(1)基态Ga原子的价电子轨道表示式为
(2)C,N、O的第一电离能由大到小的顺序为
 的空间结构为
的空间结构为(3)SiC的立方晶胞结构如图1所示,已知;1号C原子的坐标参数为(
 ,
, ,
, ),晶胞参数为apm。则晶胞中2号C原子的坐标参数为
),晶胞参数为apm。则晶胞中2号C原子的坐标参数为
①GaN晶体中N原子的杂化轨道类型为
②GaN晶体的密度为
您最近半年使用:0次
名校
解题方法
10 . 双氰胺( )为白色晶体,在冷水中溶解度较小,溶于热水、乙醇,其水溶液在80℃以上会发生分解等副反应,主要用于生产树脂、涂料、含氮复合肥等。实验室以石灰氮
)为白色晶体,在冷水中溶解度较小,溶于热水、乙醇,其水溶液在80℃以上会发生分解等副反应,主要用于生产树脂、涂料、含氮复合肥等。实验室以石灰氮 为原料制备双氰胺的流程如下:
为原料制备双氰胺的流程如下:
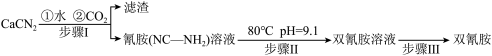
已知氰胺二聚反应机理为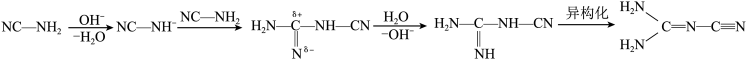
(1)已知:氰基是吸电子基团。氰氨
 的碱性
的碱性(2)写出步骤Ⅰ的化学反应方程式:
(3)步骤Ⅱ中调节溶液pH为9.1,pH不能过低的原因:
(4)步骤Ⅲ中蒸发浓缩时,常采用真空蒸发浓缩,目的是
(5)凯氏定氮法是测定有机物中氮含量的经典方法,其原理是用浓硫酸在催化剂存在下将样品中有机氮转化成铵盐,利用如图所示装置处理铵盐。
已知:
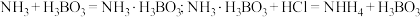

②仪器清洗后,g中加入硼酸
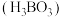 和指示剂。铵盐试样由d注入e,随后注入氢氧化钠溶液,用蒸馏水冲洗d,关闭
和指示剂。铵盐试样由d注入e,随后注入氢氧化钠溶液,用蒸馏水冲洗d,关闭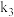 ,d中保留少量水。打开
,d中保留少量水。打开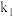 ,加热b,使水蒸气进入e。
,加热b,使水蒸气进入e。d中保留少量水的目的是
③取双氰胺样品m克进行测定,滴定g中吸收液时消耗浓度为
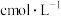 的盐酸VmL,则样品中氮的质量分数为
的盐酸VmL,则样品中氮的质量分数为
您最近半年使用:0次



