名校
1 . 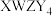 是构成电池的一种重要化合物,其阴离子结构如图所示,X、Y、Z、W为原子序数依次增大的前四周期元素,其中Y、Z为非金属元素且位于相邻主族,四种基态原子未成对电子数均不相等且不为0,未成对电子数存在关系:
是构成电池的一种重要化合物,其阴离子结构如图所示,X、Y、Z、W为原子序数依次增大的前四周期元素,其中Y、Z为非金属元素且位于相邻主族,四种基态原子未成对电子数均不相等且不为0,未成对电子数存在关系: 。下列说法错误的是
。下列说法错误的是
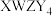 是构成电池的一种重要化合物,其阴离子结构如图所示,X、Y、Z、W为原子序数依次增大的前四周期元素,其中Y、Z为非金属元素且位于相邻主族,四种基态原子未成对电子数均不相等且不为0,未成对电子数存在关系:
是构成电池的一种重要化合物,其阴离子结构如图所示,X、Y、Z、W为原子序数依次增大的前四周期元素,其中Y、Z为非金属元素且位于相邻主族,四种基态原子未成对电子数均不相等且不为0,未成对电子数存在关系: 。下列说法错误的是
。下列说法错误的是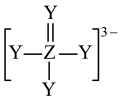
| A.电负性:Y>Z>X | B.W能与Y的简单氢化物反应生成 |
C.该化合物中Z采用 杂化 杂化 | D.Y元素形成的单质一定为非极性分子 |
您最近半年使用:0次
名校
2 . 下列关于物质的结构或性质以及解释均正确的是
| 选项 | 物质的结构与性质 | 解释 |
| A | 键角: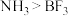 |  中 中 的孤电子对数比 的孤电子对数比 中 中 的孤电子对数多 的孤电子对数多 |
| B | 酸性: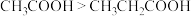 | 烃基(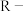 )越长推电子效应越大,使羧基中羟基的极性越小,羧酸的酸性越弱 )越长推电子效应越大,使羧基中羟基的极性越小,羧酸的酸性越弱 |
 |  的熔点比干冰高 的熔点比干冰高 |  比 比 相对分子量大,分子间作用力大 相对分子量大,分子间作用力大 |
 | 稳定性: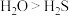 |  分子间存在氢键 分子间存在氢键 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
解题方法
3 . 合成氨N2+3H2 2NH3是人类科学技术发展史上的一项重大成就。目前合成氨工业中使用的催化剂铁触媒中主要成分为Fe3O4(Fe2O3•FeO),还含有少量的K2O、Al2O3、MgO、CaO、Cr2O3等。回答问题:
2NH3是人类科学技术发展史上的一项重大成就。目前合成氨工业中使用的催化剂铁触媒中主要成分为Fe3O4(Fe2O3•FeO),还含有少量的K2O、Al2O3、MgO、CaO、Cr2O3等。回答问题:
(1)基态N原子中,电子占据最高能级的符号是___________ ,占据该能级电子的电子云轮廓图为___________ 形。
(2)26号元素Fe基态原子的价层电子轨道表示式是___________ 。
(3)24Cr的价层电子排布式为___________ ,在元素周期表中位于___________ 区(填“s”“p”“d”或“ds”)。
(4)NH3分子中,与N原子相连的H显正电性。分析电负性大小关系为N___________ H(填“>”“<”或“=”)。
(5)工业上电解Al2O3制备铝,常用冰晶石Na3[AlF6]来降低Al2O3的熔点,请写出Na3[AlF6]电离方程式___________ 。
 2NH3是人类科学技术发展史上的一项重大成就。目前合成氨工业中使用的催化剂铁触媒中主要成分为Fe3O4(Fe2O3•FeO),还含有少量的K2O、Al2O3、MgO、CaO、Cr2O3等。回答问题:
2NH3是人类科学技术发展史上的一项重大成就。目前合成氨工业中使用的催化剂铁触媒中主要成分为Fe3O4(Fe2O3•FeO),还含有少量的K2O、Al2O3、MgO、CaO、Cr2O3等。回答问题:(1)基态N原子中,电子占据最高能级的符号是
(2)26号元素Fe基态原子的价层电子轨道表示式是
(3)24Cr的价层电子排布式为
(4)NH3分子中,与N原子相连的H显正电性。分析电负性大小关系为N
(5)工业上电解Al2O3制备铝,常用冰晶石Na3[AlF6]来降低Al2O3的熔点,请写出Na3[AlF6]电离方程式
您最近半年使用:0次
名校
4 . X、Y、Z、W为原子序数依次增大的短周期元素,基态X原子p能级上有一对成对电子,基态X、Z、W原子的未成对电子数之比为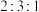 ,其中X、Y、Z可形成离子化合物
,其中X、Y、Z可形成离子化合物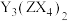 。下列说法正确的是
。下列说法正确的是
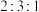 ,其中X、Y、Z可形成离子化合物
,其中X、Y、Z可形成离子化合物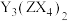 。下列说法正确的是
。下列说法正确的是A.电负性: |
B.简单离子半径: |
| C.由X元素形成的单质均为非极性分子 |
| D.在空气中点燃Y单质,只能生成一种产物 |
您最近半年使用:0次
5 . 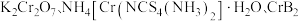 均是铬的重要化合物,回答下列问题:
均是铬的重要化合物,回答下列问题: 原子有
原子有___________ 种能量不同的电子,价电子排布式为___________ 。
(2)已知电子亲和能(E)是基态的气态原子得到电子变为气态阴离子所放出的能量, 。氧的第一电子亲和能
。氧的第一电子亲和能 为
为___________  ;
; ,其原因是
,其原因是___________ 。
(3)雷氏盐的化学式为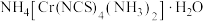 。
。
①H、C、N、O四种元素的电负性由大到小的顺序为___________ 。
②雷氏盐中所含化学键类型___________ 。
A.离子键 B.共价键 C.配位键 D.金属键 E.氢键
③配体之一 分子的
分子的 模型名称为
模型名称为___________ ,与配体 互为等电子体的分子和离子有
互为等电子体的分子和离子有___________ 、___________ (各写1种)。
(4)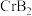 的晶体密度为
的晶体密度为 ,晶体结构(如图)为六棱柱,底边边长为
,晶体结构(如图)为六棱柱,底边边长为 ,高为
,高为 ,设阿伏加德罗常数的值为
,设阿伏加德罗常数的值为 ,则
,则
___________ (列出计算式)。
 均是铬的重要化合物,回答下列问题:
均是铬的重要化合物,回答下列问题: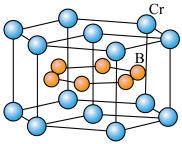
 原子有
原子有(2)已知电子亲和能(E)是基态的气态原子得到电子变为气态阴离子所放出的能量,
 。氧的第一电子亲和能
。氧的第一电子亲和能 为
为 ;
; ,其原因是
,其原因是(3)雷氏盐的化学式为
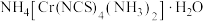 。
。①H、C、N、O四种元素的电负性由大到小的顺序为
②雷氏盐中所含化学键类型
A.离子键 B.共价键 C.配位键 D.金属键 E.氢键
③配体之一
 分子的
分子的 模型名称为
模型名称为 互为等电子体的分子和离子有
互为等电子体的分子和离子有(4)
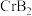 的晶体密度为
的晶体密度为 ,晶体结构(如图)为六棱柱,底边边长为
,晶体结构(如图)为六棱柱,底边边长为 ,高为
,高为 ,设阿伏加德罗常数的值为
,设阿伏加德罗常数的值为 ,则
,则
您最近半年使用:0次
名校
解题方法
6 . 十九世纪初,科学家用氰酸银(AgOCN)与NH4Cl在一定条件下反应制得尿素[CO(NH2)2]实现了由无机物到有机物的合成。下列有关说法正确的是
A.NH4Cl电子式为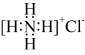 | B.电负性:C<O<N |
| C.氰酸铵与尿素互为同分异构体 | D.尿素中所有原子可能处于同一平面 |
您最近半年使用:0次
7 . 铬元素是哺乳类代谢过程中必须的微量元素,目前六氟代乙酰丙酮铬(Ⅲ)螯合物(其结构如图)的检出极限已达到3×10-12 g。回答下列问题:___________ ,H、C、O、F的电负性由大到小的顺序为___________ 。
(2)Cr3+的未成对电子数有______ 个,与Cr3+的未成对电子数相同且处于同周期的主族元素在周期表中的位置是____________ 。
(3)六氟代乙酰丙酮铬(Ⅲ)螯合物中含有的化学键有___________ 。
a.极性共价键 b.非极性共价键 c.离子键
(4)六氟代乙酰丙酮(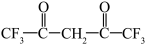 )中
)中 键有
键有______ 个。
(5)分子H2O、NH3、CH4中键角由大到小的顺序是_____________ 。
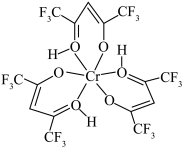
(2)Cr3+的未成对电子数有
(3)六氟代乙酰丙酮铬(Ⅲ)螯合物中含有的化学键有
a.极性共价键 b.非极性共价键 c.离子键
(4)六氟代乙酰丙酮(
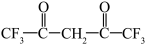 )中
)中 键有
键有(5)分子H2O、NH3、CH4中键角由大到小的顺序是
您最近半年使用:0次
名校
8 . 铜是人类最早使用的金属之一,用黄铜矿(主要成分为 )生产粗铜的反应原理如下:
)生产粗铜的反应原理如下:
(1)第三周期主族元素中电负性比 小的元素有
小的元素有___________ 种, 的沸点比
的沸点比 的
的___________ (填“高”或“低”),原因是___________ 。
(2) 和
和 均为
均为___________ 晶体, 的熔点为
的熔点为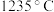 ,
, 的熔点为
的熔点为 ,
, 熔点较高的原因是
熔点较高的原因是___________ 。
(3)铜的两种氧化物的晶胞如图1、图2所示,图1表示___________ 填化学式),图2中,A原子坐标参数为(0,0,0),B原子为 ,则C原子的坐标参数为
,则C原子的坐标参数为___________ 。
 )生产粗铜的反应原理如下:
)生产粗铜的反应原理如下:
(1)第三周期主族元素中电负性比
 小的元素有
小的元素有 的沸点比
的沸点比 的
的(2)
 和
和 均为
均为 的熔点为
的熔点为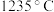 ,
, 的熔点为
的熔点为 ,
, 熔点较高的原因是
熔点较高的原因是(3)铜的两种氧化物的晶胞如图1、图2所示,图1表示
 ,则C原子的坐标参数为
,则C原子的坐标参数为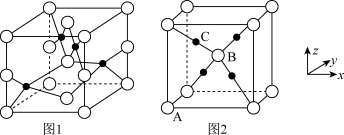
您最近半年使用:0次
9 . “证据推理与模型认知”是化学学科培养的核心素养之一、下列推论合理的是
| 选项 | 已知信息 | 推论 |
| A |  分子空间结构为V形 分子空间结构为V形 |  分子中两碳原子和氧原子不在同一直线上 分子中两碳原子和氧原子不在同一直线上 |
| B | 电负性: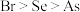 | 第一电离能: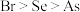 |
| C | 沸点: | 非金属性: |
| D | 原子半径: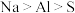 | 离子半径: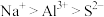 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
名校
解题方法
10 . 由金属钛、铝形成的Tebbe试剂(一种烃基钛茂)常用作有机反应的烯化试剂,其结构如图所示。下列说法错误的是
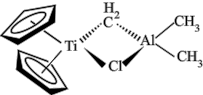
| A.Tebbe试剂为极性分子 | B.该结构中电负性最大的元素是Cl |
C.Tebbe试剂中的Al采取 杂化 杂化 | D.该结构中Al与Cl之间形成配位键 |
您最近半年使用:0次



