1 . 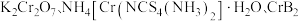 均是铬的重要化合物,回答下列问题:
均是铬的重要化合物,回答下列问题: 原子有
原子有___________ 种能量不同的电子,价电子排布式为___________ 。
(2)已知电子亲和能(E)是基态的气态原子得到电子变为气态阴离子所放出的能量, 。氧的第一电子亲和能
。氧的第一电子亲和能 为
为___________  ;
; ,其原因是
,其原因是___________ 。
(3)雷氏盐的化学式为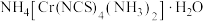 。
。
①H、C、N、O四种元素的电负性由大到小的顺序为___________ 。
②雷氏盐中所含化学键类型___________ 。
A.离子键 B.共价键 C.配位键 D.金属键 E.氢键
③配体之一 分子的
分子的 模型名称为
模型名称为___________ ,与配体 互为等电子体的分子和离子有
互为等电子体的分子和离子有___________ 、___________ (各写1种)。
(4)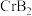 的晶体密度为
的晶体密度为 ,晶体结构(如图)为六棱柱,底边边长为
,晶体结构(如图)为六棱柱,底边边长为 ,高为
,高为 ,设阿伏加德罗常数的值为
,设阿伏加德罗常数的值为 ,则
,则
___________ (列出计算式)。
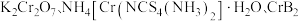 均是铬的重要化合物,回答下列问题:
均是铬的重要化合物,回答下列问题: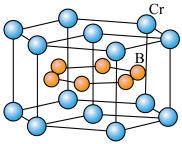
 原子有
原子有(2)已知电子亲和能(E)是基态的气态原子得到电子变为气态阴离子所放出的能量,
 。氧的第一电子亲和能
。氧的第一电子亲和能 为
为 ;
; ,其原因是
,其原因是(3)雷氏盐的化学式为
 。
。①H、C、N、O四种元素的电负性由大到小的顺序为
②雷氏盐中所含化学键类型
A.离子键 B.共价键 C.配位键 D.金属键 E.氢键
③配体之一
 分子的
分子的 模型名称为
模型名称为 互为等电子体的分子和离子有
互为等电子体的分子和离子有(4)
 的晶体密度为
的晶体密度为 ,晶体结构(如图)为六棱柱,底边边长为
,晶体结构(如图)为六棱柱,底边边长为 ,高为
,高为 ,设阿伏加德罗常数的值为
,设阿伏加德罗常数的值为 ,则
,则
您最近半年使用:0次
名校
解题方法
2 . 十九世纪初,科学家用氰酸银(AgOCN)与NH4Cl在一定条件下反应制得尿素[CO(NH2)2]实现了由无机物到有机物的合成。下列有关说法正确的是
A.NH4Cl电子式为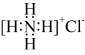 | B.电负性:C<O<N |
| C.氰酸铵与尿素互为同分异构体 | D.尿素中所有原子可能处于同一平面 |
您最近半年使用:0次
名校
3 . 铜是人类最早使用的金属之一,用黄铜矿(主要成分为 )生产粗铜的反应原理如下:
)生产粗铜的反应原理如下:
(1)第三周期主族元素中电负性比 小的元素有
小的元素有___________ 种, 的沸点比
的沸点比 的
的___________ (填“高”或“低”),原因是___________ 。
(2) 和
和 均为
均为___________ 晶体, 的熔点为
的熔点为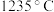 ,
, 的熔点为
的熔点为 ,
, 熔点较高的原因是
熔点较高的原因是___________ 。
(3)铜的两种氧化物的晶胞如图1、图2所示,图1表示___________ 填化学式),图2中,A原子坐标参数为(0,0,0),B原子为 ,则C原子的坐标参数为
,则C原子的坐标参数为___________ 。
 )生产粗铜的反应原理如下:
)生产粗铜的反应原理如下: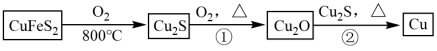
(1)第三周期主族元素中电负性比
 小的元素有
小的元素有 的沸点比
的沸点比 的
的(2)
 和
和 均为
均为 的熔点为
的熔点为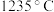 ,
, 的熔点为
的熔点为 ,
, 熔点较高的原因是
熔点较高的原因是(3)铜的两种氧化物的晶胞如图1、图2所示,图1表示
 ,则C原子的坐标参数为
,则C原子的坐标参数为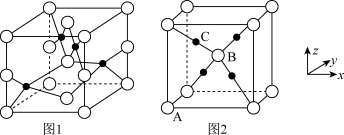
您最近半年使用:0次
4 . “证据推理与模型认知”是化学学科培养的核心素养之一、下列推论合理的是
| 选项 | 已知信息 | 推论 |
| A |  分子空间结构为V形 分子空间结构为V形 |  分子中两碳原子和氧原子不在同一直线上 分子中两碳原子和氧原子不在同一直线上 |
| B | 电负性: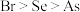 | 第一电离能: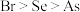 |
| C | 沸点: | 非金属性: |
| D | 原子半径: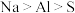 | 离子半径: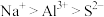 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
名校
解题方法
5 . 由金属钛、铝形成的Tebbe试剂(一种烃基钛茂)常用作有机反应的烯化试剂,其结构如图所示。下列说法错误的是
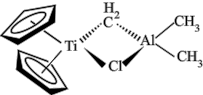
| A.Tebbe试剂为极性分子 | B.该结构中电负性最大的元素是Cl |
C.Tebbe试剂中的Al采取 杂化 杂化 | D.该结构中Al与Cl之间形成配位键 |
您最近半年使用:0次
名校
6 . 2023年诺贝尔化学奖授予蒙吉·G·巴文迪等三位科学家,以表彰他们在发现和合成量子点方面所作出的贡献,碳量子点是一类具有显著荧光性能的零维碳纳米材料,其结构如图所示。回答下列问题:_______ 区,图中C的杂化方式为_______ 。
(2)碳量子点结构包含的元素中电负性由大到小排列为:_______ 。
(3)碳量子点水溶性_______ (选填“>”“<”“=”)石墨水溶性,理由是:_______ 。
(4)高压合成金刚石的原料是廉价的石墨,用高压釜持续施加高温高压并加入金属镍等金属催化剂,石墨可转化为金刚石。基态镍原子核外电子的空间运动状态有_______ 种,比较二者C-C共价键的键长:石墨_______ 金刚石(选填“>”“<”“=”)。
(5)氮化硼(BN)是一种性能优异、潜力巨大的新型材料,其中一种结构为立方氮化硼(如图),类似于金刚石。_______ ,则立方氮化硼晶体密度为_______ g·cm-3(列出计算式,阿伏加德罗常数的值为NA)。

(2)碳量子点结构包含的元素中电负性由大到小排列为:
(3)碳量子点水溶性
(4)高压合成金刚石的原料是廉价的石墨,用高压釜持续施加高温高压并加入金属镍等金属催化剂,石墨可转化为金刚石。基态镍原子核外电子的空间运动状态有
(5)氮化硼(BN)是一种性能优异、潜力巨大的新型材料,其中一种结构为立方氮化硼(如图),类似于金刚石。
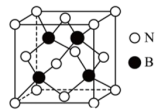
您最近半年使用:0次
名校
解题方法
7 . 下列说法错误的是
| A.碘易溶于四氯化碳、甲烷难溶于水,二者都可用相似相溶原理解释 |
B.乳酸分子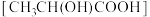 中含有一个手性碳原子 中含有一个手性碳原子 |
| C.氟的电负性大于氯的电负性,导致三氟乙酸的酸性大于三氯乙酸的酸性 |
| D.水很稳定是因为水中含有大量氢键 |
您最近半年使用:0次
名校
8 . A、B、C、D、E、F、G是元素周期表前四周期常见元素,且原子序数依次增大,其相关信息如表所示,请用化学用语回答下列问题。
(1)写出元素符号A:_______ ,B:_______ ,E_______ ,G:_______ 。
(2)C、D、E三种元素的原子半径由大到小的顺序为_______ (用元素符号表示)。
(3)由A、B、C三种元素分别与氢元素形成的简单气态氢化物,其空间构型分别为:_______ ,_______ ,_______ 。
(4)已知元素A、B形成的 分子中所有原子都满足8电子稳定结构,则
分子中所有原子都满足8电子稳定结构,则 中σ键与π键之比为
中σ键与π键之比为_______ 。
(5)G元素可形成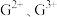 ,其中较稳定的是
,其中较稳定的是 ,试从核外电子排布的角度解释其原因:
,试从核外电子排布的角度解释其原因:_______ 。
(6)短周期元素M与D同族,已知元素M、F的电负性分别为1.5和3.0,预测它们形成的化合物是_______ 化合物(填“离子”或“共价”)。根据“对角线规则”,元素周期表中某些处于对角的元素,它们的化合物性质具有相似性,则M的最高价氧化物对应的水化物与NaOH溶液反应的离子方程式为_______ 。
| A | 原子核外有6种不同运动状态的电子 |
| C | 基态原子中s电子总数与p电子总数相等 |
| D | 电离能数据(单位: ):738、1451、7733、10540、13630…… ):738、1451、7733、10540、13630…… |
| E | 基态原子最外层电子排布式为: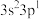 |
| F | 基态原子的最外层p轨道上2个电子的自旋状态与其他电子的自旋状态相反 |
| G | 其中一种氧化物是有磁性的黑色固体 |
(2)C、D、E三种元素的原子半径由大到小的顺序为
(3)由A、B、C三种元素分别与氢元素形成的简单气态氢化物,其空间构型分别为:
(4)已知元素A、B形成的
 分子中所有原子都满足8电子稳定结构,则
分子中所有原子都满足8电子稳定结构,则 中σ键与π键之比为
中σ键与π键之比为(5)G元素可形成
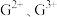 ,其中较稳定的是
,其中较稳定的是 ,试从核外电子排布的角度解释其原因:
,试从核外电子排布的角度解释其原因:(6)短周期元素M与D同族,已知元素M、F的电负性分别为1.5和3.0,预测它们形成的化合物是
您最近半年使用:0次
9 . 根据已学知识,请回答下列问题:
(1)基态N原子中,核外电子占据的最高能层的符号是L,占据该能层电子的原子轨道形状为_______ 。
(2)写出3p轨道上有2个未成对电子的元素的符号:_______ 。
(3)已知铬是24号元素,画出Cr的价层电子排布图:_______ 。
(4)从原子结构的角度分析B、N和O的第一电离能由大到小的顺序为_______ ,电负性由大到小的顺序是_______ 。
(5)Zn2+的核外电子排布式为_______ 。
(1)基态N原子中,核外电子占据的最高能层的符号是L,占据该能层电子的原子轨道形状为
(2)写出3p轨道上有2个未成对电子的元素的符号:
(3)已知铬是24号元素,画出Cr的价层电子排布图:
(4)从原子结构的角度分析B、N和O的第一电离能由大到小的顺序为
(5)Zn2+的核外电子排布式为
您最近半年使用:0次
名校
解题方法
10 . 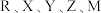 五种短周期主族元素,原子序数依次增大,R元素的原子最外层电子排布式为
五种短周期主族元素,原子序数依次增大,R元素的原子最外层电子排布式为 与M同主族,且M元素的原子序数为Y元素的2倍,Z是同周期元素中原子半径最大的元素,下列说法错误的是
与M同主族,且M元素的原子序数为Y元素的2倍,Z是同周期元素中原子半径最大的元素,下列说法错误的是
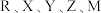 五种短周期主族元素,原子序数依次增大,R元素的原子最外层电子排布式为
五种短周期主族元素,原子序数依次增大,R元素的原子最外层电子排布式为 与M同主族,且M元素的原子序数为Y元素的2倍,Z是同周期元素中原子半径最大的元素,下列说法错误的是
与M同主族,且M元素的原子序数为Y元素的2倍,Z是同周期元素中原子半径最大的元素,下列说法错误的是A.电负性: | B.氢化物的沸点: |
| C.Z与Y形成的化合物中可能含有非极性共价键 | D.等物质的量浓度的 最高价氧化物对应的水化物水溶液酸性依次递增 最高价氧化物对应的水化物水溶液酸性依次递增 |
您最近半年使用:0次



