1 . 四种元素基态原子的电子排布式如下:① ;②
;② ;③
;③ ;④
;④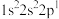 。下列有关比较中正确的是
。下列有关比较中正确的是
 ;②
;② ;③
;③ ;④
;④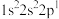 。下列有关比较中正确的是
。下列有关比较中正确的是| A.第一电离能:④>③>②>① | B.原子半径:④>③>①>② |
| C.电负性:③>④>①>② | D.最高正化合价:④=①>③=② |
您最近半年使用:0次
2024-01-24更新
|
134次组卷
|
7卷引用:山东省2019-2020学年高二下学期第二次联合考试化学试题
解题方法
2 . 铜、锌原子结构的特殊性,决定了它们的单质及其化合物在化工生产中发挥着重要的作用,回答下列问题。
(1)基态锌原子的价电子排布式为___________ ,基态 的核外电子存在
的核外电子存在___________ 种不同的空间运动状态。
(2)当黄铜受到氨腐蚀时,会出现“龟裂”现象,生成四氨合铜配合物。
① 中各非金属元素电负性由大到小的顺序为
中各非金属元素电负性由大到小的顺序为___________ ;阴离子中心原子的杂化轨道类型是___________ ,空间构型为___________ 。
② 中
中 的键角比独立
的键角比独立 的键角
的键角___________ (填“大”“小”或“相等”),原因是___________ 。
(3) 的熔点为872℃,
的熔点为872℃, 的熔点为275℃,
的熔点为275℃, 和
和 熔点差异大的原因为
熔点差异大的原因为___________ 。
(4)立方ZnS晶体常用作半导体材料,其晶胞结构如图甲所示,密度为 。
。
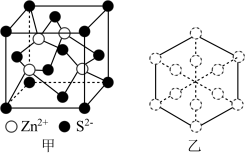
①两个S原子之间的最短距离为___________ nm(已知 为阿伏加德罗常数的值,用含
为阿伏加德罗常数的值,用含 、d的代数式表示)。
、d的代数式表示)。
②若ZnS晶胞沿体对角线方向投影,所得的Zn原子投影外围图形为正六边形,如图乙所示,则S原子的投影外围图形为___________ 。
(1)基态锌原子的价电子排布式为
 的核外电子存在
的核外电子存在(2)当黄铜受到氨腐蚀时,会出现“龟裂”现象,生成四氨合铜配合物。
①
 中各非金属元素电负性由大到小的顺序为
中各非金属元素电负性由大到小的顺序为②
 中
中 的键角比独立
的键角比独立 的键角
的键角(3)
 的熔点为872℃,
的熔点为872℃, 的熔点为275℃,
的熔点为275℃, 和
和 熔点差异大的原因为
熔点差异大的原因为(4)立方ZnS晶体常用作半导体材料,其晶胞结构如图甲所示,密度为
 。
。
①两个S原子之间的最短距离为
 为阿伏加德罗常数的值,用含
为阿伏加德罗常数的值,用含 、d的代数式表示)。
、d的代数式表示)。②若ZnS晶胞沿体对角线方向投影,所得的Zn原子投影外围图形为正六边形,如图乙所示,则S原子的投影外围图形为
您最近半年使用:0次
名校
解题方法
3 . 已知:元素的电负性和元素的化合价一样,也是元素的一种基本性质;两成键元素间电负性差值大于1.7时,通常形成离子键,两成键元素间电负性差值小于1.7时,通常形成共价键。下表给出了14种元素的电负性,则下列说法错误的是
| 元素 | Al | B | Be | C | Cl | F | Li |
| 电负性 | 1.5 | 2.0 | 1.5 | 2.5 | 3.0 | 4.0 | 1.0 |
| 元素 | Mg | N | Na | O | P | S | Si |
| 电负性 | 1.2 | 3.0 | 0.9 | 3.5 | 2.1 | 2.5 | 1.8 |
| A.随着原子序数递增,元素的电负性呈周期性变化 |
| B.元素电负性越大,其非金属性越强 |
| C.根据电负性数据可知Mg3N2中含有离子键 |
| D.BeCl2含金属元素铍,故属于离子化合物 |
您最近半年使用:0次
2023-07-29更新
|
96次组卷
|
6卷引用:【全国百强校】重庆市第一中学2017-2018学年高一下学期期中考试化学试题
【全国百强校】重庆市第一中学2017-2018学年高一下学期期中考试化学试题江西省赣州市石城县石城中学2020-2021学年高一下学期3月月考化学试题(已下线)第38练 原子结构与元素的性质-2023年高考化学一轮复习小题多维练(全国通用)第一章 本章复习提升1云南省龙陵县第一中学2022-2023学年高二下学期期末考试化学试题陕西省西安交通大学附属中学2023-2024学年高二上学期期中考试化学试题
名校
4 . 碳、硫、氧、氮是中学常见元素,下列说法不正确的是
A. 、 、 、 、 都是直线形分子 都是直线形分子 |
B. 、 、 、 、 的键角依次减小 的键角依次减小 |
C. 、 、 分子的中心原子都是 分子的中心原子都是 化 化 |
| D.C、N、F元素的电负性依次增大 |
您最近半年使用:0次
2023-06-08更新
|
114次组卷
|
4卷引用:四川省成都市蒲江县蒲江中学2019-2020学年高二下学期5月月考化学试题
名校
解题方法
5 . 有A、B、C、D四种主族元素,原子序数依次增大,A元素原子 轨道上有2个未成对电子。B元素原子的p轨道中有3个未成对电子,其简单气态氢化物在水中的溶解度在同族元素所形成的简单氢化物中最大。C的最高化合价和最低化合价的代数和为4,其最高价氧化物中含C的质量分数为40%,且其核内质子数等于中子数。D元素原子得一个电子填入
轨道上有2个未成对电子。B元素原子的p轨道中有3个未成对电子,其简单气态氢化物在水中的溶解度在同族元素所形成的简单氢化物中最大。C的最高化合价和最低化合价的代数和为4,其最高价氧化物中含C的质量分数为40%,且其核内质子数等于中子数。D元素原子得一个电子填入 轨道后,
轨道后, 轨道为全充满状态。请回答下列问题:
轨道为全充满状态。请回答下列问题:
(1) 分子中含有
分子中含有___________ 个 键,属于
键,属于___________ (填“极性”或“非极性”)分子。
(2)B的简单气态氢化物的立体构型为___________ , 原子采用
原子采用___________ 杂化。
(3)写出 的常见氧化物与
的常见氧化物与 的氧化物中互为等电子体的一组物质:
的氧化物中互为等电子体的一组物质:___________ 。
(4)C元素的电负性___________ (填“>”“<”或“=”)D元素的电负性,用一个化学方程式表示:___________ 。
 轨道上有2个未成对电子。B元素原子的p轨道中有3个未成对电子,其简单气态氢化物在水中的溶解度在同族元素所形成的简单氢化物中最大。C的最高化合价和最低化合价的代数和为4,其最高价氧化物中含C的质量分数为40%,且其核内质子数等于中子数。D元素原子得一个电子填入
轨道上有2个未成对电子。B元素原子的p轨道中有3个未成对电子,其简单气态氢化物在水中的溶解度在同族元素所形成的简单氢化物中最大。C的最高化合价和最低化合价的代数和为4,其最高价氧化物中含C的质量分数为40%,且其核内质子数等于中子数。D元素原子得一个电子填入 轨道后,
轨道后, 轨道为全充满状态。请回答下列问题:
轨道为全充满状态。请回答下列问题:(1)
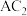 分子中含有
分子中含有 键,属于
键,属于(2)B的简单气态氢化物的立体构型为
 原子采用
原子采用(3)写出
 的常见氧化物与
的常见氧化物与 的氧化物中互为等电子体的一组物质:
的氧化物中互为等电子体的一组物质:(4)C元素的电负性
您最近半年使用:0次
2023-05-02更新
|
122次组卷
|
3卷引用:云南省盐津县第二中学2018-2019学年高二上学期12月份考试化学试题
名校
解题方法
6 . 已知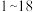 号元素的离子
号元素的离子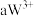 、
、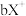 、
、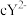 、
、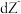 都具有相同电子层结构,下列关系正确的是
都具有相同电子层结构,下列关系正确的是
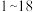 号元素的离子
号元素的离子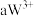 、
、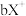 、
、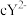 、
、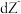 都具有相同电子层结构,下列关系正确的是
都具有相同电子层结构,下列关系正确的是A.质子数: ,离子的还原性: ,离子的还原性: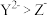 |
B.电负性: |
C.氢化物的稳定性: |
D.原子半径: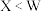 ,第一电离能: ,第一电离能: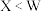 |
您最近半年使用:0次
2022-12-02更新
|
1051次组卷
|
33卷引用:2015-2016学年贵州省思南中学高二下第一次月考化学试卷
2015-2016学年贵州省思南中学高二下第一次月考化学试卷2015-2016学年山西大学附属中学高二下3月月考化学试卷2015-2016学年吉林省汪清六中高二3月月考化学试卷2015-2016学年山西大学附中高二下3月月考化学试卷2016-2017学年河北省衡水中学高二上学期五调考试化学试卷2016-2017学年河南省洛阳市第一高级中学高二(平行班)3月月考化学试卷2016-2017学年山西省大同市第一中学高二3月月考化学试卷福建省三明市第一中学2016-2017学年高二下学期半期考试化学试题贵州省思南中学2016-2017学年高二下学期期中考试化学试题人教版2017-2018学年高二化学选修三同步训练:第一章 原子结构与性质1河北省邢台市第二中学2017-2018学年高二化学选修三课时训练:第一章 综合检测1吉林省辽源五中2017-2018学年高二下学期第一次月考化学试题【全国百强校】甘肃省嘉峪关市酒钢三中2017-2018学年高二下学期期中考试化学试题【全国百强校】宁夏吴忠中学2017-2018学年高二6月月考化学试题2020届高三化学二轮物质结构题型专攻——元素性质的递变规律【选择提升专练】福建省厦门市思明区厦门外国语学校2019-2020学年高二上学期周末练习10——化学试题河南省林州市林虑中学2019-2020学年高二3月线上考试化学试题河北省石家庄市启明中学2019-2020学年高二四月月考化学试题吉林省白山市第七中学2019-2020学年高二下学期3月份月考化学试题鲁科版(新)必修第二册第一章检测题辽宁省六校协作体2019-2020学年高二下学期期中考试化学试卷(鲁科版2019)选择性必修2 第1章 原子结构与元素性质 第3节 元素性质及其变化规律(人教版2019)选择性必修2 第一章 原子结构与性质 第二节 原子结构与元素的性质(人教版2019)选择性必修2第一章 原子结构与性质 第二节 原子结构与元素的性质 第3课时 元素的电负性及其变化规律鲁科版2019选择性必修2第1章 原子结构与元素性质 第3节 元素性质及其变化规律 第2课时 元素的电负性及其变化规律(已下线)模块同步卷03 第一章综合检测-《灯塔金卷系列》2020-2021学年高二化学模块同步卷(人教版选修3)专题强化练2 电离能和电负性的应用吉林省辉南县第六中学2022-2023学年高二上学期期中考试化学试题湖南省长沙市周南中学2022-2023学年高二上学期期末考试化学试题安徽省池州市第一中学2022-2023学年高二下学期第一次月考化学试题北京市第三十五中学2021-2022学年高三上学期期中考试化学试题四川省内江市资中县第二中学2023-2024学年高二下学期3月月考化学试题黑龙江省黑河市第一中学2023-2024学年高二下学期4月月考化学试题
名校
解题方法
7 . 表中是元素周期表前五周期的一部分,X、Y、Z、R、W、J是6种元素的代号,其中J为0族元素。下列说法正确的是
| X | Y | Z | |
| R | |||
| W | |||
| J |
A.R原子的轨道表示式为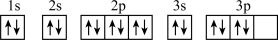 |
| B.Y2-与Na+的半径大小关系为Y2->Na+ |
| C.X的第一电离能小于Y的第一电离能 |
| D.表中电负性最大的元素为W |
您最近半年使用:0次
2022-10-03更新
|
272次组卷
|
11卷引用:第1章 原子结构——B拓展区综合拓展(鲁科版选修3)
第1章 原子结构——B拓展区综合拓展(鲁科版选修3)陕西省西安中学2019-2020学年高二下学期期末考试化学试题湖南师范大学附属中学2020-2021学年高二上学期第三次大练习化学试题(已下线)第一单元 原子结构(能力提升)-2020-2021学年高二化学单元测试定心卷(鲁科版选修3)(已下线)1.2 原子结构与元素的性质(B级能力练)-2020-2021学年高二化学章节分层检测ABC(人教版2019选择性必修2)新疆昌吉教育共同体2020-2021学年高二下学期期末质量检测化学试题浙江省“南太湖”联盟2021-2022学年高二下学期第一次联考化学试题 专题2 原子结构与元素性质 本专题达标检测福建省泉州科技中学2021-2022学年高二下学期期中考试化学试题广东省华南师范大学附属中学2022-2023学年高二下学期3月月考化学试题福建省福州市四校联盟2022-2023学年高二下学期期末联考化学试题
8 . 回答下列问题
(1)Li2O是离子晶体,它形成设计如图1所示Born﹣Haber循环。

可知,Li元素的第一电离能为_______ kJ•mol﹣1,O=O键键能为 _______ kJ•mol﹣1。
(2)所示基态原子或离子的价层电子排布图正确的有 _______。
(3)在浓硝酸和浓硫酸的混合溶液中存在NO 、HSO
、HSO ,该物质中电负性最大的元素为
,该物质中电负性最大的元素为 _______ ,除氢外,其它元素第一电离能由大到小排序为 _______ 。
(4)1mol丙二烯(CH2=C=CH2)分子中含有_______ molσ键。
(5)已知,多个相邻且平行的p轨道重叠则形成大π键,分子中的大π键可用符号π 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为π
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为π ),则环戊二烯负离子(
),则环戊二烯负离子( 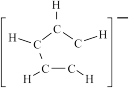 ),图中未标出π键)的大π键可表示为
),图中未标出π键)的大π键可表示为 _______ 。
(1)Li2O是离子晶体,它形成设计如图1所示Born﹣Haber循环。

可知,Li元素的第一电离能为
(2)所示基态原子或离子的价层电子排布图正确的有 _______。
A.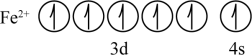 |
B.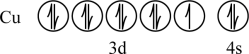 |
C.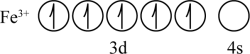 |
D. |
 、HSO
、HSO ,该物质中电负性最大的元素为
,该物质中电负性最大的元素为 (4)1mol丙二烯(CH2=C=CH2)分子中含有
(5)已知,多个相邻且平行的p轨道重叠则形成大π键,分子中的大π键可用符号π
 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为π
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为π ),则环戊二烯负离子(
),则环戊二烯负离子(  ),图中未标出π键)的大π键可表示为
),图中未标出π键)的大π键可表示为
您最近半年使用:0次
9 . 根据元素周期表中完整周期元素的性质,填写下列空白。
(1)在第三周期中,第一电离能最小的元素符号是_______ ,其原子的结构示意图为_______ ,第一电离能最大的元素符号是_______ ,其电子排布式为_______ 。
(2)在元素周期表中,电负性最大的元素名称是_______ ,其价电子排布图为_______ 。
(3)第四周期元素中未成对电子数最多的元素符号是_______ ,其基态原子的简化电子排布式为_______ ,有_______ 个未成对电子,有_______ 个能级,能量最高的能级符号为_______ 。
(4)某元素的基态原子价电子排布式为3d104s1 ,该元素符号是_______ ,原子中所有电子占有_______ 个轨道,核外共有_______ 个不同运动状态的电子。
(5)某元素的正三价离子的3d能级为半充满,其硫酸盐水溶液显_______ 性(填“酸”、“碱”或“中”),用离子方程式解释其原因_______ 。
(6)用惰性电极电解第三周期原子半径最大的元素的氯化物的水溶液,其阳极反应的电极方程式为_______ 。电解一段时间后,阴极区pH_______ (填“增大”、“减小”或“不变”)
(1)在第三周期中,第一电离能最小的元素符号是
(2)在元素周期表中,电负性最大的元素名称是
(3)第四周期元素中未成对电子数最多的元素符号是
(4)某元素的基态原子价电子排布式为3d104s1 ,该元素符号是
(5)某元素的正三价离子的3d能级为半充满,其硫酸盐水溶液显
(6)用惰性电极电解第三周期原子半径最大的元素的氯化物的水溶液,其阳极反应的电极方程式为
您最近半年使用:0次
解题方法
10 . 硒(Se)的原子序数为34,与氧、硫同主族,下列说法正确的是
| A.硒的最高价是+6价,所以只有一种氧化物SeO3 |
| B.H2Se的热稳定性比H2S差,还原性比H2S弱 |
| C.氧、硫、硒三种元素的电负性递减 |
| D.原子序数为33的元素是砷(As),则砷原子的第一电离能小于硒原子的第一电离能 |
您最近半年使用:0次



