1 . 盐酸、硝酸、硫酸在工业生产中具有重要的作用。
(1)“王水”是浓盐酸和浓硝酸按体积比3: l组成的混合物,“王水”溶金的原理为HNO3+3HCl=Cl2+NOCl+2H2O,金离子与氯离子形成AuCl4-离子,增强了金属的还原能力。
① 试写出金与王水反应生成H[AuCl4]的化学方程式:_________ ;其中AuCl4-的配位数是________ ;
② 已知:NOCl的熔点-645℃,沸点-5.5℃,NOCl固体的晶体类型是__________ ;
③ 组成NOCl分子的三种元素中,电负性N_____ O(填“>”、“<”或“=”);熔沸点H2O____ NH3(填“>”、“<”或“=”);与NH3互为等电子体的阳离子有________ (写出一种即可)。
(2)硝酸在有机反应中也有重要用途。TNT炸药、苦味酸是硝酸与甲苯、苯酚发生取代反应制成的。其中甲苯分子中碳原子的杂化方式为______ , 1mol甲苯分子中含有σ键的数目为_____ ;试解释在水中苯酚溶解度大于甲苯的原因________ 。
(3)在硝酸工业中有一种重要金属即为Cu,CuCl晶胞结构如图所示。已知该晶体的密度为ρg·cm-3,阿伏伽德罗常数为NA,则该晶胞边长为_______ pm (只写计算式)。
(1)“王水”是浓盐酸和浓硝酸按体积比3: l组成的混合物,“王水”溶金的原理为HNO3+3HCl=Cl2+NOCl+2H2O,金离子与氯离子形成AuCl4-离子,增强了金属的还原能力。
① 试写出金与王水反应生成H[AuCl4]的化学方程式:
② 已知:NOCl的熔点-645℃,沸点-5.5℃,NOCl固体的晶体类型是
③ 组成NOCl分子的三种元素中,电负性N
(2)硝酸在有机反应中也有重要用途。TNT炸药、苦味酸是硝酸与甲苯、苯酚发生取代反应制成的。其中甲苯分子中碳原子的杂化方式为

(3)在硝酸工业中有一种重要金属即为Cu,CuCl晶胞结构如图所示。已知该晶体的密度为ρg·cm-3,阿伏伽德罗常数为NA,则该晶胞边长为
您最近半年使用:0次
名校
解题方法
2 . 钛(22Ti)铝合金在航空领域应用广泛。回答下列问题:
(1)基态Ti原子的核外电子排布式为[Ar]_______ ,其中s轨道上总共有_________ 个电子。
(2)六氟合钛酸钾(K2TiF6)中存在[TiF6]2- 配离子,则钛元素的化合价是____ ,配体是______ 。
(3)TiCl3 可用作烯烃定向聚合的催化剂,例如丙烯用三乙基铝和三氯化钛做催化剂时,可以发生下列聚合反应: n CH3CH=CH2
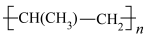 ,该反应中涉及的物质中碳原子的杂化轨道类型有
,该反应中涉及的物质中碳原子的杂化轨道类型有______________ ;反应中涉及的元素中电负性最大的是______________ 。三乙基铝是一种易燃物质,在氧气中三乙基铝完全燃烧所得产物中分子的立体构型是直线形的是__________________ 。
(4)钛与卤素形成的化合物的熔沸点如下表所示,
分析TiCl4、TiBr4 、TiI4的熔点和沸点呈现一定规律的原因是__________ 。
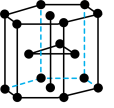
(5)金属钛有两种同素异形体,常温下是六方堆积,高温下是体心立方堆积。如上图所示是钛晶体的一种晶胞,晶胞体积为a nm3,则该钛晶体的密度为_____ g·cm-3(用NA 表示阿伏伽德罗常数的值,列出计算式即可)。
(1)基态Ti原子的核外电子排布式为[Ar]
(2)六氟合钛酸钾(K2TiF6)中存在[TiF6]2- 配离子,则钛元素的化合价是
(3)TiCl3 可用作烯烃定向聚合的催化剂,例如丙烯用三乙基铝和三氯化钛做催化剂时,可以发生下列聚合反应: n CH3CH=CH2

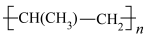 ,该反应中涉及的物质中碳原子的杂化轨道类型有
,该反应中涉及的物质中碳原子的杂化轨道类型有(4)钛与卤素形成的化合物的熔沸点如下表所示,
| 物质 | 熔点/℃ | 沸点/℃ |
| TiCl4 | -25 | 136.5 |
| TiBr4 | 39 | 230 |
| TiI4 | 150 | 377 |

(5)金属钛有两种同素异形体,常温下是六方堆积,高温下是体心立方堆积。如上图所示是钛晶体的一种晶胞,晶胞体积为a nm3,则该钛晶体的密度为
您最近半年使用:0次
名校
解题方法
3 . 下表是元素周期表的一部分,其中所列数字分别代表某一元素。
请你根据表中所给元素,回答下列问题:
(1)表中属于d区的元素是_________ (填编号)。
(2)⑤⑥⑦三种元素中电负性最大的是_____ (填写元素符号),在第二周期中第一电离能介于②和③之间的元素有_______ 种;
(3)元素⑨在周期表中的位置_______________ 。
(4)元素⑧和⑦能形成一种常见的干燥剂,它的电子式为_____________ 。
(5)写出下列有关反应的离子方程式:⑩的单质与元素③的最高价氧化物,对应的水化物的稀溶液反应:___________________________ 。
(6)⑥和⑦相比较,非金属性较弱的是______ (填元素符号),可以验证你的结论的是下列中的_____ (填编号)。
a.气态氢化物的稳定性; b.两元素的电负性;c.含氧酸的酸性; d. 最高化合价
(7)①与③的元素形成的10电子中性分子X的空间构型为_____ ,它极易溶于水中,请简要说明该物质易溶于水的原因_______________
| ① | |||||||||||||||||
| ② | ③ | ④ | |||||||||||||||
| ⑤ | ⑥ | ⑦ | |||||||||||||||
| ⑧ | ⑨ | ⑩ |
请你根据表中所给元素,回答下列问题:
(1)表中属于d区的元素是
(2)⑤⑥⑦三种元素中电负性最大的是
(3)元素⑨在周期表中的位置
(4)元素⑧和⑦能形成一种常见的干燥剂,它的电子式为
(5)写出下列有关反应的离子方程式:⑩的单质与元素③的最高价氧化物,对应的水化物的稀溶液反应:
(6)⑥和⑦相比较,非金属性较弱的是
a.气态氢化物的稳定性; b.两元素的电负性;c.含氧酸的酸性; d. 最高化合价
(7)①与③的元素形成的10电子中性分子X的空间构型为
您最近半年使用:0次
2017-05-26更新
|
125次组卷
|
2卷引用:山西省怀仁县第一中学2016-2017学年高二下学期第三次(5月)月考化学试题
名校
解题方法
4 . 硼(B)及其化合物是结构化学的重要研究对象。请回答下列问题:
(1)和B同主族电负性最小的元素[放射性元素(周期表中84号及其后的元素)除外]的价电子排布式为___________ ,Be、B、C的第一电离能由大到小的顺序是___________________ (用元素符号表示)
(2)无机苯(B3N3H6)与苯结构相似,其中B的杂化方式为______________ ,1mol B3N3H6中σ键的数目为______________________ 。
(3)Al和B同主族,其化合物氟化铝的熔沸点远远高于氯化铝,试解释其原因________________ 。
(4)将硼砂(NaB4O7)和NH4C1共热可得白色固体BN和B2O3、方程式_________________________ 。
氮化硼有两种晶型结构,一种是六方氮化硼,其结构与石墨相似却不导电,原因是__________________ ;另一种是类似于金刚石结构的立方氮化硼,已知晶胞边长为361.5pm,N原子半径为a pm,则B原子半径为___________ pm(只要求列算式)。
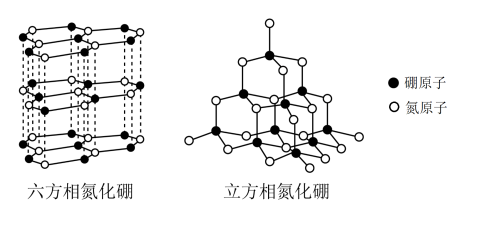
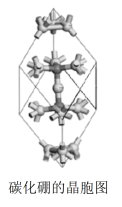
(5)碳化硼是除金刚石和氮化硼外最硬的固体,下图是碳化硼的晶胞简图,该图给出了晶胞中的所有原子,除“三原子”(中心原子和其相连的2个原子)外,晶胞的其余原子都是B12多面体中的1个原子,B12多面体的其他原子都不在晶胞内,均未画出。图中原子旁的短棍表示该原子与其他原子相连,若上述三原子都是碳原子,写出碳化硼的化学式_____________________ 。
(1)和B同主族电负性最小的元素[放射性元素(周期表中84号及其后的元素)除外]的价电子排布式为
(2)无机苯(B3N3H6)与苯结构相似,其中B的杂化方式为
(3)Al和B同主族,其化合物氟化铝的熔沸点远远高于氯化铝,试解释其原因
(4)将硼砂(NaB4O7)和NH4C1共热可得白色固体BN和B2O3、方程式
氮化硼有两种晶型结构,一种是六方氮化硼,其结构与石墨相似却不导电,原因是

(5)碳化硼是除金刚石和氮化硼外最硬的固体,下图是碳化硼的晶胞简图,该图给出了晶胞中的所有原子,除“三原子”(中心原子和其相连的2个原子)外,晶胞的其余原子都是B12多面体中的1个原子,B12多面体的其他原子都不在晶胞内,均未画出。图中原子旁的短棍表示该原子与其他原子相连,若上述三原子都是碳原子,写出碳化硼的化学式

您最近半年使用:0次
5 . 铬、铁、镍、铜等金属及其化合物在工业上有重要用途。
(l)基态铬原子的价电子排布式为___________ 。
(2)CrO2C12和NaClO均可作化工生产的氧化剂或氯化剂。制备CrO2C12的反应为:
K2Cr2O7 + 3CCl4 = 2KCl+ 2 CrO2C12+ 3COCl2↑
① 上述反应式中非金属元素电负性由大到小的顺序是_______ (用元素符号表示)。
② 常温下CrO2C12是一种易溶于CCl4的液体,则固态CrO2C12属于______ 晶体。
③ COCl2分子中所有原子均满足8电子结构,则COCl2分子中σ键和π键的个数比为_______ 。
(3)NiO、FeO的晶体结构均与氯化钠的晶体结构相同,其中Ni2+和Fe2+的半径分别为6.9×10-2 nm 和7.8×10-2 nm,则熔点:NiO______ (填“< ”、“= ”或“>” ) FeO。
④CuCl的盐酸溶液能吸收CO生成复合物氯化羰基亚铜[Cu2Cl2(CO)2·2H2O] ,其结构如图所示。下列说法不正确的是_____ (填字母序号)。
A.该复合物中只含有离子键和配位键 B.该复合物中Cl原子的杂化类型为sp3
C.该复合物中只有CO和H2O作为配位体 D.CO与N2的价电子总数相同,其结构为C≡O
(l)基态铬原子的价电子排布式为
(2)CrO2C12和NaClO均可作化工生产的氧化剂或氯化剂。制备CrO2C12的反应为:
K2Cr2O7 + 3CCl4 = 2KCl+ 2 CrO2C12+ 3COCl2↑
① 上述反应式中非金属元素电负性由大到小的顺序是
② 常温下CrO2C12是一种易溶于CCl4的液体,则固态CrO2C12属于
③ COCl2分子中所有原子均满足8电子结构,则COCl2分子中σ键和π键的个数比为
(3)NiO、FeO的晶体结构均与氯化钠的晶体结构相同,其中Ni2+和Fe2+的半径分别为6.9×10-2 nm 和7.8×10-2 nm,则熔点:NiO
④CuCl的盐酸溶液能吸收CO生成复合物氯化羰基亚铜[Cu2Cl2(CO)2·2H2O] ,其结构如图所示。下列说法不正确的是
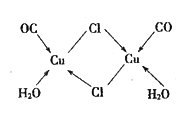
A.该复合物中只含有离子键和配位键 B.该复合物中Cl原子的杂化类型为sp3
C.该复合物中只有CO和H2O作为配位体 D.CO与N2的价电子总数相同,其结构为C≡O
您最近半年使用:0次
2017-05-17更新
|
221次组卷
|
2卷引用:安徽省合肥市第一中学2016-2017学年高二下学期期中考试化学试题
解题方法
6 . 锌及其化合物在工农业生成中有广泛的应用,二氧化碳和乙二醇在ZnO或锌盐催化下可合成碳酸乙烯酯。
(1)基态锌原子的价电子排布式为_____________ ;在基态18O原子中,核外存在_____________ 对自旋相反的电子。
(2)乙二醇中C、H、O的电负性大小关系是_____________________ ;碳酸乙烯酯中碳原子的杂化轨道类型为_____________ ;1 mol碳酸乙烯酯中含有的σ键的数目为_____________________ (设NA为阿伏伽德罗常数的值)。
(3)锌盐的水溶液中Zn2+可与H2O形成[Zn(H2O)6]2+,其中提供空轨道的是_____________ (填微粒符号),[Zn(H2O)6]2+中所含化学键的类型为_______________ 。
(4)阴离子X-与CO2互为等电子体且X-内含共价键和氢键,则X-的化学式为_______________ 。
(5)—种锌金合金晶体具有面心立方最密堆积结构,在晶胞中金原子位于顶点,锌原子位于面心,则该合金中金原子与锌原子个数之比为_____________ ;若该晶体的晶胞棱长为a pm(1 pm=10-12 m),则该合金的密度为_____________ g • cm-3(列出计算式,不要求计算结果,阿伏伽德罗常数的值为NA)。
(1)基态锌原子的价电子排布式为
(2)乙二醇中C、H、O的电负性大小关系是
(3)锌盐的水溶液中Zn2+可与H2O形成[Zn(H2O)6]2+,其中提供空轨道的是
(4)阴离子X-与CO2互为等电子体且X-内含共价键和氢键,则X-的化学式为
(5)—种锌金合金晶体具有面心立方最密堆积结构,在晶胞中金原子位于顶点,锌原子位于面心,则该合金中金原子与锌原子个数之比为
您最近半年使用:0次
7 . 某硅酸盐研究所在硅酸盐材料和闪烁晶体等领域研究上取得了重大的成就。
(1)[SiO4]4-是构成硅酸盐的基本结构单元,通过共用氧相连可形成硅氧组群。
①基态硅原子价电子的轨道表示式是_____________ 。
②与[SiO4]4-互为等电子体的微粒符号是_____________ 任写一种)。
③下图为一种硅氧组群的结构示意图,其离子符号为_____________ ,其中Si原子的杂化方式为_____________ 。
④电负性:Si______ O(填“>”、 “=”或“<” )。
(2)钨酸铅(PWO)是一种闪烁晶体,晶胞结构如图所示。
PWO中钨酸根结构式为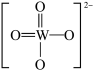 ,该离子中,σ键和π键的个数比是
,该离子中,σ键和π键的个数比是_____________ 。
②PWO晶体中含有的微粒间作用力是___________________
A.范德华力 B.离子键 C.共价键 D.金属键
③已知PWO的摩尔质量为Mg·mol-1,则该晶体的密度d=_____________ g·cm-3。
(1)[SiO4]4-是构成硅酸盐的基本结构单元,通过共用氧相连可形成硅氧组群。
①基态硅原子价电子的轨道表示式是
②与[SiO4]4-互为等电子体的微粒符号是
③下图为一种硅氧组群的结构示意图,其离子符号为

④电负性:Si
(2)钨酸铅(PWO)是一种闪烁晶体,晶胞结构如图所示。
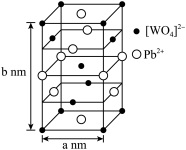
PWO中钨酸根结构式为
 ,该离子中,σ键和π键的个数比是
,该离子中,σ键和π键的个数比是②PWO晶体中含有的微粒间作用力是
A.范德华力 B.离子键 C.共价键 D.金属键
③已知PWO的摩尔质量为Mg·mol-1,则该晶体的密度d=
您最近半年使用:0次
2017-05-11更新
|
430次组卷
|
4卷引用:福建省宁德市2017届高三毕业班第二次质量检查理科综合化学试题
名校
8 . 下列说法中不正确的是
| A.同主族元素从上到下的第一电离能逐渐减小 |
| B.同周期主族元素从左到右,原子半径逐渐减小 |
| C.电负性是相对值,所以没有单位 |
| D.金属元素的电负性较大,非金属元素的电负性较小 |
您最近半年使用:0次
名校
解题方法
9 . Fe、HCN与K2CO3在一定条件下发生如下反应:
Fe+6HCN+2K2CO3=K4Fe(CN)6+H2↑+2CO2↑+2H2O,回答下列问题:
(1)此化学方程式中涉及的第二周期元素的电负性由小到大的顺序为___________________ 。
(2)配合物K4Fe(CN)6的中心离子是____________ ,该离子价电子的基态电子排布图为____________ 。
(3)lmol HCN分子中含有σ键的数目为____________ ,HCN分子中碳原子轨道杂化类型是____________ ,与CN-互为等电子体的阴离子是____________ 。
(4)K2CO3中阴离子的空间构型为____________ ,其中碳原子的价层电子对数为____________ 。
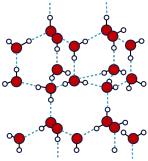
(5)冰的晶体结构模型如图,它的晶胞与金刚石相似,水分子之间以氢键相连接,在一个晶胞有__________ 个氢键,若氢键键长为d nm,则晶体密度(g/cm3)计算式为____________ (用NA表示阿伏加德罗常数的值)。
Fe+6HCN+2K2CO3=K4Fe(CN)6+H2↑+2CO2↑+2H2O,回答下列问题:
(1)此化学方程式中涉及的第二周期元素的电负性由小到大的顺序为
(2)配合物K4Fe(CN)6的中心离子是
(3)lmol HCN分子中含有σ键的数目为
(4)K2CO3中阴离子的空间构型为
(5)冰的晶体结构模型如图,它的晶胞与金刚石相似,水分子之间以氢键相连接,在一个晶胞有

您最近半年使用:0次
2017-05-07更新
|
498次组卷
|
4卷引用:黑龙江省哈尔滨师范大学附属中学2017届高三第三次模拟考试化学试题
解题方法
10 . (1)中国古代四大发明之一黑火药,它的爆炸反应为2KNO3+3C+S =A + N2↑ +3CO2↑(已配平)
①除S外,上述反应中所涉及到的非金属元素的电负性从大到小顺序依次为_____________ ,K2O,CO2,SO2,SiO2四种晶体的熔点由高到低的顺序______________________
②生成物A的电子式为_____________ 。推算HCN分子中 键与
键与 键数目之比为
键数目之比为_______________ 。
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多 2。T在元素周期表中的位置为__________________ ,1molQ2+的未成对电子数是__________ 个。
(3)在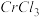 的水溶液中,一定条件下存在组成为
的水溶液中,一定条件下存在组成为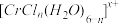 (n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:
(n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:
[CrCln(H2O)6-n]x+ + xR-H = Rx[CrCln (H2O)6-n] + xH+
交换出来的H+经中和滴定,即可求出x和n,从而确定配离子的组成。
将含0.0015 mol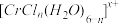 的溶液,与R-H完全交换后,中和交换过程中生成的H+需浓度为0.1200 mol·L-1 的NaOH溶液25.00 ml,则该配离子的化学式为
的溶液,与R-H完全交换后,中和交换过程中生成的H+需浓度为0.1200 mol·L-1 的NaOH溶液25.00 ml,则该配离子的化学式为_________________________ 。
①除S外,上述反应中所涉及到的非金属元素的电负性从大到小顺序依次为
②生成物A的电子式为
 键与
键与 键数目之比为
键数目之比为(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多 2。T在元素周期表中的位置为
(3)在
 的水溶液中,一定条件下存在组成为
的水溶液中,一定条件下存在组成为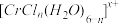 (n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:
(n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:[CrCln(H2O)6-n]x+ + xR-H = Rx[CrCln (H2O)6-n] + xH+
交换出来的H+经中和滴定,即可求出x和n,从而确定配离子的组成。
将含0.0015 mol
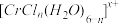 的溶液,与R-H完全交换后,中和交换过程中生成的H+需浓度为0.1200 mol·L-1 的NaOH溶液25.00 ml,则该配离子的化学式为
的溶液,与R-H完全交换后,中和交换过程中生成的H+需浓度为0.1200 mol·L-1 的NaOH溶液25.00 ml,则该配离子的化学式为
您最近半年使用:0次



