名校
解题方法
1 . 下列说法中,正确的是
| A.元素周期表中,氟的电负性最大,锂的电负性最小 |
| B.所有元素中,氟的第一电离能最大 |
| C.主族元素的最高正价一定等于族序数 |
| D.金属元素的电负性一般小于1.8 |
您最近一年使用:0次
2018-01-20更新
|
220次组卷
|
3卷引用:吉林省扶余市第一中学2017-2018学年高二上学期期末考试化学试题
解题方法
2 . [化学——选修 3:物质结构与性质]
(1) 过渡金属元素铁能形成多种配合物,如:[Fe (CN) 6] 4-、[Fe(SCN)6]3-等。
Fe3+的核外电子排布式为______________ ,从原子结构的角度解释Fe3+比Fe2+稳定的理由是_______________ 。
(2) N的基态原子中能量最高的电子,其电子云在空间有________ 个方向,原子轨道呈________ 形。
(3) (NH4)2SO4阴离子的立体构型是________ ,NH4+中心原子的杂化类型是________ 。
(4) Fe 有δ、γ、α三种同素异形体,其晶胞结构如下图所示:
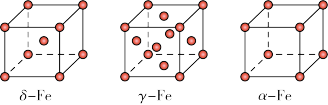
① δ、α两种晶体晶胞中铁原子的配位数之比为_____________ 。
② 1个γ晶体晶胞中所含有的铁原子数为_____________ 。
③ 若Fe原子半径为rpm,NA表示阿伏伽德罗常数的值,则δ-Fe单质的密度为____________ g/cm3(列出算式即可)。
(1) 过渡金属元素铁能形成多种配合物,如:[Fe (CN) 6] 4-、[Fe(SCN)6]3-等。
Fe3+的核外电子排布式为
(2) N的基态原子中能量最高的电子,其电子云在空间有
(3) (NH4)2SO4阴离子的立体构型是
(4) Fe 有δ、γ、α三种同素异形体,其晶胞结构如下图所示:

① δ、α两种晶体晶胞中铁原子的配位数之比为
② 1个γ晶体晶胞中所含有的铁原子数为
③ 若Fe原子半径为rpm,NA表示阿伏伽德罗常数的值,则δ-Fe单质的密度为
您最近一年使用:0次
2018-01-17更新
|
321次组卷
|
2卷引用:广东省五校(珠海二中,深圳二高,阳春一中,肇庆一中,真光中学)2018届高三1月联考理综化学试题
名校
解题方法
3 . Cu、Fe、Se、Co、Si常用于化工材料的合成。请回答下列问题:
(1)铁离子(Fe3+)最外层电子排布式为______ ,其核外共有______ 种不同运动状态的电子。Fe3+比Fe2+更稳定的原因是____________________________________ 。
(2)硒为第四周期元素,相邻的元素有砷和溴,则三种元素的电负性从大到小的顺序为________ (用元素符号表示)。
(3)Na3[Co(NO2)6]常用作检验K+的试剂,在[Co(NO2)6]3-中存在的化学键有____ 、_____ 。
(4)C与N能形成一种有毒离子CN-,能结合Fe3+形成配合物,写出一个与该离子互为等电子体的极性分子的分子式_____ ,HCN分子的空间构型为____________ 。
(5)单晶硅的结构与金刚石的结构相似,若将金刚石晶体中一半的C原子换成Si原子且同种原子间不成键,则得如图所示的金刚砂(SiC)结构。

在SiC晶体中,C原子的杂化方式为_________ ,每个Si原子被_______ 个最小环所共有。
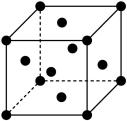
(6)已知Cu的晶胞结构如图,棱长为acm,又知Cu的密度为pg/cm3,则用a、p的代数式表示阿伏伽德罗常数为____ mol-1。
(1)铁离子(Fe3+)最外层电子排布式为
(2)硒为第四周期元素,相邻的元素有砷和溴,则三种元素的电负性从大到小的顺序为
(3)Na3[Co(NO2)6]常用作检验K+的试剂,在[Co(NO2)6]3-中存在的化学键有
(4)C与N能形成一种有毒离子CN-,能结合Fe3+形成配合物,写出一个与该离子互为等电子体的极性分子的分子式
(5)单晶硅的结构与金刚石的结构相似,若将金刚石晶体中一半的C原子换成Si原子且同种原子间不成键,则得如图所示的金刚砂(SiC)结构。

在SiC晶体中,C原子的杂化方式为
(6)已知Cu的晶胞结构如图,棱长为acm,又知Cu的密度为pg/cm3,则用a、p的代数式表示阿伏伽德罗常数为

您最近一年使用:0次
名校
解题方法
4 . 铁被誉为“第一金属”,铁及其化合物广泛应用于生活、生产、国防等领域。
(1)Fe2+是构成人体血红蛋白(如图1所示)的重要元素,基态Fe2+简化的电子排布式为___________ ;用物质结构与性质知识分析Fe2+在空气中容易被氧化成Fe3+的主要原因:_________________________________________ 。
(2)血红蛋白中所含非金属元素的电负性由小到大的顺序为___________ ;碳原子的杂化轨道类型为__________________ 杂化。
(3)羰基铁[Fe(CO)5]可用作催化剂等。1mol[Fe(CO)5]分子中含有____ mol 的σ键,与CO 互为等电子体的离子的化学式为___________________________ (写一种)。
(4)据报道,工业上可电解熔融的FeO、Fe2O3 冶炼高纯铁。Fe2O3的熔点_____ (填“高于”或“低于”) FeO 的熔点,理由是____________________________________________ 。
(5)铁晶体有面心立方、体心立方。在这两种晶体中铁的配位数之比为______________ 。
(6)某种氮化铁晶体的晶胞如图2 所示。已知:该晶胞边长、高分别为a nm、b nm,NA=6.02×1023 mol-l
①该氮化铁晶体的化学式为______________ 。
②列式表示该氮化铁晶体的密度_________________________________________ 。


(1)Fe2+是构成人体血红蛋白(如图1所示)的重要元素,基态Fe2+简化的电子排布式为
(2)血红蛋白中所含非金属元素的电负性由小到大的顺序为
(3)羰基铁[Fe(CO)5]可用作催化剂等。1mol[Fe(CO)5]分子中含有
(4)据报道,工业上可电解熔融的FeO、Fe2O3 冶炼高纯铁。Fe2O3的熔点
(5)铁晶体有面心立方、体心立方。在这两种晶体中铁的配位数之比为
(6)某种氮化铁晶体的晶胞如图2 所示。已知:该晶胞边长、高分别为a nm、b nm,NA=6.02×1023 mol-l
①该氮化铁晶体的化学式为
②列式表示该氮化铁晶体的密度


您最近一年使用:0次
名校
5 . 二氧化碳和乙二醇在氧化锌或锌盐催化下可合成碳酸乙烯酯。

回答下列问题:
(1)锌基态离子的价电子排布图为_______________ ;在基态18O原子中,核外电子存在_________ 种空间运动状态。
(2)乙二醇中C、H、O的电负性大小关系是__________ ;碳酸乙烯酯中碳原子的杂化轨道类型有___________ ;1mol 碳酸乙烯酯中含有的σ键的数目为__________ NA。
(3)锌盐水溶液中Zn2+可与H2O之间形成[Zn(H2O)6]2+,配体中的配位原子是_________ (填微粒符号),[Zn(H2O)6]2+中所含化学键的类型为__________________________ 。
(4)阴离子X-与CO2互为等电子体且X-内含共价键和氢键,则X-的化学式为______________ 。
(5)一种锌金合金晶体的立方体晶胞中,金原子位于顶点,锌原子位于面心,则该合金中金原子与锌原子的个数之比为_________ ;若该晶体的晶胞棱长为apm(1pm=10-12m),则该合金的密度为_______ g·cm-3(用NA表示阿伏伽德罗常数的值,列出算式不要求结果)。

回答下列问题:
(1)锌基态离子的价电子排布图为
(2)乙二醇中C、H、O的电负性大小关系是
(3)锌盐水溶液中Zn2+可与H2O之间形成[Zn(H2O)6]2+,配体中的配位原子是
(4)阴离子X-与CO2互为等电子体且X-内含共价键和氢键,则X-的化学式为
(5)一种锌金合金晶体的立方体晶胞中,金原子位于顶点,锌原子位于面心,则该合金中金原子与锌原子的个数之比为
您最近一年使用:0次
2018-01-15更新
|
257次组卷
|
2卷引用:黑龙江省哈尔滨市第三中学2018届高三第四次测试(期末)理综化学试题
名校
解题方法
6 . [化学一选修3:物质结构与性质]
金属材料在国民经济建设等领域具有重要应用,镁、镍、铜是几种重要的金属元素,请回答下列问题:
(1)镍元素的核电荷数为28,则原子基态电子排布式为________ ,结构中有 ___ 种不同形状的电子云。
(2)MgO的熔点高于CuO的原因是__________________________
(3)Mg元素的第一电离能反常地高于同周期后一种元素,原因是_____________________
(4)Ni与CO能形成配合物Ni(CO)4,该分子中σ键与π键个数比为_____________________
(5)配合物[Cu(CH3C≡N)4]BF4中碳原子杂化轨道类型为______ ,BF4-的空间构型为_________________ 。
(6)铜与氧元素可形成如图所示的晶胞结构,其中Cu均匀地分散在立方体内部,a、b的坐标参数依次为(0,0,0)、(1/2,1/2,1/2),则d的坐标参数为____________ ,已知该晶体的密度为ρg/cm3,NA是阿伏伽德罗常数值,则晶胞参数为 _______________ cm(列出计算式即可)。
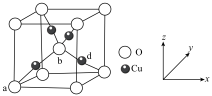
金属材料在国民经济建设等领域具有重要应用,镁、镍、铜是几种重要的金属元素,请回答下列问题:
(1)镍元素的核电荷数为28,则原子基态电子排布式为
(2)MgO的熔点高于CuO的原因是
(3)Mg元素的第一电离能反常地高于同周期后一种元素,原因是
(4)Ni与CO能形成配合物Ni(CO)4,该分子中σ键与π键个数比为
(5)配合物[Cu(CH3C≡N)4]BF4中碳原子杂化轨道类型为
(6)铜与氧元素可形成如图所示的晶胞结构,其中Cu均匀地分散在立方体内部,a、b的坐标参数依次为(0,0,0)、(1/2,1/2,1/2),则d的坐标参数为

您最近一年使用:0次
2018-01-12更新
|
552次组卷
|
4卷引用:河南省中原名校2018届高三上学期第五次联考化学试题
名校
解题方法
7 . 利用 合成的新型三元催化剂[La0.8Cu0.2Ni1-xMxO3(M 分别为Mn、Fe和Co)]可以使汽车尾气中NO和CO发生反应而减少尾气污染,同时可大大降低重金属的用量。回答下列问题:
合成的新型三元催化剂[La0.8Cu0.2Ni1-xMxO3(M 分别为Mn、Fe和Co)]可以使汽车尾气中NO和CO发生反应而减少尾气污染,同时可大大降低重金属的用量。回答下列问题:
(1)Mn2+的核外电子排布式为:________________ ,其单电子数为_________________ 。
(2)C、N、O、Mn电负性由大到小的顺序是___________ 。
(3) 也是常见配体,其中采取sp2杂化的碳原子和sp3杂化的碳原子个数比为
也是常见配体,其中采取sp2杂化的碳原子和sp3杂化的碳原子个数比为_____ 。
(4)蓝色物质KFe(Ⅲ)x[Fe(Ⅱ)(CN)6]可缓解重金属中毒,x=_______ ;该物质中不存在的作用力有_____ 。
A.范德华力 B.离子键 C.σ键 D.π键 E.氢键
(5)副族元素钴的氧化物可以在室温下完全氧化甲醛(HCHO)。甲醛分子的立体构型为_____ ;甲醛常温下为气体而甲醇(CH3OH)为液体的原因是________________________________ 。
(6)副族元素Mn和元素Se形成的某化合物属于立方晶系,其晶胞结构如图所示,其中(○为Se, 为Mn),该化合物的化学式为
为Mn),该化合物的化学式为________ ,Se的配位数为______ ,Mn和Se的摩尔质量分别为M1g/mol、M2g/mol,该晶体的密度为ρg/cm3,则Mn—Se键的键长为_____________ nm(计算表达式)。

 合成的新型三元催化剂[La0.8Cu0.2Ni1-xMxO3(M 分别为Mn、Fe和Co)]可以使汽车尾气中NO和CO发生反应而减少尾气污染,同时可大大降低重金属的用量。回答下列问题:
合成的新型三元催化剂[La0.8Cu0.2Ni1-xMxO3(M 分别为Mn、Fe和Co)]可以使汽车尾气中NO和CO发生反应而减少尾气污染,同时可大大降低重金属的用量。回答下列问题:(1)Mn2+的核外电子排布式为:
(2)C、N、O、Mn电负性由大到小的顺序是
(3)
 也是常见配体,其中采取sp2杂化的碳原子和sp3杂化的碳原子个数比为
也是常见配体,其中采取sp2杂化的碳原子和sp3杂化的碳原子个数比为(4)蓝色物质KFe(Ⅲ)x[Fe(Ⅱ)(CN)6]可缓解重金属中毒,x=
A.范德华力 B.离子键 C.σ键 D.π键 E.氢键
(5)副族元素钴的氧化物可以在室温下完全氧化甲醛(HCHO)。甲醛分子的立体构型为
(6)副族元素Mn和元素Se形成的某化合物属于立方晶系,其晶胞结构如图所示,其中(○为Se,
 为Mn),该化合物的化学式为
为Mn),该化合物的化学式为
您最近一年使用:0次
2018-01-11更新
|
659次组卷
|
4卷引用:四川省广安市眉山市2018届高三第一次诊断性考试理综化学试题
8 . 我国化学家在“铁基(氟掺杂镨氧铁砷化合物)高温超导”材料研究上取得了重要成果,该研究项目荣获2013年度“国家自然科学奖”一等奖。
(1)基态砷原子的价电子排布式为____ 。
(2)氟、氧、砷三种元素的电负性由大到小的顺序是____ (用相应的元素符号填空)。
(3)Fe(SCN)3溶液中加入NH4F,发生如下反:Fe(SCN)3+6NH4F=== (NH4)3FeF6+3NH4SCN
①NH4F 中阳离子的立体构型为____ 。
②(NH4)3FeF6存在的微粒间作用力有__ (选填序号,下同)。
a.离子键 b.共价键 c.金属键 d.配位键 e.范德华力 f.氢键
③已知SCN−中各原子最外层均满足8电子稳定结构,则C原子的杂化方式为____ ,该原子团中σ与π键个数比为____ 。
(4)FeCl3晶体易溶于水、乙醇,受热易气化,而FeF3晶体熔点高于1000oC,试解释两种化合物熔点差异较大的原因:____ 。
(5)S和Fe形成的某化合物,其晶胞如图所示,则该物质的化学式为___ 。设该晶胞的密度为ρ g/cm3,用NA表示阿伏伽德罗常数,则该晶胞中距离最近的S原子之间的距离为(列出计算式即可)____ cm。

(1)基态砷原子的价电子排布式为
(2)氟、氧、砷三种元素的电负性由大到小的顺序是
(3)Fe(SCN)3溶液中加入NH4F,发生如下反:Fe(SCN)3+6NH4F=== (NH4)3FeF6+3NH4SCN
①NH4F 中阳离子的立体构型为
②(NH4)3FeF6存在的微粒间作用力有
a.离子键 b.共价键 c.金属键 d.配位键 e.范德华力 f.氢键
③已知SCN−中各原子最外层均满足8电子稳定结构,则C原子的杂化方式为
(4)FeCl3晶体易溶于水、乙醇,受热易气化,而FeF3晶体熔点高于1000oC,试解释两种化合物熔点差异较大的原因:
(5)S和Fe形成的某化合物,其晶胞如图所示,则该物质的化学式为

您最近一年使用:0次
解题方法
9 . 【化学——选修3:物质结构与性质】氮化硼(BN)是一种重要的功能陶瓷材料。以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如下图所示:

请回答下列问题:
(1)由B2O3制备BF3、BN的化学方程式依次是_____________ 、____________________ ;
(2)基态B原子的电子排布式为_________ ;B和N相比,电负性较大的是_________ ,BN中B元素的化合价为_________ ;
(3)在BF3分子中,F-B-F的键角是_______ ,B原子的杂化轨道类型为_______ ,BF3和过量NaF作用可生成NaBF4,BF4-的立体结构为_______ ;
(4)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为________ ,层间作用力为________ ;
(5)六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm,立方氮化硼的密度是_______ g·cm-3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。

请回答下列问题:
(1)由B2O3制备BF3、BN的化学方程式依次是
(2)基态B原子的电子排布式为
(3)在BF3分子中,F-B-F的键角是
(4)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为
(5)六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm,立方氮化硼的密度是
您最近一年使用:0次
名校
10 . 晶体硅是制备太阳能电池板的主要原料,电池板中还含有硼、氮、钛、钻、钙等多种化学物质。
请回答下列问题:
1.第二周期元素的电负性按由小到大的顺序排列,B元素排在第__________ 位。
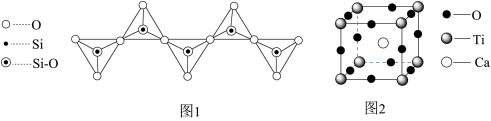
2.硅酸根有多种结构形式,一种无限长链状结构如图1所示,其化学式为____________ ,Si原子的杂化类型为__________________ 。
3.N元素位于元素周期表_____________ 区;基态N原子中,核外电子占据最高能级的电子云有____ 个伸展方向。
4. [Co(NH3)6]3+的几何构型为正八面体形,Co在中心。
①[Co(NH3)6]3+中,1个Co提供_______________ 个空轨道。
②若将[Co(NH3)6]3+中的两个NH3分子换成两个Cl-,可以形成_________ 种不同的结构形式。
5.—种由Ca、Ti、O三种元素形成的晶体的立方晶胞结构如图2所示。
①与Ti紧邻的Ca有___________________ 个。
②若Ca与O之间的最短距离为α pm,阿伏伽德罗常数的值为NA,则晶体的密度ρ=__________________ g· cm-3(用含α、NA的代数式表示)。
请回答下列问题:
1.第二周期元素的电负性按由小到大的顺序排列,B元素排在第
2.硅酸根有多种结构形式,一种无限长链状结构如图1所示,其化学式为
3.N元素位于元素周期表
4. [Co(NH3)6]3+的几何构型为正八面体形,Co在中心。
①[Co(NH3)6]3+中,1个Co提供
②若将[Co(NH3)6]3+中的两个NH3分子换成两个Cl-,可以形成
5.—种由Ca、Ti、O三种元素形成的晶体的立方晶胞结构如图2所示。
①与Ti紧邻的Ca有
②若Ca与O之间的最短距离为α pm,阿伏伽德罗常数的值为NA,则晶体的密度ρ=
您最近一年使用:0次
2018-01-08更新
|
379次组卷
|
2卷引用:江苏省溧水高级中学2017-2018学年高二下学期期末考试(选修)化学试题



