[化学一选修3:物质结构与性质]
金属材料在国民经济建设等领域具有重要应用,镁、镍、铜是几种重要的金属元素,请回答下列问题:
(1)镍元素的核电荷数为28,则原子基态电子排布式为________ ,结构中有 ___ 种不同形状的电子云。
(2)MgO的熔点高于CuO的原因是__________________________
(3)Mg元素的第一电离能反常地高于同周期后一种元素,原因是_____________________
(4)Ni与CO能形成配合物Ni(CO)4,该分子中σ键与π键个数比为_____________________
(5)配合物[Cu(CH3C≡N)4]BF4中碳原子杂化轨道类型为______ ,BF4-的空间构型为_________________ 。
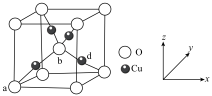
(6)铜与氧元素可形成如图所示的晶胞结构,其中Cu均匀地分散在立方体内部,a、b的坐标参数依次为(0,0,0)、(1/2,1/2,1/2),则d的坐标参数为____________ ,已知该晶体的密度为ρg/cm3,NA是阿伏伽德罗常数值,则晶胞参数为 _______________ cm(列出计算式即可)。
金属材料在国民经济建设等领域具有重要应用,镁、镍、铜是几种重要的金属元素,请回答下列问题:
(1)镍元素的核电荷数为28,则原子基态电子排布式为
(2)MgO的熔点高于CuO的原因是
(3)Mg元素的第一电离能反常地高于同周期后一种元素,原因是
(4)Ni与CO能形成配合物Ni(CO)4,该分子中σ键与π键个数比为
(5)配合物[Cu(CH3C≡N)4]BF4中碳原子杂化轨道类型为
(6)铜与氧元素可形成如图所示的晶胞结构,其中Cu均匀地分散在立方体内部,a、b的坐标参数依次为(0,0,0)、(1/2,1/2,1/2),则d的坐标参数为

更新时间:2018-01-12 14:54:22
|
相似题推荐
解答题-无机推断题
|
适中
(0.65)
【推荐1】A、B、C、D、E是原子序数依次增大 的五种短周期元素,F为第四周期元素。请根据下列相关信息回答问题。
(1)C的核外电子排布式是_______ 。
(2)F位于元素周期表第_______ 族,属于_______ 区。
(3)A、E的最高价氧化物对应的水化物酸性更强的是_______ (填化学式)。
(4)B、C和E元素的电负性由大到小的顺序是_______ (填元素符号)。
(5)常温常压下A的氢化物极易溶于水,从微粒间相互作用的角度分析原因:_______ (写出两条)。
(6)从原子结构的角度解释元素D的第一电离能高于同周期相邻元素的原因:_______ 。
| 元素 | 相关信息 |
| A | 基态原子的p轨道处于半充满状态 |
| B | 原子核外s能级上的电子总数与p能级上的电子总数相等,第一电离能低于同周期相邻元素 |
| C | 在同周期元素中,原子半径最大、电负性最小 |
| D | 电离能/(kJ•mol-1)数据:I1=740;I2=1500;I3=7700;I4=10500…… |
| E | 其价电子中,在不同形状的原子轨道中运动的电子数相等 |
| F | 在周期表的第7纵列 |
(2)F位于元素周期表第
(3)A、E的最高价氧化物对应的水化物酸性更强的是
(4)B、C和E元素的电负性由大到小的顺序是
(5)常温常压下A的氢化物极易溶于水,从微粒间相互作用的角度分析原因:
(6)从原子结构的角度解释元素D的第一电离能高于同周期相邻元素的原因:
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐2】已知A、B、C、D、E是中学化学常见的几种元素,原子序数依次增大。
其结构或性质信息如下表所示:
(1)A元素位于___________ 区,A、B、C三种元素原子第一电离能由大到小顺序为:___________ (用元素符号填空);
(2)B、C、D三种元素原子电负性由大到小顺序为:___________ (用元素符号填空); 分子的空间构型:
分子的空间构型:___________ ;
(3)化合物EC、ED其化学键的离子键百分数较大的化合物为:___________ 。(用化学式填空)
其结构或性质信息如下表所示:
| 元素 | 结构或者信息 |
| A | 基态A原子p能级上有两个未成对电子 |
| B | 基态B原子中有7个运动状态不同的电子 |
| C | C元素是地壳中含量最高的元素 |
| D | 基态D的价层电子排布是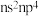 |
| E | 基态E原子次外层全充满,最外层电子数为1 |
(2)B、C、D三种元素原子电负性由大到小顺序为:
 分子的空间构型:
分子的空间构型:(3)化合物EC、ED其化学键的离子键百分数较大的化合物为:
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】镁、钙、钾、溴、氟、硼等元素在每升海水中的含量都大于1 mg ,属于海水中的常量元素。
⑴镓与硼同主族,写出镓元素原子的价电子排布式_____________________ 。
⑵钾、钙、镓的第一电离能从大到小的顺序是_____________ 。
⑶比较氟化钠和溴化钠的熔点:氟化钠_______ 溴化钠(填“<”或“>”),分析其原因是______________ 。
⑷举出两例说明锂与镁具有相似性:①________________ 、②______________ ,这种相似性称为__________________ 。
⑸用价层电子对互斥理论推断BF3空间构型为______________ ,NF3分子中N原子的杂化轨道类型为_________ ;在NH3·BF3中接受孤对电子的原子是_________ 。
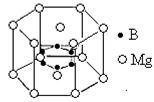
⑹2001年曾报道,硼镁化合物刷新了金属化合物超导温度的最高记录。该化合晶体结构中的晶胞如上图所示。镁原子间形成正六棱柱,且棱柱的上下底面还各有一个镁原子,六个硼原子位于棱柱内。则该化合物的化学式可表示为_______ 。
⑴镓与硼同主族,写出镓元素原子的价电子排布式
⑵钾、钙、镓的第一电离能从大到小的顺序是
⑶比较氟化钠和溴化钠的熔点:氟化钠
⑷举出两例说明锂与镁具有相似性:①
⑸用价层电子对互斥理论推断BF3空间构型为

⑹2001年曾报道,硼镁化合物刷新了金属化合物超导温度的最高记录。该化合晶体结构中的晶胞如上图所示。镁原子间形成正六棱柱,且棱柱的上下底面还各有一个镁原子,六个硼原子位于棱柱内。则该化合物的化学式可表示为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】离子液体是一种全部由离子组成的液体,它具有独特的性能,被广泛应用于化学研究的各个领域中。某离子液体由如图所示正离子和负离子构成。
(1)正离子中各元素的电负性由小到大的顺序为_____ (用元素符号表示);正离子中C原子的杂化方式为______ 。
(2)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用+ 表示,与之相反的用-
表示,与之相反的用- 表示,称为电子的自旋磁量子数。对于基态的N原子,其电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态的N原子,其电子自旋磁量子数的代数和为_____ 或_____ 。
(3)正离子中存在的作用力有_____ (填标号)。
a.极性共价键 b.非极性共价键 c.氢键 d.离子键
(4)基态Cl原子的价层电子的轨道表示式为_____ 。
(5)负离子的空间结构为_____ 形。
(6)分子中的大π键可用符号π 表示,其中m代表形成大π键的原子数,n代表形成大π键的电子数,如苯(
表示,其中m代表形成大π键的原子数,n代表形成大π键的电子数,如苯(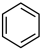 )中的大π键可表示为π
)中的大π键可表示为π 。则正离子中的大π键可表示为
。则正离子中的大π键可表示为_____ 。
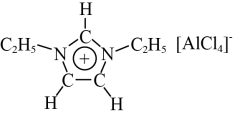
(1)正离子中各元素的电负性由小到大的顺序为
(2)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用+
 表示,与之相反的用-
表示,与之相反的用- 表示,称为电子的自旋磁量子数。对于基态的N原子,其电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态的N原子,其电子自旋磁量子数的代数和为(3)正离子中存在的作用力有
a.极性共价键 b.非极性共价键 c.氢键 d.离子键
(4)基态Cl原子的价层电子的轨道表示式为
(5)负离子的空间结构为
(6)分子中的大π键可用符号π
 表示,其中m代表形成大π键的原子数,n代表形成大π键的电子数,如苯(
表示,其中m代表形成大π键的原子数,n代表形成大π键的电子数,如苯( )中的大π键可表示为π
)中的大π键可表示为π 。则正离子中的大π键可表示为
。则正离子中的大π键可表示为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、 D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是____________ (填元素符号)。
(2)单质A有两种同素异形体,其中沸点高的是______ (填分子式),原因是___________ ;A和B的氢化物所属的晶体类型分别为______________ 和____________________ 。
(3)C和D反应可生成组成比为1:3的化合物E, E的立体构型为__________ ,中心原子的杂化轨道类型为_____________ 。
(4)化合物D2A的立体构型为_________________ ,中心原子的价层电子对数为_________________
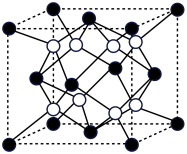
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数,a= 0.566nm, F 的化学式为_____________ :晶胞中A 原子的配位数为__________ ;列式计算晶体F的密度(g.cm-3)____________ 。
(1)四种元素中电负性最大的是
(2)单质A有两种同素异形体,其中沸点高的是
(3)C和D反应可生成组成比为1:3的化合物E, E的立体构型为
(4)化合物D2A的立体构型为
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数,a= 0.566nm, F 的化学式为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】回答下列问题:
(1)某二价金属离子有9个价电子,价电子的能级为3d。该元素位于周期表中的第四周期、第_______ 族。
(2)在氰酸钾(KOCN)的组成元素中,第一电离能最大的是________ (填元素符号、下同)、电负性最小的是__________ ;其中阴离子的空间结构是_________ ,C的杂化方式为_______ 。
(3)乙二胺能与Mg2+离子形成稳定环状离子:[Mg(C2H8N2)2]2+,其结构如图所示:
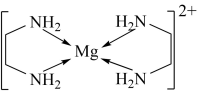
则该环状离子中镁离子的配位数为________ 。
(4)金属A的原子只有3个电子层,其第一至第四电离能如下:
则A原子的价电子排布式为________ 。
(5)用锌还原TiCl4的盐酸溶液,经后续处理可制得绿色的晶体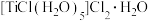 。1mol该配合物中含有
。1mol该配合物中含有 键数目为
键数目为_____ 。
(1)某二价金属离子有9个价电子,价电子的能级为3d。该元素位于周期表中的第四周期、第
(2)在氰酸钾(KOCN)的组成元素中,第一电离能最大的是
(3)乙二胺能与Mg2+离子形成稳定环状离子:[Mg(C2H8N2)2]2+,其结构如图所示:

则该环状离子中镁离子的配位数为
(4)金属A的原子只有3个电子层,其第一至第四电离能如下:
| 电离能(kJ/mol) |  | 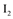 |  |  |
| A | 932 | 1821 | 15390 | 21771 |
则A原子的价电子排布式为
(5)用锌还原TiCl4的盐酸溶液,经后续处理可制得绿色的晶体
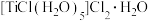 。1mol该配合物中含有
。1mol该配合物中含有 键数目为
键数目为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】含Ti化合物在工业生产中有着重要用途。TiCl3是烯烃定向聚合的催化剂、TiCl4可用于制备金属Ti。
nCH3CH=CH2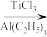

TiCl4+2Mg Ti+2MgCl2
Ti+2MgCl2
TiO2+2C+2Cl2 TiCl4+2CO
TiCl4+2CO
(1)Ti3+的基态核外电子排布式为__________ ;
(2)丙烯分子中,碳原子轨道杂化类型为__________ ;
(3)Mg、Al、Cl第一电离能由大到小的顺序是___________ ;
(4)写出一种由第2周期元素组成且与CO互为等电子体的阴离子的电子式____ ;
(5)TiCl3浓溶液中加入无水乙醚,并通入HCl至饱和,在乙醚层得到绿色的异构体,分别是[Ti(H2O)6]Cl3、[Ti(H2O)5Cl]Cl2·H2O。1mol[Ti(H2O)6]Cl3中含有σ键的数目为______ ;
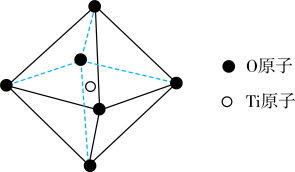
(6)钛酸锶具有超导性、热敏性等优点,该晶体的晶胞中Sr位于晶胞的顶点,O位于晶胞的面心,Ti原子填充在O原子构成的正八面体空隙的中心位置(如图),据此推测,钛酸锶的化学式为_________ 。
nCH3CH=CH2
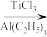

TiCl4+2Mg
 Ti+2MgCl2
Ti+2MgCl2TiO2+2C+2Cl2
 TiCl4+2CO
TiCl4+2CO(1)Ti3+的基态核外电子排布式为
(2)丙烯分子中,碳原子轨道杂化类型为
(3)Mg、Al、Cl第一电离能由大到小的顺序是
(4)写出一种由第2周期元素组成且与CO互为等电子体的阴离子的电子式
(5)TiCl3浓溶液中加入无水乙醚,并通入HCl至饱和,在乙醚层得到绿色的异构体,分别是[Ti(H2O)6]Cl3、[Ti(H2O)5Cl]Cl2·H2O。1mol[Ti(H2O)6]Cl3中含有σ键的数目为
(6)钛酸锶具有超导性、热敏性等优点,该晶体的晶胞中Sr位于晶胞的顶点,O位于晶胞的面心,Ti原子填充在O原子构成的正八面体空隙的中心位置(如图),据此推测,钛酸锶的化学式为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】卤素可形成许多结构和性质特殊的化合物。回答下列问题:
(1)-40 ℃时,F2与冰反应生成HOF和HF.常温常压下,HOF为无色气体,固态HOF的晶体类型为___________ ,HOF水解反应的产物为___________ (填化学式)。
(2)ClO2中心原子为Cl,Cl2O中心原子为O,二者均为V形结构,但ClO2中存在大π键_______________________________ ;O—Cl—O键角___________ Cl—O—Cl键角(填“>”“<”或“=”)。比较ClO2与Cl2O中Cl—O键的键长并说明原因___________ 。
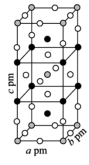
(3)一定条件下,CuCl2、K和F2反应生成KCl和化合物X。已知X属于四方晶系,晶胞结构如图所示(晶胞参数a=b≠c,α=β=γ=90°),其中Cu化合价为+2.上述反应的化学方程式为___________ 。 若阿伏加德罗常数的值为NA,化合物X的密度ρ=___________ g·cm-3(用含NA的代数式表示)。
(1)-40 ℃时,F2与冰反应生成HOF和HF.常温常压下,HOF为无色气体,固态HOF的晶体类型为
(2)ClO2中心原子为Cl,Cl2O中心原子为O,二者均为V形结构,但ClO2中存在大π键
(3)一定条件下,CuCl2、K和F2反应生成KCl和化合物X。已知X属于四方晶系,晶胞结构如图所示(晶胞参数a=b≠c,α=β=γ=90°),其中Cu化合价为+2.上述反应的化学方程式为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】如图所示是金刚石的晶胞结构,除顶点和面心上有碳原子外,体内还有4个碳原子。回答下列问题: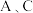 的分数坐标分别为
的分数坐标分别为 ,则原子
,则原子 的分数坐标为
的分数坐标为___________ 。若金刚石的晶胞参数为 ,则碳原子的半径约为
,则碳原子的半径约为___________  (用含
(用含 的代数式表示)。
的代数式表示)。
(2)立方氮化硼结构和硬度都与金刚石相似,但熔点比金刚石低,原因是___________ ;下图是立方氮化硼晶胞沿 轴的投影图,请在图中圆球上涂“●”和画“
轴的投影图,请在图中圆球上涂“●”和画“ ”分别标明
”分别标明 与
与 的相对位置
的相对位置___________ ;硼原子周围等距且最近的硼原子数为___________ ; 原子的杂化方式为
原子的杂化方式为___________ 。设 为阿伏加德罗常数的值,若立方氮化硼的晶体密度为
为阿伏加德罗常数的值,若立方氮化硼的晶体密度为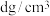 ,则晶胞参数a=
,则晶胞参数a=___________ nm。

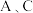 的分数坐标分别为
的分数坐标分别为 ,则原子
,则原子 的分数坐标为
的分数坐标为 ,则碳原子的半径约为
,则碳原子的半径约为 (用含
(用含 的代数式表示)。
的代数式表示)。(2)立方氮化硼结构和硬度都与金刚石相似,但熔点比金刚石低,原因是
 轴的投影图,请在图中圆球上涂“●”和画“
轴的投影图,请在图中圆球上涂“●”和画“ ”分别标明
”分别标明 与
与 的相对位置
的相对位置 原子的杂化方式为
原子的杂化方式为 为阿伏加德罗常数的值,若立方氮化硼的晶体密度为
为阿伏加德罗常数的值,若立方氮化硼的晶体密度为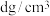 ,则晶胞参数a=
,则晶胞参数a=
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐1】金属钛性能优越,被誉为继Fe、Al后应用广泛的“第三金属”。
(1)写出Ti基态原子的电子排布_________________ 。
(2)钛能与B、C、N、O等非金属元素形成稳定的化合物。则电负性C___ B(选填“>”“<”),第一电离能N>O,原因是___________ 。
(3)月球岩石玄武岩的主要成分为钛酸亚铁(FeTiO3)。FeTiO3与80%的硫酸反应可生成TiOSO4。SO42-的空间构型为_____ ,其中硫原子采用_____ 杂化,氧原子的价电子排布图为_______ ,任意写出一种SO42-等电子体_____ 。
(4)将TiOSO4的稀溶液加热水解后,经进一步反应,可得到钛的某种氧化物。该氧化物的晶胞结构图如图所示。
则该氧化物的化学式_______ (图中钛原子用“O”表示。氧原子用“O”表示)
(1)写出Ti基态原子的电子排布
(2)钛能与B、C、N、O等非金属元素形成稳定的化合物。则电负性C
(3)月球岩石玄武岩的主要成分为钛酸亚铁(FeTiO3)。FeTiO3与80%的硫酸反应可生成TiOSO4。SO42-的空间构型为
(4)将TiOSO4的稀溶液加热水解后,经进一步反应,可得到钛的某种氧化物。该氧化物的晶胞结构图如图所示。

则该氧化物的化学式
您最近一年使用:0次
【推荐2】硼、铝及其化合物在生产、生活和科研中应用广泛。回答下列问题:
(1)基态B原子核外电子有___________ 种空间运动状态。
(2)AIF3、AlCl3、AlBr3沸点由高到低的顺序为___________ ,BF3、BCl3、BBr3的热稳定性由强到弱的顺序为___________ 。
(3)下列物质均与BCl3发生配位反应,其中形成N-B键最强的是___________ 。
A.(C2H5)3N B.NH3 C.NCl3
(4)氮化硼(BN)有立方氮化硼和六方氮化硼两种结构。
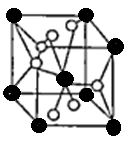
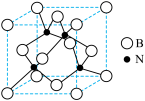
①立方氮化硼晶胞如图,N与B原子的配位数之比为___________ 。已知N-B的键长为anm,则该晶胞的晶胞参数为___________ nm。
②六方氮化硼又称“白石墨”,结构与石墨相似,氮硼交替形成层状结构,与石墨的导电能力不同,是优良的绝缘体,原因是___________ 。
(1)基态B原子核外电子有
(2)AIF3、AlCl3、AlBr3沸点由高到低的顺序为
(3)下列物质均与BCl3发生配位反应,其中形成N-B键最强的是
A.(C2H5)3N B.NH3 C.NCl3
(4)氮化硼(BN)有立方氮化硼和六方氮化硼两种结构。
①立方氮化硼晶胞如图,N与B原子的配位数之比为

②六方氮化硼又称“白石墨”,结构与石墨相似,氮硼交替形成层状结构,与石墨的导电能力不同,是优良的绝缘体,原因是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】青蒿素是从黄花蒿中提取的一种无色针状晶体,其结构如图1,请回答下列问题:

(1)基态O原子的价电子排布图为___ 。
(2)组成青蒿素的三种元素中电负性最大的是__ (填元素符号,下同),第一电离能最大的是__ 。
(3)基态N原子的未成对电子数为___ 。
(4)双氢青蒿素是青蒿素的重要衍生物,其抗疟疾疗效优于青蒿素,双氢青蒿素的合成一般是在相转移催化剂聚乙二醇的作用下,用硼氢化钠(NaBH4)还原青蒿素。两种硼氢化物的合成原理如下:
2LiH+B2H6=2LiBH4;4NaH+BF3=NaBH4+3NaF
BH4-的空间构型为__ ;B2H6分子的结构如图2,B2H6中B的杂化方式为__ 。
聚乙二醇[HO(CH2CH2O)nH]随着n值的增大,水溶性降低,原因是___ 。
(5)NaH的晶胞与NaCl相同,NaH晶体中阳离子的配位数是__ ;设晶胞中阴、阳离子为刚性球体且恰好相切,阴、阳离子的半径比约为__ (已知 ≈1.414,结果保留三位有效数字)。
≈1.414,结果保留三位有效数字)。

(1)基态O原子的价电子排布图为
(2)组成青蒿素的三种元素中电负性最大的是
(3)基态N原子的未成对电子数为
(4)双氢青蒿素是青蒿素的重要衍生物,其抗疟疾疗效优于青蒿素,双氢青蒿素的合成一般是在相转移催化剂聚乙二醇的作用下,用硼氢化钠(NaBH4)还原青蒿素。两种硼氢化物的合成原理如下:
2LiH+B2H6=2LiBH4;4NaH+BF3=NaBH4+3NaF
BH4-的空间构型为
聚乙二醇[HO(CH2CH2O)nH]随着n值的增大,水溶性降低,原因是
(5)NaH的晶胞与NaCl相同,NaH晶体中阳离子的配位数是
 ≈1.414,结果保留三位有效数字)。
≈1.414,结果保留三位有效数字)。
您最近一年使用:0次



