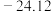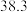名校
1 . 铜是人类最早使用的金属之一,用黄铜矿(主要成分为 )生产粗铜的反应原理如下:
)生产粗铜的反应原理如下:
(1)第三周期主族元素中电负性比 小的元素有
小的元素有___________ 种, 的沸点比
的沸点比 的
的___________ (填“高”或“低”),原因是___________ 。
(2) 和
和 均为
均为___________ 晶体, 的熔点为
的熔点为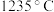 ,
, 的熔点为
的熔点为 ,
, 熔点较高的原因是
熔点较高的原因是___________ 。
(3)铜的两种氧化物的晶胞如图1、图2所示,图1表示___________ 填化学式),图2中,A原子坐标参数为(0,0,0),B原子为 ,则C原子的坐标参数为
,则C原子的坐标参数为___________ 。
 )生产粗铜的反应原理如下:
)生产粗铜的反应原理如下: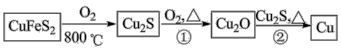
(1)第三周期主族元素中电负性比
 小的元素有
小的元素有 的沸点比
的沸点比 的
的(2)
 和
和 均为
均为 的熔点为
的熔点为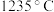 ,
, 的熔点为
的熔点为 ,
, 熔点较高的原因是
熔点较高的原因是(3)铜的两种氧化物的晶胞如图1、图2所示,图1表示
 ,则C原子的坐标参数为
,则C原子的坐标参数为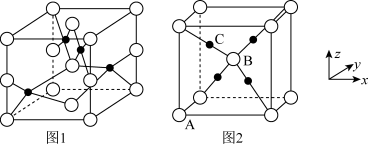
您最近半年使用:0次
2 . 根据已学知识,请回答下列问题:
(1)基态N原子中,核外电子占据的最高能层的符号是L,占据该能层电子的原子轨道形状为_______ 。
(2)写出3p轨道上有2个未成对电子的元素的符号:_______ 。
(3)已知铬是24号元素,画出Cr的价层电子排布图:_______ 。
(4)从原子结构的角度分析B、N和O的第一电离能由大到小的顺序为_______ ,电负性由大到小的顺序是_______ 。
(5)Zn2+的核外电子排布式为_______ 。
(1)基态N原子中,核外电子占据的最高能层的符号是L,占据该能层电子的原子轨道形状为
(2)写出3p轨道上有2个未成对电子的元素的符号:
(3)已知铬是24号元素,画出Cr的价层电子排布图:
(4)从原子结构的角度分析B、N和O的第一电离能由大到小的顺序为
(5)Zn2+的核外电子排布式为
您最近半年使用:0次
3 . 回答下列问题:
(1)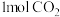 中含有的
中含有的 键数目为
键数目为___________ , 键数目为
键数目为___________ 。
(2)已知CO和 与
与 结构相似,CO分子内
结构相似,CO分子内 键与
键与 键个数之比为
键个数之比为___________ 。 分子中
分子中 键与
键与 键数目之比为
键数目之比为___________ 。
(3)肼 分子可视为
分子可视为 分子中的一个氢原子被
分子中的一个氢原子被 (氨基)取代形成的另一种氮的氢化物。肼可用作火箭燃料,燃烧时发生的反应:
(氨基)取代形成的另一种氮的氢化物。肼可用作火箭燃料,燃烧时发生的反应:
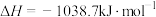 ,若该反应中有
,若该反应中有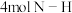 键断裂,则形成的
键断裂,则形成的 键有
键有___________ mol。
(4)Co基态原子核外电子排布式为___________ ; 的价电子轨道表示式为
的价电子轨道表示式为___________ ; 核外电子未成对电子数为
核外电子未成对电子数为___________ 。
(5) 、
、 、
、 、
、 分子中共价键的极性由强到弱的顺序是
分子中共价键的极性由强到弱的顺序是___________ 。
(1)
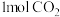 中含有的
中含有的 键数目为
键数目为 键数目为
键数目为(2)已知CO和
 与
与 结构相似,CO分子内
结构相似,CO分子内 键与
键与 键个数之比为
键个数之比为 分子中
分子中 键与
键与 键数目之比为
键数目之比为(3)肼
 分子可视为
分子可视为 分子中的一个氢原子被
分子中的一个氢原子被 (氨基)取代形成的另一种氮的氢化物。肼可用作火箭燃料,燃烧时发生的反应:
(氨基)取代形成的另一种氮的氢化物。肼可用作火箭燃料,燃烧时发生的反应:
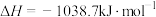 ,若该反应中有
,若该反应中有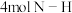 键断裂,则形成的
键断裂,则形成的 键有
键有(4)Co基态原子核外电子排布式为
 的价电子轨道表示式为
的价电子轨道表示式为 核外电子未成对电子数为
核外电子未成对电子数为(5)
 、
、 、
、 、
、 分子中共价键的极性由强到弱的顺序是
分子中共价键的极性由强到弱的顺序是
您最近半年使用:0次
4 . 完成下列问题。
(1)《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。Zn、C、O电负性由大至小的顺序是___________
(2)①基态Cu原子有___________ 种不同能级的电子。位于在周期表___________ 区(填s、p、d或ds)。Cu+的价电子排布式为___________ 。
②N原子中最高能级的电子的电子云轮廓图为___________ 。
③在空气中FeO稳定性小于Fe2O3,从电子排布的角度分析,其主要原因是___________ 。
(3)由于Be与Al处于对角线位置,性质具有相似性,根据“对角线规则”,写出Be(OH)2与NaOH反应的化学方程式:___________ 。
(4)高锰酸钾是一种重要的化学试剂,实验室常常利用高锰酸钾溶液测定草酸晶体(H2C2O4·xH2O)中 的值,高锰酸钾溶液需用
的值,高锰酸钾溶液需用___________ 盛装(填 酸式滴定管 或 碱式滴定管)滴定终点溶液的判断是___________ 颜色变化为由无色变为浅红色。
(1)《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。Zn、C、O电负性由大至小的顺序是
(2)①基态Cu原子有
②N原子中最高能级的电子的电子云轮廓图为
③在空气中FeO稳定性小于Fe2O3,从电子排布的角度分析,其主要原因是
(3)由于Be与Al处于对角线位置,性质具有相似性,根据“对角线规则”,写出Be(OH)2与NaOH反应的化学方程式:
(4)高锰酸钾是一种重要的化学试剂,实验室常常利用高锰酸钾溶液测定草酸晶体(H2C2O4·xH2O)中
 的值,高锰酸钾溶液需用
的值,高锰酸钾溶液需用
您最近半年使用:0次
5 . 磷酸亚铁锂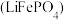 和锰酸锂
和锰酸锂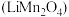 均可用作锂离子电池正极材料。回答下列问题:
均可用作锂离子电池正极材料。回答下列问题:
(1)基态O原子的价电子轨道表示式为___________ ;Mn的原子结构示意图为___________ 。
(2) 的熔、沸点
的熔、沸点___________ (填“高于”或“低于”) 。
。
(3) 分子中,与N原子相连的H呈正电性
分子中,与N原子相连的H呈正电性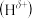 ,与B原子相连的H呈负电性
,与B原子相连的H呈负电性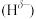 ,H、B、N电负性由小到大的顺序是
,H、B、N电负性由小到大的顺序是___________ 。
(4)已知: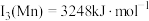 ,
,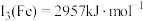 。Mn的第三电离能大于Fe的第三电离能,其主要原因是
。Mn的第三电离能大于Fe的第三电离能,其主要原因是___________ 。
(5)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种 配合物的结构如图所示,2mol该配合物中通过
配合物的结构如图所示,2mol该配合物中通过螯合作用 形成的配位键有___________ mol。
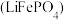 和锰酸锂
和锰酸锂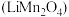 均可用作锂离子电池正极材料。回答下列问题:
均可用作锂离子电池正极材料。回答下列问题:(1)基态O原子的价电子轨道表示式为
(2)
 的熔、沸点
的熔、沸点 。
。(3)
 分子中,与N原子相连的H呈正电性
分子中,与N原子相连的H呈正电性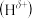 ,与B原子相连的H呈负电性
,与B原子相连的H呈负电性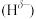 ,H、B、N电负性由小到大的顺序是
,H、B、N电负性由小到大的顺序是(4)已知:
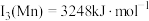 ,
,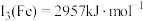 。Mn的第三电离能大于Fe的第三电离能,其主要原因是
。Mn的第三电离能大于Fe的第三电离能,其主要原因是(5)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种
 配合物的结构如图所示,2mol该配合物中通过
配合物的结构如图所示,2mol该配合物中通过
您最近半年使用:0次
名校
解题方法
6 .  (氨硼烷)具有很高的储氢容量及相对低的放氢温度(
(氨硼烷)具有很高的储氢容量及相对低的放氢温度( 350℃)而成为颇具潜力的化学储氢材料之一,它可通过环硼氨烷、
350℃)而成为颇具潜力的化学储氢材料之一,它可通过环硼氨烷、 与
与 进行合成。
进行合成。
1.上述涉及的元素H、B、C、N、O原子半径最大的是___________ ,电负性最大的是___________ 。
2.键角:
___________  (填“
(填“ ”“
”“ ”或“
”或“ ”),原因是
”),原因是___________ 。
 (氨硼烷)具有很高的储氢容量及相对低的放氢温度(
(氨硼烷)具有很高的储氢容量及相对低的放氢温度( 350℃)而成为颇具潜力的化学储氢材料之一,它可通过环硼氨烷、
350℃)而成为颇具潜力的化学储氢材料之一,它可通过环硼氨烷、 与
与 进行合成。
进行合成。1.上述涉及的元素H、B、C、N、O原子半径最大的是
2.键角:

 (填“
(填“ ”“
”“ ”或“
”或“ ”),原因是
”),原因是
您最近半年使用:0次
名校
解题方法
7 . 工业上高纯晶体硅时中间产物为SiHCl3,SiHCl3中电负性由大到小的顺序是___________ ,其中处于同一周期的两元素第一电离能大小关系为___________ 。
您最近半年使用:0次
名校
8 . 工业上以CO2和NH3为原料合成尿素,在尿素合成塔中的主要反应可表示如下:
反应Ⅰ:2NH3(g)+CO2(g) H2NCOONH4(s)(氨基甲酸铵) ΔH1=-272kJ·mol -1
H2NCOONH4(s)(氨基甲酸铵) ΔH1=-272kJ·mol -1
反应Ⅱ:H2NCOONH4(s) CO(NH2)2(s)+H2O(g) ΔH2=+138kJ·mol-1;
CO(NH2)2(s)+H2O(g) ΔH2=+138kJ·mol-1;
总反应Ⅲ:2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g) ∆H3
CO(NH2)2(s)+H2O(g) ∆H3
(1)反应Ⅰ的熵变ΔS___________  填“
填“ ”“
”“ ”或“
”或“ ”
” 。反应Ⅲ的
。反应Ⅲ的 H3=
H3=___________ ,反应Ⅲ自发进行的条件是___________ (填“低温”、“高温”、“任何温度”)。
(2)下列关于尿素合成的说法正确的是___________。
(3)1mol CO(NH2)2(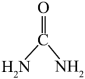 )中含有
)中含有___________ molπ键。NH 离子的VSEPR模型是
离子的VSEPR模型是___________ ,空间构型是___________ 。
(4)对于尿素分子中N、O两种基态原子,下列说法正确的是___________。
反应Ⅰ:2NH3(g)+CO2(g)
 H2NCOONH4(s)(氨基甲酸铵) ΔH1=-272kJ·mol -1
H2NCOONH4(s)(氨基甲酸铵) ΔH1=-272kJ·mol -1反应Ⅱ:H2NCOONH4(s)
 CO(NH2)2(s)+H2O(g) ΔH2=+138kJ·mol-1;
CO(NH2)2(s)+H2O(g) ΔH2=+138kJ·mol-1;总反应Ⅲ:2NH3(g)+CO2(g)
 CO(NH2)2(s)+H2O(g) ∆H3
CO(NH2)2(s)+H2O(g) ∆H3(1)反应Ⅰ的熵变ΔS
 填“
填“ ”“
”“ ”或“
”或“ ”
” 。反应Ⅲ的
。反应Ⅲ的 H3=
H3=(2)下列关于尿素合成的说法正确的是___________。
| A.及时分离出尿素可促使反应Ⅱ向正反应方向移动 |
| B.从合成塔出来的混合气体分离出水蒸气后其余气体可以循环使用 |
| C.保持容积不变,充入惰性气体增大压强,可提高总反应Ⅲ的反应速率 |
| D.保持压强不变,降低氨碳比[n(NH3)/n(CO2)]可提高反应Ⅰ中NH3的平衡转化率 |
 )中含有
)中含有 离子的VSEPR模型是
离子的VSEPR模型是(4)对于尿素分子中N、O两种基态原子,下列说法正确的是___________。
| A.N的半径较小 | B.N的未成对电子数较多 |
| C.N的电负性较大 | D.N的第一电离能较高 |
您最近半年使用:0次
名校
解题方法
9 . 已知: 与
与 在一定条件下可以发生如下反应,
在一定条件下可以发生如下反应,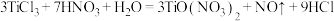 .回答下列问题:
.回答下列问题:
(1)基态钛原子的核外电子排布式为_____________ .
(2)N、H、O三种元素的电负性由大到小的顺序为_____________ .
(3)上述方程式中涉及的元素中属于P区元素的是_____________ (填元素符号).
(4) 的空间结构为
的空间结构为_____________ .
(5)肼 分子可视为
分子可视为 分子中的一个氢原子被
分子中的一个氢原子被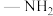 (氨基)取代形成的另一种氮的氢化物.肼可用作火箭燃料,燃烧时发生的反应如下:
(氨基)取代形成的另一种氮的氢化物.肼可用作火箭燃料,燃烧时发生的反应如下: .若该反应中有
.若该反应中有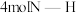 键断裂,则形成的
键断裂,则形成的 键有
键有_____________  .
.
(6)由C、H、N三种元素形成的一种有机物的结构简式如下,则该物质中N原子的杂化方式为_____________ ,C原子的杂化方式为_____________ .
 与
与 在一定条件下可以发生如下反应,
在一定条件下可以发生如下反应,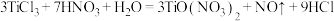 .回答下列问题:
.回答下列问题:(1)基态钛原子的核外电子排布式为
(2)N、H、O三种元素的电负性由大到小的顺序为
(3)上述方程式中涉及的元素中属于P区元素的是
(4)
 的空间结构为
的空间结构为(5)肼
 分子可视为
分子可视为 分子中的一个氢原子被
分子中的一个氢原子被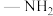 (氨基)取代形成的另一种氮的氢化物.肼可用作火箭燃料,燃烧时发生的反应如下:
(氨基)取代形成的另一种氮的氢化物.肼可用作火箭燃料,燃烧时发生的反应如下: .若该反应中有
.若该反应中有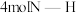 键断裂,则形成的
键断裂,则形成的 键有
键有 .
.(6)由C、H、N三种元素形成的一种有机物的结构简式如下,则该物质中N原子的杂化方式为
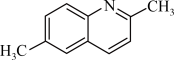
您最近半年使用:0次
名校
解题方法
10 . 钙钛矿( )型化合物是一类可用于生产太阳能电池、传感器、固体电阻器等的功能材料。回答下列问题:
)型化合物是一类可用于生产太阳能电池、传感器、固体电阻器等的功能材料。回答下列问题:
Ⅰ. 为制备
为制备 的一种原料。
的一种原料。
(1)Ti的四卤化物熔点如下表所示, 熔点高于其他三种卤化物,自
熔点高于其他三种卤化物,自 至
至 熔点依次升高,原因是
熔点依次升高,原因是______ 。
Ⅱ.一类有机一无机杂化材料 具有与
具有与 相同的晶体结构。
相同的晶体结构。
(2)①有机阳离子 中C原子和N原子的电负性大小比较:C
中C原子和N原子的电负性大小比较:C______ N(填“ ”、“
”、“ ”或“
”或“ ”),从原子结构的角度说明理由
”),从原子结构的角度说明理由______ 。
②若将晶胞中的A坐标定义为 ,B坐标定义为
,B坐标定义为 ,则离A最近的微粒的坐标为
,则离A最近的微粒的坐标为______ (任写其一)。若将晶胞中心微粒的坐标定义为 ,则与其紧邻的
,则与其紧邻的 的坐标为
的坐标为______ (任写其一)。 键角大小比较:
键角大小比较:
______  (填“
(填“ ”、“
”、“ ”或“
”或“ ”),原因是
”),原因是______ 。
(3) 晶体生长过程中容易产生晶体缺陷,造成
晶体生长过程中容易产生晶体缺陷,造成 空位。用
空位。用 替换
替换 可改善这种情况的可能原因是
可改善这种情况的可能原因是______ 。
 )型化合物是一类可用于生产太阳能电池、传感器、固体电阻器等的功能材料。回答下列问题:
)型化合物是一类可用于生产太阳能电池、传感器、固体电阻器等的功能材料。回答下列问题:Ⅰ.
 为制备
为制备 的一种原料。
的一种原料。(1)Ti的四卤化物熔点如下表所示,
 熔点高于其他三种卤化物,自
熔点高于其他三种卤化物,自 至
至 熔点依次升高,原因是
熔点依次升高,原因是化合物 |
|
|
|
|
熔点 | 377 |
|
| 155 |
Ⅱ.一类有机一无机杂化材料
 具有与
具有与 相同的晶体结构。
相同的晶体结构。(2)①有机阳离子
 中C原子和N原子的电负性大小比较:C
中C原子和N原子的电负性大小比较:C ”、“
”、“ ”或“
”或“ ”),从原子结构的角度说明理由
”),从原子结构的角度说明理由②若将晶胞中的A坐标定义为
 ,B坐标定义为
,B坐标定义为 ,则离A最近的微粒的坐标为
,则离A最近的微粒的坐标为 ,则与其紧邻的
,则与其紧邻的 的坐标为
的坐标为
 键角大小比较:
键角大小比较:
 (填“
(填“ ”、“
”、“ ”或“
”或“ ”),原因是
”),原因是(3)
 晶体生长过程中容易产生晶体缺陷,造成
晶体生长过程中容易产生晶体缺陷,造成 空位。用
空位。用 替换
替换 可改善这种情况的可能原因是
可改善这种情况的可能原因是
您最近半年使用:0次