名校
解题方法
1 .  (氨硼烷)具有很高的储氢容量及相对低的放氢温度(
(氨硼烷)具有很高的储氢容量及相对低的放氢温度( 350℃)而成为颇具潜力的化学储氢材料之一,它可通过环硼氨烷、
350℃)而成为颇具潜力的化学储氢材料之一,它可通过环硼氨烷、 与
与 进行合成。
进行合成。
1.上述涉及的元素H、B、C、N、O原子半径最大的是___________ ,电负性最大的是___________ 。
2.键角:
___________  (填“
(填“ ”“
”“ ”或“
”或“ ”),原因是
”),原因是___________ 。
 (氨硼烷)具有很高的储氢容量及相对低的放氢温度(
(氨硼烷)具有很高的储氢容量及相对低的放氢温度( 350℃)而成为颇具潜力的化学储氢材料之一,它可通过环硼氨烷、
350℃)而成为颇具潜力的化学储氢材料之一,它可通过环硼氨烷、 与
与 进行合成。
进行合成。1.上述涉及的元素H、B、C、N、O原子半径最大的是
2.键角:

 (填“
(填“ ”“
”“ ”或“
”或“ ”),原因是
”),原因是
您最近半年使用:0次
名校
解题方法
2 . 工业上高纯晶体硅时中间产物为SiHCl3,SiHCl3中电负性由大到小的顺序是___________ ,其中处于同一周期的两元素第一电离能大小关系为___________ 。
您最近半年使用:0次
名校
3 . 工业上以CO2和NH3为原料合成尿素,在尿素合成塔中的主要反应可表示如下:
反应Ⅰ:2NH3(g)+CO2(g) H2NCOONH4(s)(氨基甲酸铵) ΔH1=-272kJ·mol -1
H2NCOONH4(s)(氨基甲酸铵) ΔH1=-272kJ·mol -1
反应Ⅱ:H2NCOONH4(s) CO(NH2)2(s)+H2O(g) ΔH2=+138kJ·mol-1;
CO(NH2)2(s)+H2O(g) ΔH2=+138kJ·mol-1;
总反应Ⅲ:2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g) ∆H3
CO(NH2)2(s)+H2O(g) ∆H3
(1)反应Ⅰ的熵变ΔS___________  填“
填“ ”“
”“ ”或“
”或“ ”
” 。反应Ⅲ的
。反应Ⅲ的 H3=
H3=___________ ,反应Ⅲ自发进行的条件是___________ (填“低温”、“高温”、“任何温度”)。
(2)下列关于尿素合成的说法正确的是___________。
(3)1mol CO(NH2)2(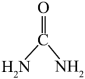 )中含有
)中含有___________ molπ键。NH 离子的VSEPR模型是
离子的VSEPR模型是___________ ,空间构型是___________ 。
(4)对于尿素分子中N、O两种基态原子,下列说法正确的是___________。
反应Ⅰ:2NH3(g)+CO2(g)
 H2NCOONH4(s)(氨基甲酸铵) ΔH1=-272kJ·mol -1
H2NCOONH4(s)(氨基甲酸铵) ΔH1=-272kJ·mol -1反应Ⅱ:H2NCOONH4(s)
 CO(NH2)2(s)+H2O(g) ΔH2=+138kJ·mol-1;
CO(NH2)2(s)+H2O(g) ΔH2=+138kJ·mol-1;总反应Ⅲ:2NH3(g)+CO2(g)
 CO(NH2)2(s)+H2O(g) ∆H3
CO(NH2)2(s)+H2O(g) ∆H3(1)反应Ⅰ的熵变ΔS
 填“
填“ ”“
”“ ”或“
”或“ ”
” 。反应Ⅲ的
。反应Ⅲ的 H3=
H3=(2)下列关于尿素合成的说法正确的是___________。
| A.及时分离出尿素可促使反应Ⅱ向正反应方向移动 |
| B.从合成塔出来的混合气体分离出水蒸气后其余气体可以循环使用 |
| C.保持容积不变,充入惰性气体增大压强,可提高总反应Ⅲ的反应速率 |
| D.保持压强不变,降低氨碳比[n(NH3)/n(CO2)]可提高反应Ⅰ中NH3的平衡转化率 |
 )中含有
)中含有 离子的VSEPR模型是
离子的VSEPR模型是(4)对于尿素分子中N、O两种基态原子,下列说法正确的是___________。
| A.N的半径较小 | B.N的未成对电子数较多 |
| C.N的电负性较大 | D.N的第一电离能较高 |
您最近半年使用:0次
4 . 某元素基态原子的电子排布式为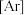
 。下列描述中,正确的是
。下列描述中,正确的是
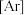
 。下列描述中,正确的是
。下列描述中,正确的是| A.该元素的电负性比溴元素的电负性大 |
| B.该元素位于元素周期表VA族 |
| C.4p能级上的3个电子能量相等,但自旋状态不同 |
| D.该元素的原子有5个价电子 |
您最近半年使用:0次
解题方法
5 . 钙钛矿是指通式为ABO3的一类化合物,最早发现钙钛矿石中的CaTiO3,因此而得名。钙钛矿型化合物可用于生产太阳能电池、传感器、固体电阻器等的功能材料。
1.基态 原子中未成对电子数为
原子中未成对电子数为___________ 。
2. 的四卤化物熔点如下表所示,
的四卤化物熔点如下表所示, 熔点高于其他三种卤化物,自
熔点高于其他三种卤化物,自 至
至 熔点依次升高,原因是
熔点依次升高,原因是___________ 。
 的立方晶胞如图1所示。
的立方晶胞如图1所示。___________ 。
4.金属离子与氧离子间的作用力为 。
5.晶胞中与 距离最近且相等的
距离最近且相等的 数目为 。
数目为 。
一种立方钙钛矿结构的金属卤化物光电材料的组成为Pb2+、I-和有机碱离子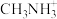 ,其晶胞如图2所示。
,其晶胞如图2所示。 具有相同的空间位置的微粒是 。
具有相同的空间位置的微粒是 。
7.有机碱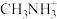 中,
中, 原子的杂化轨道类型是
原子的杂化轨道类型是___________ 。
8.若晶胞参数为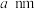 ,则晶体密度为
,则晶体密度为___________  (用
(用 表示阿伏加德罗常数)。
表示阿伏加德罗常数)。
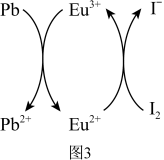
用上述金属卤化物光电材料制作的太阳能电池在使用过程中会产生单质铅和碘,降低了的器件效率和使用寿命。我国科学家巧妙地在此材料中引入稀土铕(Eu)盐,提升了太阳能电池的效率和使用寿命,其作用原理如图3所示。___________ 、___________ 。
1.基态
 原子中未成对电子数为
原子中未成对电子数为2.
 的四卤化物熔点如下表所示,
的四卤化物熔点如下表所示, 熔点高于其他三种卤化物,自
熔点高于其他三种卤化物,自 至
至 熔点依次升高,原因是
熔点依次升高,原因是| 化合物 |  |  |  |  |
熔点 | 377 | -24.12 | 38.3 | 155 |
 的立方晶胞如图1所示。
的立方晶胞如图1所示。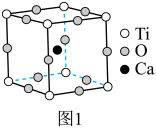
4.金属离子与氧离子间的作用力为 。
| A.离子键 | B.金属键 | C.共价键 | D.分子间作用力 |
 距离最近且相等的
距离最近且相等的 数目为 。
数目为 。| A.4 | B.8 | C.12 | D.16 |
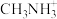 ,其晶胞如图2所示。
,其晶胞如图2所示。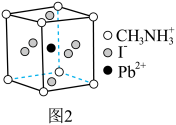
 具有相同的空间位置的微粒是 。
具有相同的空间位置的微粒是 。A. | B. | C. | D.无 |
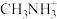 中,
中, 原子的杂化轨道类型是
原子的杂化轨道类型是8.若晶胞参数为
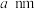 ,则晶体密度为
,则晶体密度为 (用
(用 表示阿伏加德罗常数)。
表示阿伏加德罗常数)。用上述金属卤化物光电材料制作的太阳能电池在使用过程中会产生单质铅和碘,降低了的器件效率和使用寿命。我国科学家巧妙地在此材料中引入稀土铕(Eu)盐,提升了太阳能电池的效率和使用寿命,其作用原理如图3所示。
您最近半年使用:0次
6 . ZnO和硫脲[CS(NH2)2]在一定条件可制备纳米ZnS(粒径8-15nm)。
(1)基态硫原子的价电子排布式为_____ 。
(2)金属Zn在元素周期表的_____ 。
A. s区 B. p区 C. ds区 D. f区
(3)下列说法中正确的是_____ 。
A. 电负性:S<N B. 第一电离能:Zn>S
C. 硫脲[CS(NH2)2]属于分子晶体 D. 硫脲[CS(NH2)2]中所有原子共面
(4)将该纳米ZnS均匀分散于水中,可利用_____ 将该分散系与NaCl溶液进行鉴别。
A. 渗析 B. 丁达尔现象 C. 萃取 D. 盐析
(1)基态硫原子的价电子排布式为
(2)金属Zn在元素周期表的
A. s区 B. p区 C. ds区 D. f区
(3)下列说法中正确的是
A. 电负性:S<N B. 第一电离能:Zn>S
C. 硫脲[CS(NH2)2]属于分子晶体 D. 硫脲[CS(NH2)2]中所有原子共面
(4)将该纳米ZnS均匀分散于水中,可利用
A. 渗析 B. 丁达尔现象 C. 萃取 D. 盐析
您最近半年使用:0次
名校
解题方法
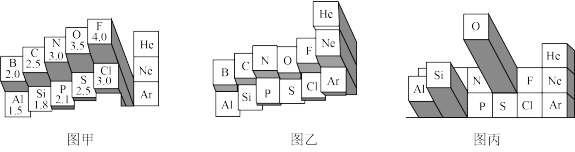
7 . 元素周期表有多种形式。如图分别是两种不同形式元素周期表的局部区域。_______ (选填“金属性”或“非金属性”)越大。
②根据图甲中的信息判断,下列物质中含有离子键的是_______ 。
A.AlF3 B.AlCl3 C.Al2O3 D.Al2S3
(2)①图乙所示第二周期元素中,某一元素的该性质反常偏高,原因是_______ 。
②若将下列元素在图乙中排列,位置最低的元素是_______ 。
A.Na B.K C.Mg D.Ca
(3)图丙表示含义的是元素_______ 。
(4)①图中能正确表示基态N原子轨道表示式的是_______ 。_______ 。
A.能量最低原理 B.泡利原理 C.洪特规则
③基态N原子核外电子共有_______ 种不同的运动状态。
(5)同压下,部分氟化物的熔点见表:
①NaF、MgF2的熔点存在差异的原因是________ 。
②SiF4的熔点明显低于NaF、MgF2,原因是________ 。
②根据图甲中的信息判断,下列物质中含有离子键的是
A.AlF3 B.AlCl3 C.Al2O3 D.Al2S3
(2)①图乙所示第二周期元素中,某一元素的该性质反常偏高,原因是
②若将下列元素在图乙中排列,位置最低的元素是
A.Na B.K C.Mg D.Ca
(3)图丙表示含义的是元素
| A.原子半径 | B.第一电离能 | C.电负性 | D.在地壳中的含量 |
(4)①图中能正确表示基态N原子轨道表示式的是
A.  B.
B.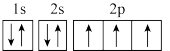
A.能量最低原理 B.泡利原理 C.洪特规则
③基态N原子核外电子共有
(5)同压下,部分氟化物的熔点见表:
| 氟化物 | NaF | MgF2 | SiF4 |
| 熔点/℃ | 1266 | 1534 | 183 |
②SiF4的熔点明显低于NaF、MgF2,原因是
您最近半年使用:0次
名校
解题方法
8 . 铁和硒都是人体所必需的微量元素,且在医药、催化、材料等领域有广泛应用。乙烷硒啉(Ethaselen)是一种抗癌新药,其结构如下:
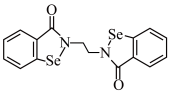
(1)基态Se原子的核外电子排布式为[Ar]_______ ,其核外有_______ 种不同能量的电子;该新药分子中的H被1个Cl取代,其可能的产物有_______ 种。
(2)在对电子运动状态的描述中,确定1个“轨道”的方面包括_______。
①电子层 ②电子云形状 ③电子云的伸展方向 ④电子的自旋
(3)比较键角大小:气态SeO3分子_______  离子(填“>”“<”或“=”)。
离子(填“>”“<”或“=”)。
(4)过渡元素离子一般能形成多种配位化合物。[Cr(NH3)3(H2O)2Cl]2+中提供电子对形成配位键的原子或离子是_______ 。
(5)富马酸亚铁FeC4H2O4是一种补铁剂。富马酸分子的结构模型如下图所示:

富马酸分子中σ键与π键的数目比为___ ,富马酸亚铁中各元素的电负性由大到小的顺序为___

(1)基态Se原子的核外电子排布式为[Ar]
(2)在对电子运动状态的描述中,确定1个“轨道”的方面包括_______。
①电子层 ②电子云形状 ③电子云的伸展方向 ④电子的自旋
| A.①②③④ | B.①②③ | C.①② | D.① |
 离子(填“>”“<”或“=”)。
离子(填“>”“<”或“=”)。(4)过渡元素离子一般能形成多种配位化合物。[Cr(NH3)3(H2O)2Cl]2+中提供电子对形成配位键的原子或离子是
(5)富马酸亚铁FeC4H2O4是一种补铁剂。富马酸分子的结构模型如下图所示:

富马酸分子中σ键与π键的数目比为
您最近半年使用:0次
解题方法
9 . 砷元素(As)广泛分布于自然界中,土壤、水体、矿物和生物体内都含有微量的砷。工业上提取砷的某步反应如下:

(1)砷元素在周期表中的位置是___________ 。
(2)沸点:AsH3___________ NH3,原因是___________ 。
A.> B.<
(3)关于I~Ⅳ四种物质的说法正确的是___________。
(4)已知H3AsO3为三元弱酸,则分子中As原子存在___________ 对孤电子对,AsO 的空间构型为
的空间构型为___________ 。
A.正四面体 B.三角锥形 C.角形
(5)溶解于水中的H3AsO4存在如下平衡:H3AsO4 H2AsO
H2AsO +H+,H2AsO
+H+,H2AsO
 HAsO
HAsO +H+,HAsO
+H+,HAsO
 AsO
AsO +H+。目前常用吸附法消除水中的砷,已知pH越大,吸附剂表面带的负电荷越多。分析吸附剂对砷的吸附量随pH升高而下降的原因
+H+。目前常用吸附法消除水中的砷,已知pH越大,吸附剂表面带的负电荷越多。分析吸附剂对砷的吸附量随pH升高而下降的原因___________ 。
(6)砷和镍(Ni)形成某种晶体的晶胞如图1所示,图2为该晶胞的俯视投影图。
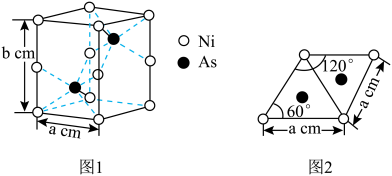
该晶胞中含有___________ 个Ni原子。该晶体的密度 ρ =___________ g·cm-3。(设NA为阿伏加德罗常数,该晶体的摩尔质量为M g·mol-1,用含 a、b、M和NA的代数式表示。)

(1)砷元素在周期表中的位置是
(2)沸点:AsH3
A.> B.<
(3)关于I~Ⅳ四种物质的说法正确的是___________。
| A.I中仅有σ键 | B.Ⅱ中部分元素的第一电离能: (O)> (O)> (S) (S) |
| C.Ⅲ中含有的元素中砷的电负性最大 | D.Ⅳ中含有的化学键为离子键、共价键 |
(4)已知H3AsO3为三元弱酸,则分子中As原子存在
 的空间构型为
的空间构型为A.正四面体 B.三角锥形 C.角形
(5)溶解于水中的H3AsO4存在如下平衡:H3AsO4
 H2AsO
H2AsO +H+,H2AsO
+H+,H2AsO
 HAsO
HAsO +H+,HAsO
+H+,HAsO
 AsO
AsO +H+。目前常用吸附法消除水中的砷,已知pH越大,吸附剂表面带的负电荷越多。分析吸附剂对砷的吸附量随pH升高而下降的原因
+H+。目前常用吸附法消除水中的砷,已知pH越大,吸附剂表面带的负电荷越多。分析吸附剂对砷的吸附量随pH升高而下降的原因(6)砷和镍(Ni)形成某种晶体的晶胞如图1所示,图2为该晶胞的俯视投影图。

该晶胞中含有
您最近半年使用:0次
名校
解题方法
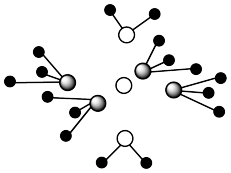
10 . 铜离子可与含N、含O的微粒形成多种结构。向CuSO4溶液中滴加氨水可最终形成如图所示的配离子。

(1)图中微粒的化学式为
A.1mol该微粒中有22mol共价键
B.该微粒中的N、O原子构成了立方体结构
C.电负性N>O>H
D.该微粒中可与溶剂水分子形成氢键的只有N、O原子
(2)铜元素位于元素周期表的
A.s区 B.p区 C.ds区 D.f区
铜原子
(3)Cu2+无法与BF3中的B原子形成配位键的原因是
(4)请在图中用规范的化学符号表示该微粒中的所有配位键
(5)Cu2+可形成如图所示晶体。该晶胞中

①该晶体中距Fe3+最近且等距的Cu2+有
②已知相邻的Fe3+与Cu2+核间距为apm,则相邻的Fe3+与K+核间距为
③该晶体的化学式为
您最近半年使用:0次



