1 . 原子序数依次递增且都小于36的A、B、C、D、E五种元素,其中A的一种核素中没有中子,B原子基态时最外层电子数是其内层电子数的2倍,D原子基态时2p原子轨道上有2个未成对的电子,E元素的原子结构中3d能级上未成对电子数是成对电子数的2倍。回答下列问题:
(1)A、B、C、D四种元素的电负性从大到小的顺序为___________ (用元素符号表示);化合物 的沸点比化合物
的沸点比化合物 的高,其主要原因是
的高,其主要原因是___________ 。
(2)元素E能形成多种配合物,如: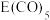 等。
等。
①基态E原子的价电子排布式为___________ 。
②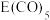 常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断
常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断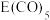 晶体属于
晶体属于___________ (填晶体类型),该晶体中E的化合价为___________ 。
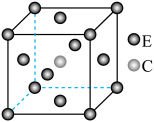
(3)E和C形成的一种化合物的晶胞结构如图所示,该晶胞的化学式为___________ 。若两个最近的E原子间的距离为 ,则该晶体的密度是
,则该晶体的密度是___________  。
。
(1)A、B、C、D四种元素的电负性从大到小的顺序为
 的沸点比化合物
的沸点比化合物 的高,其主要原因是
的高,其主要原因是(2)元素E能形成多种配合物,如:
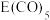 等。
等。①基态E原子的价电子排布式为
②
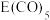 常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断
常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断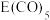 晶体属于
晶体属于(3)E和C形成的一种化合物的晶胞结构如图所示,该晶胞的化学式为
 ,则该晶体的密度是
,则该晶体的密度是 。
。
您最近半年使用:0次
2 . 下列元素或化合物的性质变化顺序不正确的是
A.第一电离能: |
B.电负性: |
C.价层电子对互斥理论中, 键电子对数计入中心原子的价层电子对数 键电子对数计入中心原子的价层电子对数 |
| D.第四周期元素中,锰原子价电子层中未成对电子数最多 |
您最近半年使用:0次
名校
解题方法
3 . 物质的结构决定其性质。下列事实与解释相符的是
| 选项 | 事实 | 解释 |
| A | 一氟乙酸的 大于一溴乙酸 大于一溴乙酸 |  的电负性比 的电负性比 的大 的大 |
| B |  原子间难以形成 原子间难以形成 键 键 |  的原子半径较大,未杂化的 的原子半径较大,未杂化的 轨道很难重叠 轨道很难重叠 |
| C |  是非极性分子 是非极性分子 |  原子处在4个 原子处在4个 原子所组成的正方形中心,键的极性的向量和为零 原子所组成的正方形中心,键的极性的向量和为零 |
| D | 干冰的熔点低于 | 2个 键的键能之和小于4个 键的键能之和小于4个 键的键能之和 键的键能之和 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
名校
4 . X、Y、Z、W为原子序数依次增大的短周期元素,基态Y原子的s能级电子数是p能级的2倍,基态W原子的电子总数是其最高能级电子数的2倍,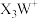 是10电子微粒,可形成离子液体
是10电子微粒,可形成离子液体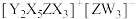 。下列说法正确的是
。下列说法正确的是
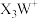 是10电子微粒,可形成离子液体
是10电子微粒,可形成离子液体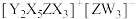 。下列说法正确的是
。下列说法正确的是| A.第一电离能:Y<W<Z | B. 与 与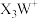 的空间结构相同 的空间结构相同 |
C.键能: | D. 中存在 中存在 键、氢键和配位键 键、氢键和配位键 |
您最近半年使用:0次
2024-04-17更新
|
598次组卷
|
3卷引用:山东省淄博市2024届高三一模化学试题
山东省淄博市2024届高三一模化学试题(已下线)题型5 物质结构与性质 有机物的结构与性质(25题)-2024年高考化学常考点必杀300题(新高考通用)四川省射洪中学校2023-2024学年高二下学期4月月考化学试题
名校
解题方法
5 . 优氯净(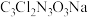 )是常用的杀菌消毒剂。下列与优氯净组成元素有关的说法正确的是
)是常用的杀菌消毒剂。下列与优氯净组成元素有关的说法正确的是
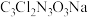 )是常用的杀菌消毒剂。下列与优氯净组成元素有关的说法正确的是
)是常用的杀菌消毒剂。下列与优氯净组成元素有关的说法正确的是| A.电负性:O>N>C | B.原子半径:Cl>Na>O |
| C.O在周期表中的位置是第2周期ⅣA族 | D.热稳定性: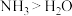 |
您最近半年使用:0次
2024-04-11更新
|
91次组卷
|
2卷引用:山东省鄄城县第一中学2023-2024学年高二下学期3月月考化学试题
名校
6 . “点击化学”研究获得2022年诺贝尔化学奖,用该原理可制得如图含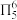 大
大 键的产物。已知杂化轨道中s成分越多,所形成的化学键越稳定。下列说法错误为是
键的产物。已知杂化轨道中s成分越多,所形成的化学键越稳定。下列说法错误为是
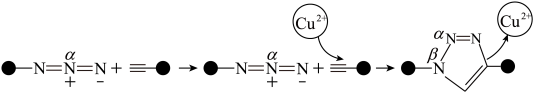
 大
大 键的产物。已知杂化轨道中s成分越多,所形成的化学键越稳定。下列说法错误为是
键的产物。已知杂化轨道中s成分越多,所形成的化学键越稳定。下列说法错误为是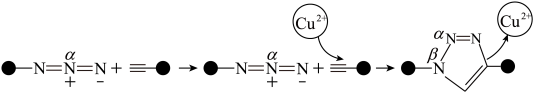
| A.铜离子增大了反应的活化能 |
| B.反应物中黑球元素的电负性强于N |
C.产物中 、 、 两位置中的N原子中, 两位置中的N原子中, 位置的N原子更容易形成配位键 位置的N原子更容易形成配位键 |
| D.反应物中氮氮键比产物中氮氮键的键长短 |
您最近半年使用:0次
名校
解题方法
7 . FeSO4·7H2O的结构如图,下列说法错误的是
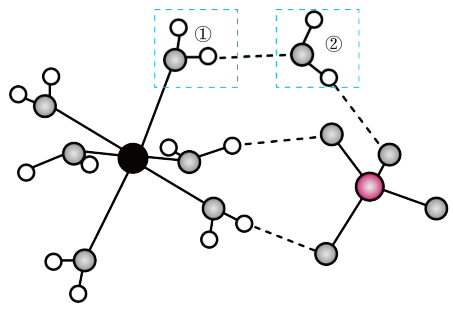

| A.键角:①>② | B.H2O与Fe2+、H2O与 的作用力类型相同 的作用力类型相同 |
| C.Fe2+的配位数是6 | D.电负性:O>S>H |
您最近半年使用:0次
名校
解题方法
8 . 某种合成医药、农药的中间体W结构如图所示,其中X、Y、Z、M、R均为短周期元素,原子序数依次增大。下列说法错误的是
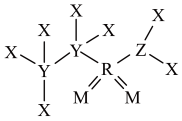
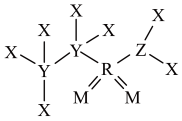
| A.简单氢化物沸点:Y<Z | B.电负性:M>Z>Y |
| C.第一电离能:Y<Z<M | D.W分子中R的杂化方式为sp3 |
您最近半年使用:0次
名校
解题方法
9 . Zn、Fe、Cu、Cr等过渡金属的原子或离子易通过配位键形成配合物或配离子。回答下列问题:
I.一种比率光声探针M与 配位,可用于小鼠脑内铜(Ⅱ)的高时空分辨率动态成像,反应如下所示:
配位,可用于小鼠脑内铜(Ⅱ)的高时空分辨率动态成像,反应如下所示:

(1)H、C、N、F四种元素电负性由小到大的顺序为_______ , 中键角F-B-F
中键角F-B-F_______ M中键角F-B-F(填“>”、“<”或“=”)。
(2)As与N为同一主族元素,有机酸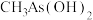 的沸点比
的沸点比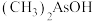 高的原因是
高的原因是_______ 。
(3)将含有未成对电子的物质置于外磁场中,会使磁场强度增大,称其为顺磁性物质,下列物质中,属于顺磁性物质的是_______。
Ⅱ. 的结构如下图所示。
的结构如下图所示。
(4)与Fe最外层电子数相同且同周期的元素有_______ 种。
(5)图示 结构中键角1、2、3由大到小的顺序是
结构中键角1、2、3由大到小的顺序是_______ (填序号)。
Ⅲ.一种立方钙钛矿型晶体 有两种晶胞结构,其俯视图如下(重叠处仅画出大的微粒),La的配位数均是12。
有两种晶胞结构,其俯视图如下(重叠处仅画出大的微粒),La的配位数均是12。
(6)图a的晶胞参数为xpm,则O与O的最小核间距为_______ pm;图b晶胞中O的位置为_______ (填“体心”“顶点”“面心”“棱心”)。
(7)晶胞经掺杂后能提高红外辐射效率。由图a晶胞堆叠形成的2×2×2超晶胞中一个La原子被Sr代替,则掺杂后晶体化学式为_______ 。
I.一种比率光声探针M与
 配位,可用于小鼠脑内铜(Ⅱ)的高时空分辨率动态成像,反应如下所示:
配位,可用于小鼠脑内铜(Ⅱ)的高时空分辨率动态成像,反应如下所示:
(1)H、C、N、F四种元素电负性由小到大的顺序为
 中键角F-B-F
中键角F-B-F(2)As与N为同一主族元素,有机酸
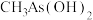 的沸点比
的沸点比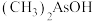 高的原因是
高的原因是(3)将含有未成对电子的物质置于外磁场中,会使磁场强度增大,称其为顺磁性物质,下列物质中,属于顺磁性物质的是_______。
A. | B. |
C. | D. |
Ⅱ.
 的结构如下图所示。
的结构如下图所示。
(4)与Fe最外层电子数相同且同周期的元素有
(5)图示
 结构中键角1、2、3由大到小的顺序是
结构中键角1、2、3由大到小的顺序是Ⅲ.一种立方钙钛矿型晶体
 有两种晶胞结构,其俯视图如下(重叠处仅画出大的微粒),La的配位数均是12。
有两种晶胞结构,其俯视图如下(重叠处仅画出大的微粒),La的配位数均是12。
(6)图a的晶胞参数为xpm,则O与O的最小核间距为
(7)晶胞经掺杂后能提高红外辐射效率。由图a晶胞堆叠形成的2×2×2超晶胞中一个La原子被Sr代替,则掺杂后晶体化学式为
您最近半年使用:0次
名校
解题方法
10 . 物质的光学性质在科研中有重要的用途。回答下列问题:
Ⅰ.一种比率光声探针M与Cu2+配位,可用于小鼠脑内铜(Ⅱ)的高时空分辨率动态成像,反应如下所示:
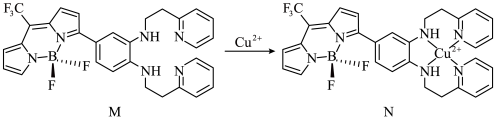
(1)H、C、N、F四种元素电负性由大到小的顺序为___________ ,M中键角F-B-F___________  中键角F-B-F(填“>”、“<”或“=”);基态
中键角F-B-F(填“>”、“<”或“=”);基态 的价电子中,两种自旋状态的电子数之比为
的价电子中,两种自旋状态的电子数之比为___________ 。
(2)均为平面结构的吡咯(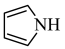 )和吡啶(
)和吡啶(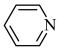 )是合成该探针的原料,吡咯和吡啶在盐酸中溶解度较大的为
)是合成该探针的原料,吡咯和吡啶在盐酸中溶解度较大的为___________ ,原因是___________ 。
Ⅱ.铪(Hf)的卤化物八面体离子是构建卤化物钙钛矿的基本发光单元,其构建的某晶胞结构如图所示。
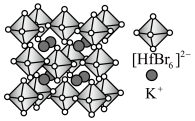
(3)该晶胞中 的配位数为
的配位数为___________ ,阴离子形成的八面体空隙有___________ 个。
(4)该晶体的密度为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则Hf-Hf最近距离为
,则Hf-Hf最近距离为___________ nm。
Ⅰ.一种比率光声探针M与Cu2+配位,可用于小鼠脑内铜(Ⅱ)的高时空分辨率动态成像,反应如下所示:

(1)H、C、N、F四种元素电负性由大到小的顺序为
 中键角F-B-F(填“>”、“<”或“=”);基态
中键角F-B-F(填“>”、“<”或“=”);基态 的价电子中,两种自旋状态的电子数之比为
的价电子中,两种自旋状态的电子数之比为(2)均为平面结构的吡咯(
 )和吡啶(
)和吡啶( )是合成该探针的原料,吡咯和吡啶在盐酸中溶解度较大的为
)是合成该探针的原料,吡咯和吡啶在盐酸中溶解度较大的为Ⅱ.铪(Hf)的卤化物八面体离子是构建卤化物钙钛矿的基本发光单元,其构建的某晶胞结构如图所示。

(3)该晶胞中
 的配位数为
的配位数为(4)该晶体的密度为
 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则Hf-Hf最近距离为
,则Hf-Hf最近距离为
您最近半年使用:0次
2024-04-08更新
|
923次组卷
|
3卷引用:山东省烟台市2024届高三一模化学试题



