名校
解题方法
1 . 优氯净(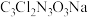 )是常用的杀菌消毒剂。下列与优氯净组成元素有关的说法正确的是
)是常用的杀菌消毒剂。下列与优氯净组成元素有关的说法正确的是
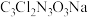 )是常用的杀菌消毒剂。下列与优氯净组成元素有关的说法正确的是
)是常用的杀菌消毒剂。下列与优氯净组成元素有关的说法正确的是| A.电负性:O>N>C | B.原子半径:Cl>Na>O |
| C.O在周期表中的位置是第2周期ⅣA族 | D.热稳定性: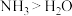 |
您最近半年使用:0次
2024-04-11更新
|
98次组卷
|
2卷引用:山东省鄄城县第一中学2023-2024学年高二下学期3月月考化学试题
2 . 短周期元素可形成许多结构和性质不同的化合物,回答下列问题:

(1) 是一种甲基化试剂,能发生水解反应
是一种甲基化试剂,能发生水解反应 ;
; 的水解产物为
的水解产物为_____ (填化学式)。
(2) 是共价化合物,可以形成二聚体和多聚体
是共价化合物,可以形成二聚体和多聚体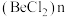 ,二聚体中
,二聚体中 的杂化方式为
的杂化方式为 ,二聚体的结构式为
,二聚体的结构式为_____ 。
(3)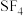 分子的电子对空间构型为三角双锥,排布方式有两种,结构如图。根据价层电子对互斥理论中:“孤电子对一成键电子对”分布在互成
分子的电子对空间构型为三角双锥,排布方式有两种,结构如图。根据价层电子对互斥理论中:“孤电子对一成键电子对”分布在互成 的方向上时斥力最大,判断
的方向上时斥力最大,判断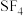 应采用结构
应采用结构_____ (填“a”或“b”)。
(4) 在水溶液中显蓝色,加入过量的氨水后变为深蓝色,原因是生成了
在水溶液中显蓝色,加入过量的氨水后变为深蓝色,原因是生成了_____ (填化学式),比较它与 的稳定性并说明理由
的稳定性并说明理由_____ 。
(5)在超高压下,金属钠和氦可形成化合物。结构中的钠离子按简单立方排布,形成 立方体空隙如图,电子对
立方体空隙如图,电子对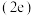 和氦原子交替分布填充在立方体的中心。若将氦原子放在晶胞顶点,则电子对
和氦原子交替分布填充在立方体的中心。若将氦原子放在晶胞顶点,则电子对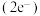 在该晶胞中的所有分数坐标除了
在该晶胞中的所有分数坐标除了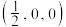 、
、 ,还有
,还有_____ ;若晶体的密度为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,晶胞的边长
,晶胞的边长
_____  (用含
(用含 的代数式表示)。
的代数式表示)。


(1)
 是一种甲基化试剂,能发生水解反应
是一种甲基化试剂,能发生水解反应 ;
; 的水解产物为
的水解产物为(2)
 是共价化合物,可以形成二聚体和多聚体
是共价化合物,可以形成二聚体和多聚体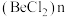 ,二聚体中
,二聚体中 的杂化方式为
的杂化方式为 ,二聚体的结构式为
,二聚体的结构式为(3)
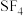 分子的电子对空间构型为三角双锥,排布方式有两种,结构如图。根据价层电子对互斥理论中:“孤电子对一成键电子对”分布在互成
分子的电子对空间构型为三角双锥,排布方式有两种,结构如图。根据价层电子对互斥理论中:“孤电子对一成键电子对”分布在互成 的方向上时斥力最大,判断
的方向上时斥力最大,判断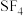 应采用结构
应采用结构(4)
 在水溶液中显蓝色,加入过量的氨水后变为深蓝色,原因是生成了
在水溶液中显蓝色,加入过量的氨水后变为深蓝色,原因是生成了 的稳定性并说明理由
的稳定性并说明理由(5)在超高压下,金属钠和氦可形成化合物。结构中的钠离子按简单立方排布,形成
 立方体空隙如图,电子对
立方体空隙如图,电子对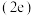 和氦原子交替分布填充在立方体的中心。若将氦原子放在晶胞顶点,则电子对
和氦原子交替分布填充在立方体的中心。若将氦原子放在晶胞顶点,则电子对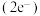 在该晶胞中的所有分数坐标除了
在该晶胞中的所有分数坐标除了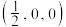 、
、 ,还有
,还有 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,晶胞的边长
,晶胞的边长
 (用含
(用含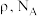 的代数式表示)。
的代数式表示)。
您最近半年使用:0次
名校
解题方法
3 . 下列关于物质结构和性质的说法正确的是
A.第2周期元素中,第一电离能介于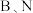 之间的有1种 之间的有1种 |
B.酸性: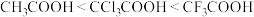 |
C. 与 与 中心原子的杂化方式相同,均为 中心原子的杂化方式相同,均为 形结构 形结构 |
D.乙二胺 的沸点比三甲胺 的沸点比三甲胺 高的原因是乙二胺存在分子间氢键,三甲胺存在分子内氢键 高的原因是乙二胺存在分子间氢键,三甲胺存在分子内氢键 |
您最近半年使用:0次
2024-03-21更新
|
510次组卷
|
3卷引用:山东省菏泽市2024届高三一模考试化学试题
4 . 磷酸铁锂(LiFePO4)电极材料主要用于各种锂离子电池。回答下列问题。
(1)Fe 位于元素周期表中第_______ 周期第_______ 族,其价层电子排布式为_______ 。
(2)用“>”“<”或“=”填空:离子半径:Li+_______ H-;第一电离能:Li_______ Be;电负性:O_______ P。
(3)下列 Li 原子轨道表示式表示的状态中,能量最低和最高的分别为_______ 、_______ (填字母)。
A.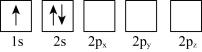 B.
B.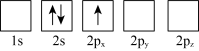
C. D.
D.
(4)基态 P 中未成对电子数为_______ ,其原子核外电子占据的最高能级的电子云轮廓图为_______ 形。
(1)Fe 位于元素周期表中第
(2)用“>”“<”或“=”填空:离子半径:Li+
(3)下列 Li 原子轨道表示式表示的状态中,能量最低和最高的分别为
A.
 B.
B.
C.
 D.
D.
(4)基态 P 中未成对电子数为
您最近半年使用:0次
5 . 锂电池中电解液的阻燃剂的结构式如图所示,其中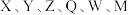 是原子序数依次增大的短周期主族元素。下列说法正确的是
是原子序数依次增大的短周期主族元素。下列说法正确的是
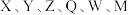 是原子序数依次增大的短周期主族元素。下列说法正确的是
是原子序数依次增大的短周期主族元素。下列说法正确的是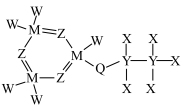
A.元素的第一电离能: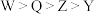 |
B.元素的电负性: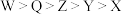 |
C.最高价氧化物对应的水化物的酸性: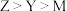 |
D.基态原子未成对电子数: |
您最近半年使用:0次
2024-03-03更新
|
216次组卷
|
2卷引用:山东省菏泽市东明县第一中学2023-2024学年高三下学期开学化学试题
名校
解题方法
6 . 《中华本草》中记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症等。下列叙述正确的是
| A.Zn的核外电子排布式为3d104s2 |
| B.ZnCO3中阴离子空间结构为平面正三角形 |
| C.ZnCO3中C的杂化方式为sp3 |
| D.电负性:Zn>C>O |
您最近半年使用:0次
2024-02-11更新
|
178次组卷
|
2卷引用:山东省菏泽市鄄城县第一中学2023-2024学年高二上学期1月期末化学试题
名校
解题方法
7 . X、Y、Z、W、R为原子序数依次增大的前四周期元素。基态X原子的价电子排布式为nsnnpn+1;Y的+2价阳离子核外电子排布与氖原子相同;Z元素的第一至第四电离能分别是:I1=578kJ∙mol-1、I2=1817kJ∙mol-1、I3=2745kJ∙mol-1、I4=11575kJ∙mol-1;W的最高正价与最低负价的代数和为6:基态R2+的M层有5个未成对电子。
回答下列问题:
(1)R元素在元素周期表中的位置为___________ ,原子序数比R少1的元素原子基态核外排布式为:___________ 。
(2)元素的气态原子得到一个电子所放出的能量称为第一电子亲合能。气态原子结合电子越容易,电子亲合能越大。X和W的第一电子亲合能X___________ W(填“>”或“<”),利用原子结构知识解释原因___________ 。
(3)X、Z、W的简单离子半径由大到小的顺序是___________ (填离子符号)。
(4)Z单质与NaOH反应的离子反应方程式为___________ 。
回答下列问题:
(1)R元素在元素周期表中的位置为
(2)元素的气态原子得到一个电子所放出的能量称为第一电子亲合能。气态原子结合电子越容易,电子亲合能越大。X和W的第一电子亲合能X
(3)X、Z、W的简单离子半径由大到小的顺序是
(4)Z单质与NaOH反应的离子反应方程式为
您最近半年使用:0次
8 . IIIA族元素及其化合物在材料化学中具有广泛的应用。回答下列问题:
(1)基态硼原子核外价电子的轨道表示式为___________ 。
(2)氨硼烷(NH3BH3)是目前最具潜力的储氢材料之一、氨硼烷分子中与N相连的H呈正电性,与B原子相连的H呈负电性,它们之间存在静电相互吸引作用,称为双氢键。NH3BH3所含元素电负性由大到小的顺序为___________ ;还原性:NH3BH3___________ NH3(填“>”或“<”)。
(3)N、O、F三元素对应氢化物的稳定性有强到弱的顺序为___________ (用化学式表示)。
(4)基态铝原子核外有___________ 个空间运动状态,第一电离能介于Al、P之间的第3周期元素有___________ 种。
(1)基态硼原子核外价电子的轨道表示式为
(2)氨硼烷(NH3BH3)是目前最具潜力的储氢材料之一、氨硼烷分子中与N相连的H呈正电性,与B原子相连的H呈负电性,它们之间存在静电相互吸引作用,称为双氢键。NH3BH3所含元素电负性由大到小的顺序为
(3)N、O、F三元素对应氢化物的稳定性有强到弱的顺序为
(4)基态铝原子核外有
您最近半年使用:0次
2024-01-23更新
|
177次组卷
|
2卷引用:山东省菏泽市东明县第一中学2023-2024学年高二上学期12月月考化学试题
名校
解题方法
9 . 下列曲线表示第ⅦA族元素(F、 、I)性质随其质子数的变化趋势,错误的是
、I)性质随其质子数的变化趋势,错误的是
 、I)性质随其质子数的变化趋势,错误的是
、I)性质随其质子数的变化趋势,错误的是A.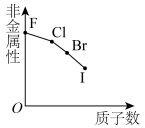 | B. |
C.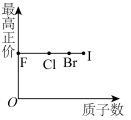 | D.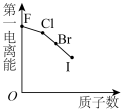 |
您最近半年使用:0次
2023-12-26更新
|
229次组卷
|
7卷引用:山东省菏泽市鄄城县第一中学2023-2024学年高二上学期1月期末化学试题
山东省菏泽市鄄城县第一中学2023-2024学年高二上学期1月期末化学试题青海省海南州高级中学、共和县高级中学2023-2024学年高二上学期期中联考化学试题江西省部分学校2023-2024学年高二上学期1月期末化学试题(已下线)1.2.2 元素周期律(基础)(已下线)名校期中好题汇编-原子结构与性质(选择题)名校期中好题汇编-原子结构与性质(选择题)黑龙江省绥化市绥棱县第一中学2023-2024学年高二下学期开学化学试题
10 . 前四周期元素X、Y、Z、W的原子序数依次增大,X原子中有6个运动状态不同的电子,Y是地壳中含量最多的元素,基态Z原子K、L层上的电子总数是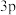 原子轨道上电子数的两倍,基态W原子中有6个未成对电子。下列说法错误的是
原子轨道上电子数的两倍,基态W原子中有6个未成对电子。下列说法错误的是
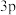 原子轨道上电子数的两倍,基态W原子中有6个未成对电子。下列说法错误的是
原子轨道上电子数的两倍,基态W原子中有6个未成对电子。下列说法错误的是A.电负性: ,原子半径: ,原子半径: | B.同周期中,元素Z的第一电离能最大 |
C.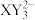 离子中存在 离子中存在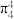 的离域π键 的离域π键 | D.在一定条件下,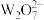 和 和 均具有强氧化性 均具有强氧化性 |
您最近半年使用:0次



